| |
| Med Sci (Paris). 2004 June; 20(6-7): 710–714. Published online 2004 June 15. doi: 10.1051/medsci/2004206-7710.Le myocyte cardiaque adulte peut-il encore proliférer ? Bernard Swynghedauw* Inserm U.572, Hôpital Lariboisière, 41, boulevard de la Chapelle, 75475 Paris Cedex 10, France |
La croissance et la prolifération postnatale sont des caractéristiques essentielles des myocytes cardiaques qui permettent au cœur d’adapter progressivement sa masse à la demande hémodynamique. Mais, une fois l’âge adulte atteint, l’arrêt des divisions semble être un mal nécessaire au maintien de la stabilité des fonctions électriques et mécaniques du myocarde. Les myocytes cardiaques ont-ils toutefois gardé la capacité de proliférer ? La question est, pour plusieurs raisons, loin d’être académique. Ainsi, en cas d’infarctus du myocarde, c’est-à-dire de mort par ischémie d’un certain nombre de cellules myocardiques, la capacité conservée des myocytes à proliférer permettrait d’envisager la régénération spontanée ou provoquée de la zone infarcie, en totalité ou en partie. En revanche, en cas d’incapacité des myocytes à proliférer, la fibrose réparatrice serait la seule possibilité de limiter les dégâts, et la transplantation d’un nouveau cœur, ou l’injection de cellules progénitrices, le seul moyen de rétablir la situation [
1] (‹). (‹) m/s 2004, n° 6-7, p. 651
|
La capacité des myocytes cardiaques à proliférer est limitée En milieu de gestation, la prolifération des cardiomyocytes est de 33 %, contre 2 % seulement à la naissance. Karyocinèse et cytocinèse sont dissociées après la naissance et, selon les espèces, il apparaît des cellules polynucléées, binucléées le plus souvent [
2], ou polyploïdes [
3]. L’arrêt du cycle cellulaire est sous le contrôle de deux familles fonctionnelles distinctes de protéines kinases inhibitrices dépendant des cyclines, Ink4 et Cip/Kip, lesquelles bloquent l’activation de l’ADN polymérase [2] ; peu d’informations sont disponibles sur le fonctionnement de ces deux familles d’inhibiteurs au sein du myocarde jeune ou adulte [
4]. L’hypothèse d’un arrêt du cycle cellulaire a également été renforcée par le fait que la survenue d’un cancer du myocarde est exceptionnelle et, en tous les cas, jamais d’origine myocytaire. Sur ce point, le myocarde est radicalement différent du muscle squelettique. L’expérience cruciale, ancienne, est celle du groupe de Radovan Zak [
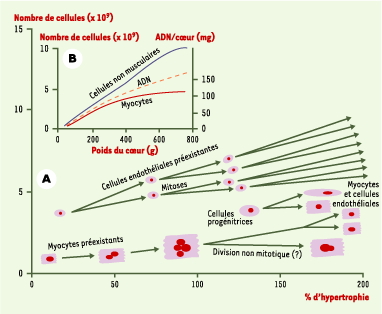
5] à Chicago. Chez le rat, après une sténose de l’aorte, le cœur s’hypertrophie et la concentration en ADN du cœur reste inchangée ; la masse myocardique totale en ADN est donc augmentée, puisque le cœur est plus gros. Cette augmentation de la synthèse d’ADN n’est pas due à une multiplication des myocytes, dont le nombre ne change pas, mais à une multiplication des cellules non musculaires dont le nombre a doublé et qui sont les seules à incorporer en excès un précurseur radioactif de l’ADN. Néanmoins, un certain nombre de noyaux myocytaires (< 2 %) sont polyploïdes (par un mécanisme d’endoréplication de l’ADN, non mitotique, qui ne s’accompagne en principe pas de divisions cellulaires) à l’état normal, et ce pourcentage augmente, bien que faiblement (jusqu’à 4 %), après sténose aortique (Figure 1).
 | Figure 1. Modes de prolifération des cellules du myocarde adulte en fonction du degré d’hypertrophie du cœur. A. En bas : les myocytes s’hypertrophient progressivement en même temps que le degré de polyploïdie des noyaux croît ; il est possible que, dans les très gros cœurs, surviennent des divisions non mitotiques. Les cellules progénitrices pluripotentes de la circulation s’incorporent dans le myocarde très hypertrophié pour y former des myocytes et des cellules endothéliales. Au-dessus : les cellules endothéliales préexistantes ont gardé la capacité de proliférer. B. La masse en ADN croît avec le degré d’hypertrophie, cette augmentation étant surtout le fait d’une augmentation du nombre de cellules non musculaires. |
Chez l’homme, à l’état normal, le pourcentage de myocytes possédant un noyau polyploïde est élevé (jusqu’à 72 % de noyaux tétraploïdes). Ce pourcentage, ainsi que le degré de polyploïdie, augmentent très significativement en cas de surcharge mécanique (55 % des noyaux deviennent ainsi octoploïdes) [3]. Ce phénomène n’est pas propre au cœur humain : les cardiomyocytes de porc, par exemple, s’ils n’ont pas de noyaux polyploïdes, possèdent plusieurs noyaux, et le nombre de cellules polynucléées croît après surcharge cardiaque. Cette endoréplication de l’ADN conduit-elle à des divisions non mitotiques ? Oui, a répondu il y a longtemps Linzbach, sur la foi d’images un peu contestables d’étirements des myocytes [
7] ; mais comment démontrer, sur des pièces d’autopsie, que les divisions, si elles existent, se font sans mitose ? Identifier des mitoses en activité sur ce type de matériel n’est déjà pas facile. Plusieurs études, essentiellement planimétriques, ont mis en évidence une augmentation, probablement limitée, du nombre de myocytes dans les hypertrophies cardiaques extrêmes. Elles ont même permis de définir un seuil, autour de 600 g (le cœur humain pèse normalement environ 250 g), au-delà duquel les myocytes sont non seulement hypertrophiés, mais aussi plus nombreux [
6]. D’autres ont montré, chez l’animal, que les myocytes cardiaques adultes avaient probablement la possibilité de se diviser, et de rares images mitotiques ont même été observées [
8]. Au demeurant, cette possibilité semble limitée, et très en-deçà des besoins fonctionnels de ces myocardes parvenus au stade ultime de leurs capacités. Le problème est ainsi double : il est presque impossible de détecter des mitoses, rares, sur pièces d’autopsie, et l’on ne peut que se fonder sur des arguments indirects ; il est par ailleurs tout aussi difficile de connaître le réel impact qu’une telle prolifération pourrait avoir sur la fonction cardiaque [8]. Le monde scientifique a la mémoire courte, et ce qui est bien connu depuis quarante ans a été redécouvert par un leader particulièrement brillant et agressif, Piero Anversa, au moyen de techniques plus performantes et d’une superbe imagerie [
9,
10]. Les myocytes entrés en cycle de division cellulaire sont identifiés en microscopie confocale grâce à leur marquage par l’antigène nucléaire Ki-67 : cette protéine s’exprime à toutes les phases du cycle cellulaire, excepté en G0, et favorise la prolifération cellulaire en interférant avec la formation de la liaison entre la protéine p53 et l’ADN. Ce premier marquage est complété par une identification directe des mitoses au moyen d’anticorps anti-tubuline. Les auteurs trouvent ainsi 11 myocytes ayant un indice mitotique positif pour 106 myocytes chez les sujets témoins, contre 200 à 800/106, soit 1 % à 4 % des myocytes, dans le voisinage de la zone infarcie 4 à 12 jours après un infarctus. Deux question essentielles restent sans réponse : ce phénomène est-il fonctionnellement significatif, et quels sont ces myocytes qui « se réveillent » ? Après des calculs fondés sur plusieurs a priori concernant, en particulier, la vitesse du cycle cellulaire et la durée des périodes intercycles, les indices mitotiques relevés permettent à ces auteurs d’affirmer qu’il existe environ 700 000 à 800 000 myocytes en cours de division mitotique dans un ventricule au stade d’insuffisance cardiaque et jusqu’à 2 millions dans la périphérie d’un infarctus du myocarde, contre 60 000 à 80 000 chez les sujets témoins [8, 9]. Stricto sensu, cela voudrait dire que la régénération devrait jouer un rôle déterminant dans le pronostic de l’insuffisance cardiaque et que tous les myocytes perdus au cours de l’accident ischémique devraient être remplacés en 18 jours. Or il n’en est rien. On peut par ailleurs émettre l’hypothèse que la régénération des cardiocytes serait directement liée à l’expression de gènes régulant l’apoptose comme Bcl-2 [
11], ce qui pourrait avoir un intérêt thérapeutique considérable. Si de nouveaux cardiomyocytes semblent donc pouvoir apparaître dans des situations extrêmes, il faut bien reconnaître qu’ils ne semblent pas jouer de rôle important sur le plan fonctionnel, et en particulier qu’ils n’empêchent ni l’apparition de l’hypertrophie compensatrice, ni celle de la fibrose qui se développe dans la zone ischémiée comme en périphérie (pour revue, voir [
12]) (‹), ni, finalement, l’issue fatale. (‹) m/s 2004, n° 6-7, p. 643
|
Mais, mêmes rares, d’où proviennent ces nouveaux myocytes ? En dehors de la main du chirurgien, il n’existe que deux possibilités : le myocarde préexistant et la circulation sanguine. Du myocarde préexistant ? La rareté des mitoses suggère qu’elles affectent une population particulière de cellules pluripotentes. Le bon exemple est donné par le muscle squelettique. Ce type de muscle, blessé, a la capacité de se régénérer ad integrum avec un minimum de fibrose, un maximum de nouveaux myocytes, et une fonction contractile qui revient rapidement à la normale [
13]. Cette régénération est le fait de cellules pluripotentes, dites satellites, ou myoblastes, qui sont de petites cellules accolées le long des myocytes adultes. Il n’y a pas aujourd’hui de preuve formelle de l’existence de telles cellules souches dans le myocarde, ni de critère morphologique permettant de les identifier, et la partie ischémiée du myocarde, ne se régénérant pas spontanément, fait place à une cicatrice fibreuse. Deux groupes différents, celui de Michael Schneider [
15,
16] et celui de Piero Anversa [
17,
18], ont identifié de telles cellules pluripotentes dans le myocarde adulte. Chez le rat adulte, une population de cellules Lin-c-kit POS a été isolée [17] ; ces cellules possèdent in vitro comme in vivo des propriétés analogues à celles des cellules souches : elles se divisent et sont multipotentes, pouvant se différencier en myocytes, en cellules endothéliales… Une fois injectées à du myocarde ischémié, elles peuvent reconstituer du myocarde normal. Des résultats comparables ont été obtenus chez l’homme. La surcharge mécanique active la production de ce type de cellules que l’on peut identifier et isoler grâce à un certain nombre de marqueurs de cellules souches (c-kit, MDR1, protéine Sca-1-réactive, concentration élevée de télomérase…). De la circulation ? Il existe également plusieurs arguments en faveur d’une origine circulatoire : la moelle osseuse contient des cellules souches pluripotentes, capables de se différencier et de fabriquer de l’os, du cartilage, des tendons… ; le sang circulant, lui-même, contient des cellules souches capables de restaurer l’hématopoïèse après destruction de la moelle osseuse ; enfin, ces cellules souches sanguines sont pluripotentes et capables de se différencier en hépatocytes ou en cellules épithéliales cutanées matures. Le cœur est constitué de myocytes et de cellules non musculaires, dont un grand nombre de cellules endothéliales. L’existence de cellules précurseurs des cellules endothéliales vasculaires dans la circulation ne fait plus guère de doute depuis leur isolement [
19]. Le taux de ces cellules circulantes est un marqueur du risque vasculaire et du dysfonctionnement endothélial [
20]. La plus convaincante des démonstrations a consisté à quantifier dans la circulation sanguine des cellules mononucléées progénitrices, c’est-à-dire exprimant des protéines endothéliales spécifiques telles que le récepteur vasculaire du facteur de croissance endothélial de type 2, et capables de pousser sur fibronectine. Si le nombre de ces colonies est, chez les sujets normaux, remarquablement corrélé avec les facteurs de risque classiques comme le cholestérol, le diabète ou l’hypertension, il est aussi directement proportionnel à la fonction endothéliale telle qu’on l’apprécie en mesurant l’effet vasodilatateur d’une compression artérielle standardisée. Il existe donc dans la circulation des cellules endothéliales progénitrices, en nombre particulièrement élevé chez les sujets à risque, c’est-à-dire chez ceux qui, précisément, ont un risque d’infarctus [20]. Ces cellules endothéliales circulantes sont-elles capables de s’implanter dans le myocarde, et qu’en est-il des myocytes ? La réponse vient des chimères réalisées au cours de transplantations d’organes lorsque le receveur est de sexe masculin et le donneur féminin (Figure 2). Le chromosome Y est identifiable par fluorescence au moyen de sondes ADN spécifiques comme le satellite CEP Y III, bien que cette identification ne soit pas très sensible (on ne trouve guère plus de 35 % de cellules positives chez des témoins masculins [
21]) et demande l’identification simultanée de la membrane basale [
22]. Des cellules endothéliales chimériques sont en effet retrouvées dans le myocarde 1 à 2 semaines après transplantation [19, 22]. En revanche, pour la plupart des auteurs [19–
23], à une exception près [
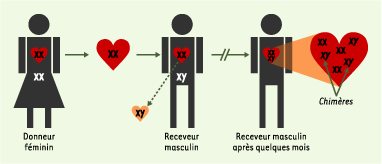
24], des myocytes chimériques n’ont jamais été retrouvés en quantité notable, même plusieurs années après la transplantation. L’identification de myocytes chimériques pose par ailleurs des problèmes techniques importants qui expliquent ces différences (discuté dans [22]).  | Figure 2. Mise en évidence de chimères lors de la transplantation d’un cœur féminin chez un receveur masculin. XX : chromosomes féminins ; XY : chromosomes masculins. |
|
La transplantation cellulaire Le pronostic après un infarctus dépend bien entendu d’abord de sa taille. Un infarctus massif peut entraîner une rupture de la paroi ou des troubles du rythme mortels. Dans la majorité des cas, l’infarctus cicatrise, au prix d’un processus de remodelage qui revêt des aspects à la fois adaptatifs, mais aussi délétères (‹). (‹) m/s 2004, n° 6-7, p. 643
L’option thérapeutique évidente serait de compléter ce processus adaptatif physiologique soit en activant les potentialités éventuelles de régénération du myocarde, soit en injectant des myocytes ou des cellules souches capables de se différencier in situ en myocytes fonctionnellement efficaces [4] (‹). (‹) m/s 2004, n° 6-7, p. 651
À la suite de l’injection intramyocardique de cellules de moelle osseuse, il est difficile de faire la part de ce qui revient à l’amélioration de l’oxygénation du tissu par les nouveaux vaisseaux, puisque ces cellules injectées dans la périphérie de la zone infarcie donnent naissance à la fois à des myocytes et à des cellules endothéliales vasculaires [
25]. La même amélioration est obtenue par mobilisation des cellules de la moelle endogène au moyen d’un traitement par des cytokines [
26–
28]. Des premiers résultats ont été obtenus chez l’homme [
29], mais il est difficile de savoir si l’amélioration fonctionnelle est due à l’apparition de nouveaux myocytes ou à la néo-angiogenèse. Pour ce qui concerne la transplantation de myoblastes squelettiques, les premiers essais réalisés chez l’homme ont porté sur des patients qui bénéficiaient simultanément d’un pontage aortocoronarien [1]. Les raisons de l’amélioration fonctionnelle observée, là aussi un peu ambigües, devraient être en partie élucidées par les données d’une étude prospective européenne en cours de réalisation. |
S’il est difficile d’affirmer avec certitude que les myocytes cardiaques adultes sont capables de proliférer, il existe incontestablement des capacités de régénération myocardique, à partir de cellules souches résidant originellement dans le myocarde ou « importées » par la circulation coronaire. Ces capacités restent toutefois extrêmement limitées et ne permettent en aucun cas au cœur de compenser, tout seul, une perte significative de son patrimoine contractile, comme c’est le cas lors d’un infarctus du myocarde étendu. À moins de trouver un moyen de faire proliférer in situ, à un niveau suffisant, des cellules d’origine cardiaque, les cellules utilisées lors de la thérapie cellulaire cardiaque devront être importées en grand nombre. La restitution fonctionnelle ad integrum par apport de cellules à la zone infarcie restant encore du domaine du rêve, les études se portent logiquement vers l’apport précoce de cellules à la zone ischémique pour prévenir les aspects délétères du remodelage. Là encore, dans ce domaine particulièrement innovant de la cardiologie, la prévention va devenir prioritaire par rapport à la réparation. |
1. Menasché P, Hagège AA, Scorsin M, et al. First successful clinical myoblast transplantation for heart failure. Lancet 2001; 357 : 279–80. 2. Itescu S, Schuster MD, Kocher AA. New directions in strategy using cell therapy for heart disease. J Mol Med 2003; 81 : 288–96. 3. Adler CP, Sandritter W. Alterations of substances in experimentally induced cardiac hypertrophy. Basic Res Cardiol 1980; 75 : 126–38. 4. von Hardsorf R, Poole-Wilson P, Dietz R. Regenerative capacity of the myocardium : Implication for treatment of heart failure. Lancet 2004; 363 : 1306–13. 5. Grove D, Nair KG, Zak R. Biochemical correlates of cardiac hypertrophy. III. Changes in DNA content; the relative contributions of polyploidy and mitotic activity. Circ Res 1969; 25 : 463–71. 6. Astorri E, Bolognesi R, Colla B, et al. LV hypertrophy : A cytometric study on 42 human hearts. J Mol Cell Cardiol 1977; 9 : 763–75. 7. Linzbach AJ. Heart failure from the point of view of quantitative anatomy. Am J Cardiol 1960; 5 : 370–81. 8. Swynghedauw B. Molecular mechanisms of myocardial remodeling. Physiol Rev 1999; 79 : 215–62. 9. Kajstura J, Leri A, Finato N, et al. Myocyte proliferation in end-stage cardiac failure in humans. Proc Natl Acad Sci USA 1998; 95 : 8801–5. 10. Beltrami AP, Urbanek K, Kajstura J, et al. Evidence that human cardiac myocytes divide after myocardial infarction. N Engl J Med 2001; 344 : 1750–7. 11. Limana F, Urbanek K, Chimenti S, et al. Bcl-2 overexpression promotes myocyte proliferation. Proc Natl Acad Sci USA 2002; 99 : 6257–62. 12. Weber KT. Wound healing in cardiovascular disease. Armonk, NY : Futura Publishing Cy, 1995. 13. Swynghedauw B. Developmental and functional adaptation of contractile proteins in cardiac and skeletal muscles. Physiol Rev 1986; 710 : 710–71. 14. Anderson DJ, Gage FH, Weissman Il. Can stem cells cross lineage boundaries ? Nat Med 2001; 7 : 393–5. 15. Oh H, Bradfute SB, Gallardo TD, et al. Cardiac progenitor cells from adult myocardium : homing, differentiation, and fusion after infarction. Proc Natl Acad Sci USA 2003; 100 : 12313–8. 16. Olson EN, Schneider MD. Sizing up the heart : Development redux in disease. Genes Dev 2003; 17 : 1–20. 17. Beltrami AP, Barlucchi L, Torella D, et al. Adult cardiac stem cells are multipotent and support myocardial regeneration. Cell 2003; 114 : 763–76. 18. Urbanek K, Quaini F, Tasca G, et al. Intense myocyte formation from cardiac stem cells in human cardiac hypertrophy. Proc Natl Acad Sci USA 2003; 100 : 10440–5. 19. Asahara T, Murohara T, Sullivan A, et al. Isolation of putative progenitor endothelial cells for angiogenesis. Science 1997; 275 : 964–7. 20. Hill JM, Zalos G, Halcox JPJ, et al. Circulating endothelial progenitors cells, vascular function, and cardiovascular risk. N Engl J Med 2003; 348 : 593–600. 21. Glaser R, Lu MM, Narula N, Epstein JA. Smooth muscle cells, but not myocytes, of host origin in transplanted human hearts. Circulation 2002; 106 : 17–9. 22. Taylor DA, Hruban R, Rodriguez ER, et al. Cardiac chimerism as a mechanism for self-repair. Does-it happen and if so to what degree ? Circulation 2002; 106 : 2–4. 23. Laflamme MA, Myerson D, Saffitz JE, et al. Evidence for cardiomyocyte repopulation by extracardiac progenitors in transplanted human hearts. Circ Res 2002; 90 : 634–40. 24. Quaini F, Urbanek K, Beltrami AP, et al. Chimerism of the transplanted heart. N Engl J Med 2002; 346 : 5–15. 25. Orlic D, Kajstura J, Chimenti S, et al. Bone marrow cells regenerate infarcted myocardium. Nature 2001; 410 : 701–5. 26. Orlic D, Kajstura J, Chimenti, et al. Mobilised bone marrow cells repairs the infarcted heart, improving function and survival. Proc Natl Acad Sci USA 2001; 98 : 10344–9. 27. Kamihata H, Matsubara H, Nishiue T, et al. Implantation of bone marrow mononuclear cells into ischemic myocardium enhances collateral perfusion and regional function via side supply of angioblasts, angiogenic ligands, and cytokines. Circulation 2001; 104 : 1046–52. 28. Kocher AA, Schuster MD, Szabolcs MJ, et al. Neovascularization of ischemic myocardium by human bone-marrow-derived angioblasts prevents cardiomyocyte apoptosis reduces remodeling and improves cardiac function. Nat Med 2001; 7 : 430–6. 29. Assmus B, Schächinger V, Teupe C, et al. Transplantation of progenitors cells and regeneration enhancement in acute myocardial infarction (TOPCARE-AMI). Circulation 2002; 106 : 3009–15. |