| |
| Med Sci (Paris). 2004 December; 20(12): 1061–1062. Published online 2004 December 15. doi: 10.1051/medsci/200420121061.Cellules souches hépatiques : tout un programme ! Hélène Gilgenkrantz Inserm U.567, CNRS UMR 81-04, Institut Cochin, 24, rue du Faubourg Saint-Jacques, 75014 Paris, France MeSH keywords: Animaux, Humains, Foie, Cellules stromales mésenchymateuses, Cellules souches |
Il était une fois, une histoire de foie… Devant la pénurie de greffons, trouver une alternative à la transplantation de foie a toujours été une sorte de quête du Graal. La transplantation d’hépatocytes isolés est apparue comme une approche séduisante, mais les essais cliniques sont restés peu nombreux et décevants, limités par l’absence d’expansion de ces cellules in vivo. Pourtant, les capacités d’autorenouvellement et de reconstitution du foie font de l’hépatocyte une sorte de cellule souche monopotente. Des transplantations en série ont en effet démontré, chez le rongeur, l’extraordinaire capacité de division de cette cellule in vivo. D’autres cellules bipotentes, appelées cellules ovales et capables de différenciation en hépatocytes ou en cellules biliaires, ont également été observées dans des conditions pathologiques chez l’homme ou d’induction spécifique chez le rongeur. Leur présence dans des cholangiocarcinomes et la difficulté d’obtenir une population homogène de cellules ovales les ont écartées des approches de thérapie cellulaire. D’après les données les plus récentes, existe-t-il d’autres cellules souches dans l’organisme, à la naissance ou à l’âge adulte, capables de remplir la fonction hépatocytaire ? |
Hématopoïèse et hépatopoïèse : une si discrète différence ! Les premiers travaux tentant de répondre à cette question datent de presque cinq ans. Depuis, de nombreuses observations sont venues conforter la notion que des cellules médullaires portent une capacité de se transformer in vivo en hépatocytes. Il est ainsi possible de détecter, après greffe de moelle, des cellules provenant du donneur dans le foie du receveur. Parmi celles-ci, on trouve majoritairement des macrophages et des cellules endothéliales, mais aussi parfois des cellules parenchymateuses hépatiques. Cette observation a-t-elle néanmoins une pertinence physiologique ou thérapeutique ? La plupart des travaux ultérieurs ont orienté leurs conclusions vers une réponse négative, tant cet événement de différenciation cellule médullaire-hépatocyte semble rare [
1–
3]. Très récemment, l’équipe de E.D. Zanjani a utilisé le foie fœtal de mouton pour démontrer la capacité de cellules souches hématopoïétiques (CSH) humaines de participer à l’« hépatopoïèse ». En effet, cette équipe a développé depuis plus de 10 ans un modèle de mouton humanisé en tirant profit de la tolérance immune des fœtus au cours de la gestation. Après transplantation intrapéritonéale de cellules souches hématopoïétiques humaines chez le fœtus au cours de la gestation, les agneaux présentent un chimérisme qui persiste après la naissance. L’équipe de E.D. Zanjani vient désormais de montrer que ces animaux, chimériques dans leur moelle et leur sang, présentent également des hépatocytes humains dérivés des cellules souches injectées. De plus, il semble exister une corrélation directe entre la formation d’hépatocytes et le chimérisme hématopoïétique [
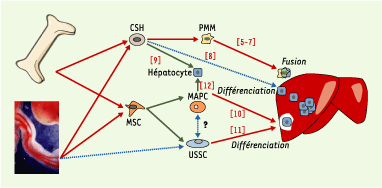
4]. Les CSH humaines peuvent ainsi participer au développement du foie à une hauteur de 17 % des hépatocytes, 11 mois après transplantation (Figure 1). Enfin, argument incontournable pour définir la plasticité de cellules souches, les cellules humaines isolées de la moelle de premiers receveurs gardent cette plasticité après transplantation secondaire. Il est possible que le contexte fœtal soit particulièrement propice à cette plasticité cellulaire.  | Figure 1. Cellules du sang de cordon ou de la moelle capables de donner des hépatocytes. La moelle adulte ou le sang de cordon contiennent des cellules souches hématopoïétiques (CSH) et des cellules souches mésenchymateuses (MSC). De ces différents compartiments sont issus respectivement des progéniteurs myélomonocytaires (PMM), capables de fusionner in vivo avec des hépatocytes résidents, ainsi que des multipotent adult progenitor cells (MAPC) et des unrestricted somatic stem cells (USSC), qui peuvent in vitro et/ou in vivo donner des cellules hépatocytaires. Certains articles mentionnent une différenciation directe des CSH en cellules hepatocyte-like in vitro ou in vivo. Les références relatives à chacun des processus observés sont indiquées. Les flèches vertes indiquent les expériences menées in vitro, les flèches rouges celles menées in vivo. Les flèches en pointillé bleu indiquent qu’aucun élément ne permet d’affirmer un passage direct entre les deux états. |
|
To fusion or not to fusion ? Chez le rongeur, il a été démontré que les hépatocytes dérivés de la moelle provenaient en réalité d’un événement de fusion entre une cellule myélomonocytaire issue de la moelle donneuse [
5–
7] et un hépatocyte résident. Cependant, d’autres résultats sont venus récemment contredire cette observation : il serait en effet possible d’obtenir des cellules hépatiques à partir de cellules médullaires en l’absence de fusion in vivo chez la souris [
8] ou dans le modèle du foie fœtal de mouton [4], voire in vitro lorsque des cellules souches hématopoïétiques sont mises en présence de sérum d’animaux au foie lésé [
9]. Néanmoins, les différences expérimentales entre la nature des cellules transplantées, les méthodes de détection et les modèles receveurs empêchent de tirer une conclusion définitive sur la réelle plasticité de ces cellules. Notons toutefois que, le foie étant un organe naturellement polyploïde, une fusion entre cellule médullaire et cellule hépatique, si elle ne donne pas lieu à une aneuploïdie, pourrait s’avérer parfaitement fonctionnelle. |
L’entrée en scène des cellules souches mésenchymateuses… Jusque-là, les cellules capables de fusionner ou de se transdifférencier en hépatocytes étaient plutôt décrites dans le compartiment souche hématopoïétique. Par la suite, l’équipe de C. Verfaillie (Minnesota, États-Unis) a isolé, à partir du compartiment mésenchymateux de différents tissus adultes, des cellules souches qu’elle a appelées MAPC (multipotent adult progenitor cells) et qui sont capables de contribuer au développement de la plupart des tissus somatiques, notamment du foie, après injection dans un blastocyste (Figure 1). Par ailleurs, les MAPC participent à la régénération du foie lorsqu’elles sont injectées par voie intraveineuse chez l’animal immunodéficient NOD/SCID (‹) [
10]. (‹) m/s 2003, n° 6-7, p. 683
Enfin, contrairement aux cellules ES, elle ne donnent pas lieu à un développement tumoral après transplantation in vivo. Toutefois, il n’est pas démontré que ces cellules existent réellement en tant que telles dans les différents tissus où elles sont isolées ; elles pourraient en effet n’apparaître qu’après dédifférenciation en culture. Les MAPC, jusqu’à présent seules cellules capables in vitro et à l’échelon clonal de donner naissance à la fois à des cellules mésenchymateuses et à des hépatocytes, ont été très récemment détrônées par un autre type cellulaire - appelé USSC (unrestricted somatic stem cells) par leurs auteurs - isolé à partir de sang de cordon humain [
11]. Ces cellules sont adhérentes en culture et ne portent pas les marqueurs de cellules souches hématopoïétiques CD45 ou CD34. Comme toute cellule souche mésenchymateuse, elles sont capables de différenciation en cellules osseuses, cartilagineuses ou adipocytaires. Mais leur pluripotence inclut également une capacité de différenciation in vitro en cellules hématopoïétiques ou neurales et, in vivo, en cellules hépatiques. Après transplantation de ces cellules dans le modèle du mouton fœtal, celui-ci compte en effet jusqu’à 20 % de cellules hépatiques d’origine humaine, et ceci en l’absence de tout processus de fusion (Figure 1). Peut-on différencier USSC et MAPC ? L’expression différentielle de plusieurs marqueurs ne suffit pas à les différencier car la simple variation des conditions de culture pourrait moduler l’expression phénotypique de ces cellules. On manque donc cruellement d’éléments de comparaison pour répondre à cette question, tant les protocoles de purification, les modes de culture et les modèles animaux utilisés diffèrent. Enfin, pour les MAPC comme pour les USSC, il n’a pas encore été démontré que ces cellules pouvaient participer à une régénération hépatique fonctionnelle chez l’adulte. Force est de constater, ma foi, qu’on aimerait une bonne fois y voir plus clair et avoir foi dans toutes ces cellules souches de foie. |
1. Mallet VO, Mitchell C, Mezey E, et al. Bone marrow transplantation in mice leads to a minor population of hepatocytes that can be selectively amplified in vivo. Hepatology 2002; 35 : 799–804. 2. Wagers AJ, Sherwood RI, Christensen JL, et al. Little evidence for developmental plasticity of adult hematopoietic stem cells. Science 2002; 297 : 2256–9. 3. Wang X, Montini E, Al-Dhalimy M, et al. Kinetics of liver repopulation after bone marrow transplantation. Am J Pathol 2002; 161 : 565–74. 4. Almeida-Porada G, Porada CD, Chamberlain J, et al. Formation of human hepatocytes by human hematopoietic stem cells in sheep. Blood 2004; 104 : 2582–90. 5. Alvarez-Dolado M, Pardal R, Garcia-Verdugo JM, et al. Fusion of bone-marrow-derived cells with Purkinje neurons, cardiomyocytes and hepatocytes. Nature 2003; 425 : 968–73. 6. Camargo FD, Finegold M, Goodell MA. Hematopoietic myelomonocytic cells are the major source of hepatocyte fusion partners. J Clin Invest 2004; 113 : 1266–70. 7. Willenbring H, Bailey AS, Foster M, et al. Myelomonocytic cells are sufficient for therapeutic cell fusion in liver. Nat Med 2004; 10 : 744–8. 8. Harris RG, Herzog EL, Bruscia EM, et al. Lack of a fusion requirement for development of bone marrow-derived epithelia. Science 2004; 305 : 90–3. 9. Jang YY, Collector MI, Baylin SB, et al. Hematopoietic stem cells convert into liver cells within days without fusion. Nat Cell Biol 2004; 6 : 532–9. 10. Jiang Y, Jahagirdar BN, Reinhardt RL, et al. Pluripotency of mesenchymal stem cells derived from adult marrow. Nature 2002; 418 : 41–9. 11. Kogler G, Sensken S, Airey JA, et al. A new human somatic stem cell from placental cord blood with intrinsic pluripotent differentiation potential. J Exp Med 2004; 200 : 123–35. 12. Schwartz RE, Reyes M, Koodie L, et al. Multipotent adult progenitor cells from bone marrow differentiate into functional hepatocyte-like cells. J Clin Invest 2002; 109 : 1291–302. |