Le fer est un nutriment indispensable à quasiment tous les organismes vivants, pour des besoins aussi primordiaux que la respiration et la synthèse d’ADN. On explique ainsi la non-prolifération bactérienne dans les profondeurs océaniques par l’absence de fer. La plupart du temps, cependant, la difficulté pour les micro-organismes de trouver du fer réside dans le fait que ce dernier est insoluble et/ou inaccessible. Les bactéries, en particulier le staphylocoque, ont développé diverses stratégies de capture du fer. Il peut s’agir de la sécrétion de sidérophores solubles, qui captent le fer externe puis assurent son entrée dans la bactérie par des transporteurs spécifiques. Il existe aussi des systèmes d’importation directe de sels de fer. Un premier mécanisme de défense des organismes supérieurs contre l’invasion bactérienne est une limitation drastique du fer libre dans le sang et les tissus. Ce blocage du fer s’effectue majoritairement par sa fixation sur des protéines qui ont pour lui une forte affinité, la lactoferrine et la transferrine. Les sites de fixation du Fe3+ de la transferrine sont, en fait, rarement saturés, laissant toujours un excès de protéine non saturée sous forme d’apotransferrine et assurant ainsi l’élimination virtuelle de tout fer libre. Un récent travail de chercheurs de l’Université de Chicago (États-Unis) a mis en évidence la stratégie employée par le staphylocoque doré (Staphylococcus aureus) pour se procurer le fer nécessaire à sa croissance et à sa différenciation [ 1, 2]. Pour coloniser son hôte, le staphylocoque rencontre un premier obstacle : le manque de fer. La concentration dont il a besoin est de l’ordre de 0,4-4,0 mM, alors que la concentration de fer libre se situe autour de 10- 9 M. Deux sources possibles de capture existent dans l’organisme des mammifères : la transferrine, qui ne représente que 1 % du fer total, et l’hème, qui en contient plus de 80 %. Les auteurs ont donc supposé que l’hème devait être utilisé de façon préférentielle. Afin de vérifier cette hypothèse, un marquage spécifique des deux protéines par un isotope stable du fer a été réalisé pour mesurer la consommation de la transferrine [57Fe] et de l’hémine [54Fe]. Les dosages ont été effectués par une spectrométrie de masse en source plasma ICP-MS (inductively coupled plasma-mass spectrometry). Dans une première étape, les bactéries sont placées sur un milieu pauvre en fer jusqu’à une limitation de croissance indicatrice de carence martiale, suivie par l’ajout en quantité équimolaire des deux protéines marquées. Les mesures sont ensuite effectuées au bout de 9 heures, 12 heures et en phase stationnaire à 24 heures. Le contenu isotopique des cellules montre, dans les premières heures, un enrichissement (x 4 à 5) en fer héminique en même temps qu’un appauvrissement du milieu. Cette modification des concentrations diminue au cours du temps, mettant en évidence la régulation progressive des autres systèmes de capture (à partir de la transferrine ou de sidérophores). La méthode a aussi permis de préciser la localisation subcellulaire du fer extrait des deux protéines : le fer héminique se fixerait sélectivement à la membrane, celui de la transferrine s’orientant vers le cytoplasme.
Parallèlement à ces mesures isotopiques, une analyse du génome de S. aureus a montré sept séquences codant potentiellement pour des transporteurs transmembranaires et présentant une homologie avec des transporteurs connus. Parmi ceux-ci, certains systèmes avaient déjà été mis en évidence par le même groupe de chercheurs. Tout un ensemble de gènes isd A à F (iron-regulated surface determinants) fonctionne comme système d’import et assure la fixation de l’hème et son passage dans le cytoplasme [ 3]. Deux autres gènes isd G et I codent pour des protéines qui assurent alors la dégradation de l’hème [ 4]. Ce travail récent d’inactivation par mutation a permis d’identifier chez la bactérie un système non encore décrit de transport de l’hème constitué de trois gènes, hts A, B et C, dont les homologues ont été décrits dans d’autres bactéries, Yersinia enterocolica et Corynebacterium diphteriae. En effet, l’inactivation de ces gènes hts réduit considérablement l’acquisition de fer héminique. De plus, les auteurs ont montré, 8 nucléotides en amont du codon d’initiation de HtsA, une séquence homologue de la séquence canonique fixant le répresseur Fur (ferric uptake regulation) [ 5], ce qui suppose une régulation de l’activité des gènes en réponse à une carence en fer. L’existence d’une exotoxine hémolytique sécrétée par le staphylocoque, démontrée par ailleurs, permet l’attaque initiale de l’érythrocyte [ 6].
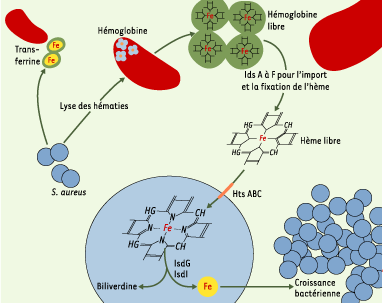
L’ensemble de ces travaux montre l’efficacité des systèmes mis en œuvre par le staphylocoque qui doit extraire le fer dans l’hémoglobine des hématies [2]. On peut élaborer un schéma dont la première étape est la lyse osmotique des cellules. L’étape suivante de libération de l’hème pourrait être le fait des enzymes Isd et/ou être due à une protéase sécrétée ou à une dissociation spontanée de l’hème par oxydation. Les enzymes IsdG et IsdI effectuent alors l’import de l’hème libre dans le cytoplasme et libèrent le fer d’une façon comparable à l’action des oxygénases chez les mammifères (Figure 1). Il était naturellement important de vérifier in vivo la validité de ce schéma et de montrer que l’inactivation des gènes hts atténue la virulence de S. aureus. Ce contrôle a pu être fait dans deux systèmes modèles, chez le ver Caenorabditis elegans et chez la souris. Chez C. elegans, l’infection tue normalement les vers en deux à quatre jours, mais cette mortalité est réduite de façon significative après inactivation de htsB ou C. Chez la souris, après inactivation du gène, on constate aussi une diminution importante des abcès habituellement observés au niveau du foie et des reins 96 heures après une injection intraveineuse de la bactérie.
| Figure 1. Système mis en œuvre par le staphylocoque pour extraire le fer des globules rouges à partir de l’hémoglobine. La première étape est la lyse osmotique des cellules. L’étape suivante de libération de l’hème est réalisée par les enzymes IsdG et IsdI qui effectuent l’import de l’hème libre dans le cytoplasme et libèrent le fer d’une façon comparable à l’action des oxygénases chez les mammifères (d’après [2]). |
En clinique, on sait que la réponse à une infection bactérienne entraîne une diminution de la capture du fer et sa séquestration dans les macrophages. C’est l’hepcidine qui joue le rôle de chef d’orchestre et qui est alors responsable de la baisse du taux de fer sérique [ 7]. Cette réaction de diminution du taux de fer sérique pourrait jouer un rôle important dans la première ligne de défense de l’organisme contre l’invasion du pathogène. Du reste, ce rôle protecteur d’une carence martiale pour empêcher la croissance d’une bactérie n’avait-il pas été empiriquement pressenti ? Depuis plus de deux millénaires, les médecins avaient coutume de traiter les infections graves - des pneumonies en particulier - par des saignées, « affamant » la bactérie. Cette notion a perduré puisqu’on retrouve cette recommandation en 1942 dans un manuel de W. Osler !