| |
| Med Sci (Paris). 2005 January; 21(1): 5–6. Published online 2005 January 15. doi: 10.1051/medsci/20052115.Peut-on reprogrammer des cellules cancéreuses ? Hélène Gilgenkrantz* Inserm U.567, Institut Cochin, 24, rue du Faubourg Saint-Jacques, 75014 aris, France MeSH keywords: Animaux, Carcinome embryonnaire, Lignée cellulaire tumorale, Phénomènes physiologiques cellulaires, Cytogénétique, Tumeurs |
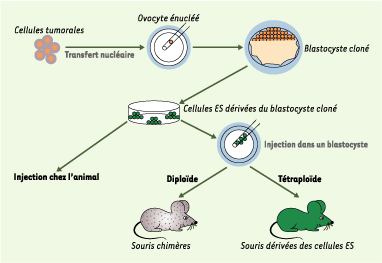
Une réponse expérimentale innovante : le transfert nucléaire Les modifications génétiques agissent généralement de concert avec des modifications épigénétiques pour induire un processus tumoral. Si les premières sont transmissibles, les secondes, telles que la méthylation de l’ADN ou l’acétylation des histones, sont potentiellement réversibles puisqu’elles n’altèrent pas directement la séquence d’ADN. Pour étudier le rôle de ces modifications épigénétiques dans l’oncogenèse, l’équipe de Rudolf Jaenisch a utilisé le transfert nucléaire. En effet, transférer un noyau d’une cellule différenciée dans un ovocyte énucléé s’apparente presque à appuyer sur la touche « remise à zéro » d’un programme, et donc à effacer les modifications épigénétiques. Le protocole expérimental proposé ici comprend deux étapes : transférer tout d’abord un noyau de cellule tumorale dans un ovocyte énucléé, puis tenter de dériver une lignée de cellules ES à partir des blastocystes issus de ce clonage. Les cellules ES obtenues sont alors testées pour leur double capacité : celle d’induire un processus tumoral, et celle de participer au développement d’un animal par injection dans un blastocyste diploïde ou tétraploïde (Figure 1). Les auteurs ont testé deux sortes de cellules : des cellules de carcinome embryonnaire (EC) qui produisent des tumeurs, mais sont aussi, paradoxalement, capables de participer à la mise en place de différents tissus au cours du développement embryonnaire [
1], et des cellules de différentes lignées cancéreuses, dont la pluripotence développementale n’était pas démontrée jusqu’à présent [
2]. Cette approche a pour but de répondre à deux questions : (1) une inversion du potentiel tumorigène de cellules cancéreuses est-elle possible par transfert nucléaire ? (2) L’activité de reprogrammation d’un ovocyte est-elle suffisante pour rétablir la pluripotence de lignées cancéreuses ? Chez les amphibiens, il a été démontré que des noyaux de cellules EC peuvent être reprogrammés pour participer au développement embryonnaire. Mais qu’en est-il chez les mammifères ?
 | Figure 1.
Approche expérimentale en deux étapes ayant permis de tester la capacité de reprogrammation de cellules tumorales. Un transfert nucléaire est établi à partir de noyaux de cellules tumorales. Des cellules ES sont dérivées des blastocystes clonés obtenus. Ces dernières sont injectées dans un blastocyste receveur diploïde - permettant d’obtenir des souris chimères (les deux génomes parentaux du blastocyste et de la cellule ES participent à la formation du souriceau) - ou tétraploïde (seules les cellules ES participent à la formation du souriceau). |
|
Reprogrammation des cellules de carcinome embryonnaire Les cellules de carcinome embryonnaire sont issues de tératocarcinomes. Leur pluripotence est connue de longue date : injectées dans un blastocyste, elles peuvent contribuer à la formation de différents organes [
3]. Trois lignées de cellules EC donnant des profils de tumorigenèse et de différenciation variés ont été utilisées pour le transfert nucléaire. Les blastocystes obtenus après clonage sont normaux et ont permis de dériver des lignées de cellules ES avec un excellent rendement. Ces cellules - injectées par voie sous-cutanée chez des souris immunodéprimées - sont équivalentes à la lignée EC parentale quant à leur propension à développer des tératomes. De même, lorsque les cellules ES sont injectées dans un blastocyste diploïde, elles possèdent le même potentiel développemental que les cellules EC parentales. Par conséquent, les capacités de développement et le potentiel tumoral des cellules ES sont déterminés par des modifications génétiques héritables ou des modifications épigénétiques « non réversibles » par la reprogrammation nucléaire. De fait, des altérations de l’ADN communes et spécifiques de chacune des lignées ont été détectées dans les cellules parentales. |
Reprogrammation des lignées tumorales Il fut beaucoup plus difficile d’obtenir des cellules ES après transfert nucléaire de lignées tumorales. Cette difficulté s’explique sans doute par le fait suivant : selon des travaux récents, l’efficacité d’obtention de cellules ES est directement corrélée à l’état de différenciation du noyau donneur [
4]. Les cellules EC expriment des marqueurs de « souchitude » comme Oct4 ou Nanog, à l’instar des cellules ES. A contrario, dans les ovocytes clonés à partir de cellules différenciées ou de lignées tumorales, il est probablement nécessaire de réactiver ces marqueurs de pluripotence afin d’obtenir un développement blastocytaire. Toutefois, des blastocystes a priori normaux ont été obtenus à partir de lignées de mélanome, ce qui permet de conclure que des cellules cancéreuses peuvent répondre à des signaux environnementaux pour participer à la différenciation des deux premiers lignages de l’embryon : l’épiblaste et le trophectoderme, sans prolifération anormale. Par deux fois (sur 57 blastocystes), une lignée de cellules ES a été obtenue à partir d’un blastocyste issu d’une cellule tumorale de mélanome. Cette cellule tumorale provenait d’un animal transgénique déficient pour le locus suppresseur de tumeur ink4a/Arf, et où le transgène Ras est activé de façon conditionnelle exclusivement dans les mélanocytes, après administration de doxycycline [
5]. L’impact de la reprogrammation épigénétique sur le développement et le potentiel tumoral a été testé sur les deux lignées de cellules ES. Injectées dans des blastocystes diploïdes receveurs, une seule de ces deux lignées a contribué à la formation de multiples organes dont la peau, le cœur, le rein, le foie ou le poumon, sans passage toutefois à la lignée germinale. Afin de déterminer si les cellules du blastocyste receveur ont pu complémenter les cellules ES transplantées pour leur participation au développement embryonnaire, les auteurs ont injecté les cellules ES dans des blastocystes tétraploïdes. Dans ce type d’approche, en effet, les cellules tétraploïdes contribuent uniquement au placenta et non au développement de l’embryon. Les embryons se sont développés jusqu’à 9,5 jours de vie embryonnaire et présentaient alors un cœur battant, un tube neural fermé et des ébauches de membres et de queue. Mais les remaniements chromosomiques (détectés par hybridation génomique comparative, CGH) ont probablement empêché le développement ultérieur de ces embryons. Le potentiel tumorigène inductible des cellules ES issues de la lignée tumorale de mélanome a été testé sur les souris chimériques. Elles présentent toutes des mélanomes multiples après induction par la doxycycline, tumeurs qui régressent après retrait de la drogue et peuvent être à nouveau réinduites. Des rhabdomyosarcomes ont également été détectés dans un tiers des cas, non susceptibles au retrait de la doxycycline. Par conséquent, le phénotype malin de ces lignées tumorales peut être transitoirement supprimé par cette reprogrammation ovocytaire et autoriser un développement précoce a priori normal et une participation à la plupart des lignages somatiques, et ce malgré des remaniements chromosomiques importants. Néanmoins, les altérations chromosomiques irréversibles participent au potentiel tumorigène qui subsiste chez les souris chimères et le spectre tumoral est plus important chez celles-ci. |
Différentes applications de cette stratégie L’ensemble de ces résultats suggère que le génome de cellules cancéreuses peut être reprogrammé par l’environnement ovocytaire pour donner un état embryonnaire pluripotent, sans toutefois permettre d’établir les facteurs épigénétiques capables d’influencer le phénotype malin. Il fournit également une donnée intéressante : l’apparition de rhabdomyosarcomes dans un tiers des chimères confirme l’existence d’une voie commune entre le développement des mélanomes et ce type de tumeurs [
6]. Cette approche expérimentale utilisant le transfert nucléaire pourrait donc, à l’avenir, non seulement servir à caractériser des associations entre différents types de cancer, comme c’est le cas ici, mais également à amplifier le génome potentiellement altéré d’une cellule dans le contexte d’un développement embryonnaire précoce. Elle pourrait aussi se révéler utile dans l’étude des désordres génétiques polygéniques ou dans la création de modèles de maladies complexes comme le diabète. |
1. Hochedlinger K, Blelloch R, Brennan C, et al. Reprogramming of a melanoma genome by nuclear transplantation. Gene Dev 2004; 18 : 1875–85. 2. Blelloch R, Hochedlinger K, Yamada Y, et al. Nuclear cloning of embryonal carcinoma cells. Proc Natl Acad Sci USA 2004; 101 : 13985–90. 3. Andrews PW. From teratocarcinomas to embryonic stem cells. Philos Trans R Soc Lond B 2002; 357 : 405–17. 4. Bortvin A, Eggan K, Skaletsky H, et al. Incomplete reactivation of Oct4-related genes in mouse embryos cloned from somatic nuclei. Development 2003; 130 : 1673–80. 5. Chin L, Tam A, Pomerantz J, et al. Essential role for oncogenic Ras tumour maintenance. Nature 1999; 400 : 468–72. 6. Sharp R, Recio JA, Jhappan C, et al. Synergism between INK4a/ARF inactivation and aberrant HGF/SF signaling in rhabdomyosarcomagenesis. Nat Med 2002; 8 : 1276–80. |