| |
| Med Sci (Paris). 2005 January; 21(1): 17–19. Published online 2005 January 15. doi: 10.1051/medsci/200521117.Bases moléculaires du tropisme foetoplacentaire de Listeria monocytogenes
Marc Lecuit*1 and Pascale Cossart2 1Unité des Interactions bactériescellules, Inserm U.604, Département de Biologie cellulaire et infection, Institut Pasteur et Service des Maladies infectieuses et tropicales, Université Paris 5, Hôpital Necker-Enfants malades, 149, rue de Sèvres 75743 Paris Cedex 15, France 2Unité des Interactions bactériescellules, Inserm U.604, Département de Biologie cellulaire et infection, Institut Pasteur, 25, rue du Docteur Roux, 75015 Paris, France MeSH keywords: Protéines bactériennes, Translocation bactérienne, Humains, Listeria monocytogenes, Placenta |
Listeria monocytogenes, l’espèce bactérienne responsable de la listériose, a la capacité de franchir trois barrières au cours de l’infection chez l’homme : la barrière intestinale, la barrière hémato-encéphalique et la barrière maternofœtale. C’est un micro-organisme intracellulaire facultatif1 capable de survivre et de se multiplier dans les cellules phagocytaires, et d’induire son internalisation dans les cellules non phagocytaires, notamment les cellules d’origine épithéliale humaines. Il a été proposé que cette capacité d’infecter les cellules non phagocytaires confère à Listeria monocytogenes son triple tropisme pour le tissu intestinal, le système nerveux central et l’unité fœtoplacentaire [
1,
2]. Des études menées in vitro ont permis d’identifier les mécanismes moléculaires de l’internalisation de L. monocytogenes dans les cellules épithéliales. L’in-ternaline (InlA), lorsqu’elle est ancrée à la surface des bactéries, reconnaît un récepteur exprimé à la surface de la cellule hôte, qui est un marqueur de différenciation épithéliale, la E-cadhérine [
3,
4]. Cette interaction est spécifique d’espèce, l’internaline reconnaissant la E-cadhérine humaine, mais ne reconnaissant pas la E-cadhérine murine [
5]. Cette observation a conduit à la mise en évidence du rôle crucial du 16e acide aminé de la E-cadhérine mature, qui est une proline chez les espèces permissives (homme, cobaye, lapin, ovins, bovins) et un acide glutamique chez les espèces non permissives (souris, rat). L’étude par diffraction des rayons X de la structure tridimensionnelle du complexe internaline/E-cadhérine humaine a permis de démontrer que la proline 16 de la E-cadhérine humaine est absolument nécessaire à la formation de ce complexe moléculaire [
6]. Dans un modèle murin transgénique exprimant la E-cadhérine humaine, spécifiquement dans les entérocytes, L. monocytogenes acquiert la capacité de traverser la barrière intestinale avec une grande efficacité, démontrant le rôle crucial du couple internaline/E-cadhérine au cours de l’étape initiale de l’infection [
7]. Ces résultats expérimentaux ne permettent cependant pas d’affirmer que l’internaline joue un rôle dans l’espèce humaine. De plus, ils ne permettaient pas de savoir si l’internaline joue un rôle dans la traversée des barrières maternofœtale et hémato-encéphalique qui comportent, comme la barrière intestinale, des cellules exprimant la E-cadhérine. |
Démonstration épidémiologique du rôle de l’internaline chez l’homme Afin d’étudier le rôle éventuel de l’internaline chez l’homme, nous avons adopté une approche épidémiologique [
8]. Il existe en effet des isolats de L. monocytogenes qui expriment une internaline tronquée, qui n’est plus ancrée à la surface des bactéries et est donc non fonctionnelle. In vitro, ces bactéries entrent très peu dans les cellules intestinales humaines en culture et se comportent comme un mutant n’exprimant pas d’internaline. Cette étude épidémiologique visait à déterminer la fréquence des isolats exprimant une internaline fonctionnelle ou tronquée au sein de deux échantillons, l’un d’isolats d’origine alimentaire2, et l’autre d’isolats cliniques responsables d’infection invasive chez l’homme. Notre hypothèse de travail était que l’existence d’une fréquence plus élevée de souches exprimant une internaline fonctionnelle dans le groupe « isolats d’origine clinique » que dans le groupe « isolats d’origine alimentaire » constituerait un argument épidémiologique en faveur du rôle de l’internaline au cours de la listériose humaine. Cette hypothèse a été confirmée sans ambiguïté [8]. En effet, sur les 300 isolats cliniques étudiés, 96 % exprimaient une internaline « sauvage », contre seulement 65 % des 150 isolats d’origine alimentaire (p<10−7, OR : 12,73, IC 95 % : 6,27-26,34). De plus, toutes les souches à l’origine d’infections fœtoplacentaires (61/61) et toutes celles responsables d’infections du système nerveux central, sauf une (55/56), exprimaient une internaline « sauvage ». Ces résultats démontrent non seulement le rôle crucial de l’internaline au cours de la listériose humaine, mais suggèrent également qu’elle est impliquée dans la traversée des barrières fœtoplacentaire et hémato-encéphalique. De plus, toutes les souches de sérovar 4b3 expriment une internaline sauvage : ce résultat apporte donc une explication moléculaire à la prédominance de ce sérovar dans les cas de listériose humaine et est en faveur d’une pathogénicité accrue de ce sérovar pour l’espèce humaine. Enfin, ces résultats permettent de proposer d’utiliser l’expression de l’internaline comme un marqueur moléculaire de virulence pour l’homme des souches de L. monocytogenes isolées de sources alimentaires. |
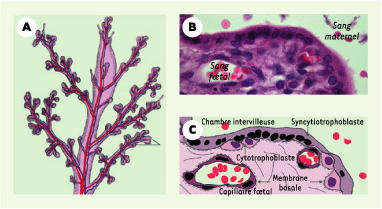
Rôle de l’internaline dans la traversée de la barrière placentaire La barrière fœtoplacentaire comporte des cellules exprimant la E-cadhérine : les cellules cytotrophoblastiques et les cellules épithéliales amniotiques. Un modèle animal transgénique exprimant en lieu et place de la E-cadhérine murine la E-cadhérine humaine n’est pas encore disponible [2] ; il permettrait d’étudier le rôle de l’internaline à toutes les étapes du processus infectieux in vivo où L. monocytogenes est en contact avec des tissus dont les cellules expriment la E-cadhérine. Le placenta humain, qui est de type discoïde, multivilleux et hémomonochorial (Figure 1), est d’organisation voisine de celle du placenta des autres primates, mais relativement différente de nombreuses autres espèces animales. Expulsé au moment de l’accouchement, que la grossesse ait été normale ou pathologique (notamment en cas d’infections néonatales entraînant un avortement ou un accouchement prématuré), le placenta peut être étudié au laboratoire. Outre l’histologie classique, la culture primaire de cellules originaires du placenta humain ou d’explants de villosités placentaires sont réalisables.  | Figure 1.
Anatomie de la barrière maternofœtale chez l’homme. A. Schéma des villosités placentaires. B, C. Section d’une villosité placentaire colorée à l’hématoxyline-éosine (B), et schéma histologique correspondant (C). La chambre intervilleuse est normalement remplie de sang maternel. Le syncytiotrophoblaste multinucléé, qui constitue un véritable syncytium, recouvre les villosités. Les cellules cytotrophoblastiques sont mitotiquement actives, et donnent naissance au syncytiotrophoblaste par un processus de différenciation et de fusion. Le trophoblaste est séparé de l’axe des villosités contenant les vaisseaux fœtaux par une membrane basale. La barrière placentaire séparant les circulations maternelle et fœtale est donc matérialisée par l’espace tissulaire s’étendant de la membrane apicale du syncytiotrophoblaste aux cellules endothéliales des capillaires fœtaux. |
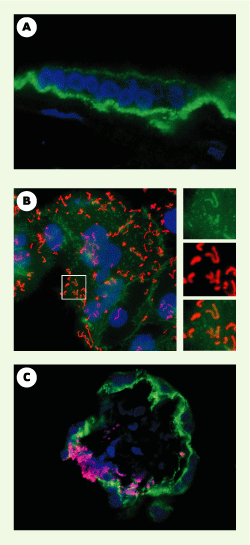
À partir de coupes de placenta et d’amnios (membrane amniotique) issus de sept patientes ayant eu une listériose maternofœtale, nous avons pu mettre en évidence que L. monocytogenes existait à l’état libre dans la chambre intervilleuse et infectait les villosités placentaires, notamment au niveau syncytiotrophoblastique, pour ensuite former des micro-abcès au sein des axes villositaires. En revanche, au niveau amniotique, les bactéries semblaient n’infecter l’épithélium amniotique qu’à partir du liquide amniotique. Ces résultats semblaient donc favoriser le scénario d’un franchissement de la barrière maternofœtale au niveau placentaire plutôt qu’amniotique. La E-cadhérine est localisée non seulement au niveau du cytotrophoblaste, comme cela avait été précédemment décrit, mais aussi au niveau du syncytiotrophoblaste, notamment sur sa face apicale (Figure 2A), en contact direct avec le sang maternel. En conséquence, L. monocytogenes, en position extracellulaire dans le sang maternel, peut rencontrer son récepteur au niveau du placenta. À partir de cellules trophoblastiques primaires humaines et d’explants placentaires humains, nous avons démontré la permissivité du syncytiotrophoblaste à l’infection par L. monocytogenes (Figure 2B). Nous avons également reproduit au sein des explants placentaires infectés ex vivo des abcès villeux semblables à ceux observés dans les placentas issus de patientes ayant eu une listériose maternofœtale (Figure 2C) et, enfin, démontré que l’invasion du syncytiotrophoblaste et la formation des abcès villeux nécessitaient la présence de l’internaline [
9].
 | Figure 2.
Rôle de l’internaline dans la traversée de la barrière placentaire. A. Coupe d’une villosité placentaire humaine centrée sur le syncytiotrophoblaste, immunomarquée avec un anticorps dirigé contre la E-cadhérine humaine. La E-cadhérine apparaît en vert, les noyaux en bleu. B. Adhérence et entrée de bactéries exprimant l’internaline dans du syncytiotrophoblaste humain en culture. Les bactéries apparaissent en rouge, la E-cadhérine en vert, les noyaux en bleu. Il existe un recrutement de E-cadhérine au site d’entrée des bactéries dans le syncytiotrophoblaste. C. Coupe d’une villosité placentaire infectée ex vivo par Listeria monocytogenes. Les bactéries ont envahi le syncytiotrophoblaste, franchi la barrière placentaire, et permis la constitution de micro-abcès villositaires semblables à ceux observés au sein de placentas issus de femmes enceintes ayant eu une listériose maternofœtale. |
|
Ces résultats démontrent que L. monocytogenes utilise une stratégie commune pour reconnaître et traverser les barrières intestinale et placentaire. Ils démontrent également qu’à l’immunodépression associée à la grossesse s’associe un mécanisme spécifique qui permet à L. monocytogenes d’interagir avec le tissu placentaire. En effet, les cellules endothéliales des microvaisseaux cérébraux et les cellules épithéliales des plexus choroïdes expriment la E-cadhérine. Ainsi, l’invasion du système nerveux central par L. monocytogenes pourrait également faire intervenir l’interaction entre l’internaline et la E-cadhérine. Cette interaction constituerait alors non seulement la clé du tropisme d’hôte de L. monocytogenes, mais également celle de son tropisme d’organe. D’autres micro-organismes pathogènes pour l’homme, tels que Toxoplasma gondii, le cytomégalovirus ou Treponema pallidum
4 utilisent une porte d’entrée muqueuse et possèdent un tropisme pour le système nerveux central et l’unité fœtoplacentaire. Une approche visant à étudier les similitudes et les spécificités de ces trois barrières pourrait permettre une meilleure compréhension des stratégies utilisées par les micro-organismes pathogènes, afin de les circonvenir. |
Nous remercions Christine Jacquet, Charles Babinet, Sandrine Vandormael-Pournin, Michael Nelson, Michel Huerre, Huot Kuhn et Marie-Cécile Vacher-Lavenue pour leur contribution aux résultats présentés dans cet article. Nous remercions également la Fondation Philips pour sa participation au financement de ce travail.
|
Footnotes |
1. Cossart P, Pizarro-Cerda J, Lecuit M. Invasion of mammalian cells by Listeria monocytogenes : functional mimicry to subvert cellular functions. Trends Cell Biol 2003; 13 : 23–31. 2. Lecuit M, Cossart P. Genetically-modified-animal models for human infections : the Listeria paradigm. Trends Mol Med 2002; 8 : 537–42. 3. Gaillard JL, Berche P, Frehel C, et al. Entry of L. monocytogenes into cells is mediated by internalin, a repeat protein reminiscent of surface antigens from Gram-positive cocci. Cell 1991; 65 : 1127–41. 4. Mengaud J, Ohayon H, Gounon P, et al. E-cadherin is the receptor for internalin, a surface protein required for entry of L. monocytogenes into epithelial cells. Cell 1996; 84 : 923–32. 5. Lecuit M, Dramsi S, Gottardi C, et al. A single amino acid in E-cadherin responsible for host specificity towards the human pathogen Listeria monocytogenes. EMBO J 1999; 18 : 3956–63. 6. Schubert WD, Urbanke C, Ziehm T, et al. Structure of internalin, a major invasion protein of Listeria monocytogenes, in complex with its human receptor E-cadherin. Cell 2002; 111 : 825–36. 7. Lecuit M, Vandormael-Pournin S, Lefort J, et al. A transgenic model for listeriosis : role of internalin in crossing the intestinal barrier. Science 2001; 292 : 1722–5. 8. Jacquet C, Doumith M, Gordon JI, et al. A molecular marker for evaluating the pathogenic potential of foodborne Listeria monocytogenes. J Infect Dis 2004; 189 : 2094–100. 9. Lecuit M, Nelson DM, Smith SD, et al. Targeting and crossing of the human maternofetal barrier by Listeria monocytogenes : role of internalin interaction with trophoblast E-cadherin. Proc Natl Acad Sci USA 2004; 101 : 6152–7. |