Depuis la découverte de l’aquaporine 1 par l’équipe de P. Agre [ 1], récompensée par le Prix Nobel de chimie en 2003, plus de 200 aquaporines ont été identifiées dans le monde vivant, dont 11 chez les mammifères [ 2]. Les aquaporines sont constituées de six domaines transmembranaires qui délimitent un canal central présentant une structure typique en sablier [ 3]. La perméabilité de ce canal permet de distinguer deux grands groupes d’aquaporines : les aquaporines dites « classiques », perméables à l’eau stricto sensu, et les aquaglycéroporines, perméables à l’eau, au glycérol ainsi qu’à d’autres solutés de petite taille [ 4]. Localisées dans de nombreux épithéliums, les aquaporines contribuent essentiellement aux mécanismes d’absorption/excrétion de l’eau et participent à son homéostasie. À titre d’exemple, citons l’aquaporine 2, impliquée dans l’absorption rénale de l’eau et dont les mutations sont à l’origine de 10 % des diabètes néphrogéniques insipides héréditaires [ 5]. Cependant, des études récentes indiquent que les aquaporines ne seraient pas cantonnées au seul rôle de « passeuses d’eau » des cellules.
L’aquaporine 3 est une aquaglycéroporine présente dans les couches basales des épitheliums de nombreux organes tels que le rein, le poumon ou l’intestin [2]. Dans la peau, l’aquaporine 3 est localisée dans les kératinocytes [ 6]. Les souris dont le gène de l’aquaporine 3 a été invalidé présentent une perte d’élasticité de l’épiderme, une altération de la barrière cutanée ainsi qu’une diminution de la quantité d’eau contenue dans le stratum corneum à l’origine d’une sécheresse prononcée de la peau [ 7]. L’ensemble de ces observations plaide en faveur d’un rôle de l’aquaporine 3 dans l’homéostasie hydrique de l’épiderme. Cependant, une étude menée par X. Zheng et W. Bollinger-Bollag suggère que l’aquaporine 3, par sa perméabilité au glycérol et en interagissant avec la phospholipase D, pourrait également intervenir dans les mécanismes de prolifération et de différenciation des kératinocytes [ 8].
Les auteurs ont démontré, dans des kératinocytes en culture, que l’aquaporine 3 est détectée dans des fractions enrichies en cavéoline 1. Les cavéoles sont impliquées dans la signalisation cellulaire. En particulier, elles contribuent à la régulation de la NO synthase endothéliale et jouent un rôle dans la signalisation calcique [ 9]. La localisation de l’aquaporine 3 dans les cavéoles permet donc d’envisager une contribution éventuelle de ce canal à certains mécanismes de transduction du signal. À l’appui de cette hypothèse, les auteurs montrent que l’aquaporine 3 coprécipite avec la phospholipase D2, et ce même en présence de détergent, ce qui suggère l’existence d’une interaction protéique directe entre les deux protéines dans les cavéoles.
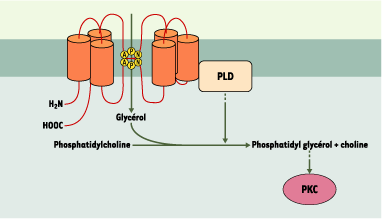
La phospholipase D2 hydrolyse la phosphatidylcholine et engendre l’acide phosphatidique et la choline. En présence de glycérol, l’hydrolyse de la phosphatidylcholine par la phospholipase D2 conduit à la formation de phosphatidylglycérol. Or, le phosphatidylglycérol est un activateur de certaines isoformes de la protéine kinase C (PKC), dont certaines interviennent dans la régulation du cycle cellulaire [ 10]. En particulier, dans l’épiderme, l’activation de la PKCα induit l’expression de protéines spécifiques des couches basales de l’épiderme telles que la filaggrine et la loricrine et contrôle la prolifération des kératinocytes [ 11]. À l’inverse, l’activation de la PKC¸ induit l’expression de protéines spécifiques des couches supérieures de l’épiderme, telles que l’involucrine et la transglutaminase, indiquant un rôle de cette kinase dans l’arrêt de la prolifération et la différenciation des kératinocytes [11]. L’aquaporine 3, en établissant un couplage fonctionnel avec la phospholipase D2, pourrait faciliter la formation de phosphatidylglycérol et être impliquée dans la prolifération ou la différenciation des kératinocytes de l’épiderme (Figure 1). Afin de confirmer cette hypothèse, X. Zheng et W. Bollinger-Bollag ont étudié les variations de l’expression et de l’activité biologique de l’aquaporine 3 au cours de la différenciation des kératinocytes.
| Figure 1.
Interaction fonctionnelle entre l’aquaporine 3 et la phospholipase D. La perméabilité de l’aquaporine 3 au glycérol facilite la formation du phosphatidylglycérol, catalysée par la phospholipase D (PLD). Le phosphatidylglycérol est un activateur de protéine kinases C (PKC) dont certaines isoformes modulent la prolifération et la différenciation des kératinocytes. |
La différenciation des kératinocytes est placée sous le contrôle de plusieurs messagers dont les ions Ca2+ et la 1,25-dihydroxyvitamine D3. Ainsi, l’application de ces deux médiateurs sur des kératinocytes en culture entraîne une diminution très importante de l’expression de l’aquaporine 3 (à l’échelle de l’ARNm et de la protéine) alors que les concentrations de phospholipase D2 demeurent inchangées. Ces résultats sont en accord avec des travaux antérieurs démontrant que l’aquaporine 3 est exprimée principalement par les cellules des couches basales (prolifératives) de l’épiderme, et non par les cellules différenciées des couches supérieures [10]. Il est important de noter que certaines protéines de la famille de p53, telles que p63, sont exprimées exclusivement par les kératinocytes en phase proliférative [11]. Or, la séquence promotrice du gène codant pour l’aquaporine 3 présente des sites de liaison aux protéines de la famille de p53. Ces données suggèrent que la transcription du gène codant pour l’aquaporine 3 pourrait être contrôlée par p63. Par ailleurs, les auteurs ont démontré que l’application de Ca2+ ou de 1,25-dihydroxyvitamine D3 provoque une diminution de la capture de glycérol par les kératinocytes en culture, démontrant ainsi que la répression de l’expression de l’aquaporine 3 provoque une diminution de son activité de transport du glycérol.
L’ensemble de ces travaux a permis de mettre en lumière un rôle inattendu de l’aquaporine 3 dans les mécanismes de la prolifération et de la différenciation des kératinocytes. En interagissant avec la phospholipase D2 dans les cavéoles, l’aquaporine 3 facilite la formation de phosphatidylglycérol, un activateur de plusieurs isoformes de la PKC qui interviennent dans la prolifération et la différenciation des kératinocytes. De plus, de façon rétroactive, la différenciation des kératinocytes provoque une diminution de l’expression du gène codant pour l’aquaporine 3, accompagnée d’une diminution de son activité de transport du glycérol. Ce mécanisme pourrait permettre une régulation fine de l’activité de la phospholipase D2, une diminution de la formation de phosphatidylglycérol et une modulation de l’activité des PKC. Ces données confortent l’hypothèse d’une fonction spécifique supplémentaire de l’aquaporine 3 dans l’épiderme, éloignée du rôle de transporteur d’eau dans lequel elle a été cantonnée jusqu’à présent.