| |
| Med Sci (Paris). 2005 January; 21(1): 37–42. Published online 2005 January 15. doi: 10.1051/medsci/200521137.Télomère et cancer : quoi de plus à la fin ? Michele Brunori and Eric Gilson* Laboratoire de Biologie moléculaire de la cellule, UMR 5161, CNRS, École normale supérieure de Lyon, 46, allée d’Italie, 69364 Lyon Cedex 07, France et Service de Biologie des tumeurs solides- énomiqueprotéomique, Centre Hospitalier Lyon-Sud, 69495 Pierre-Bénite Cedex, France |
Les extrémités de chromosome, ou télomères, contrôlent la prolifération des cellules et la stabilité du génome. L’ADN télomérique se raccourcit à chaque division cellulaire, car la réplication des extrémités d’une molécule d’ADN linéaire est incomplète. Cette dégradation peut être compensée grâce à une enzyme de type transcriptase inverse, la télomérase [
1]. La surexpression quasi systématique de la télomérase dans les cancers et l’incapacité pour des souris dépourvues de télomérase de développer certaines formes de tumeurs ont permis d’attribuer des propriétés oncogéniques au surdosage de la télomérase. L’absence de télomérase dans de nombreux tissus somatiques pourrait également jouer un rôle dans des épisodes d’instabilité chromosomique survenant dans les stades précoces de la transformation maligne. Enfin, il apparaît de plus en plus clairement qu’outre l’activité télomérase, les autres constituants de la chromatine télomérique peuvent contrôler la prolifération cellulaire. Les télomères doivent donc être explorés dans leur ensemble pour appréhender leurs rôles dans l’oncogenèse. |
La télomérase comme suppresseur de tumeur La télomérase est présente dans les cellules de la lignée germinale et dans certaines cellules souches somatiques, mais est absente ou présente en très faible quantité dans les cellules somatiques adultes [
2]. Cette absence de télomérase entraîne un raccourcissement des télomères, rythmé par les divisions cellulaires, ce qui explique l’impossibilité pour certains types cellulaires de prolonger indéfiniment leur prolifération. Lorsque un ou plusieurs télomères atteignent une taille critique, les cellules se bloquent en G0. Ce phénomène, appelé sénescence réplicative, dépend de l’activation de p53. En l’absence de cette protéine, les cellules continuent de se diviser, malgré l’absence de télomérase, et accumulent des réarrangements chromosomiques résultant de l’apparition de télomères instables. Cette instabilité finit par atteindre des niveaux intolérables et les cellules rencontrent une deuxième barrière de prolifération, la crise, qui correspond à leur mort massive. Pour échapper à la sénescence ou à la crise, les cellules peuvent réactiver l’expression de la télomérase ou mettre en place un mécanisme alternatif d’élongation de l’ADN télomérique, l’ALT, fondé sur des échanges non réciproques entre chromosomes. On peut noter que les cellules qui maintiennent leur télomère par un processus ALT sont caractérisées par la présence dans le nucléoplasme d’APB (associated PML bodies), qui correspondent à la colocalisation de la protéine PML avec des protéines télomériques telles que TRF1 ou TRF2. Il existe des relations entre le raccourcissement des télomères, l’instabilité chromosomique et la transformation cellulaire [
3]. Par exemple, les patients atteints de colite ulcéreuse, dont les biopsies montrent les télomères les plus courts, ont également une plus forte instabilité chromosomique et sont plus susceptibles de développer un cancer [
4]. Des études réalisées sur des modèles animaux montrent clairement un lien entre l’absence de télomérase et la formation de cancers. Ainsi, des souris, dont le gène codant pour l’ARN matrice de la télomérase (Tel-) a été invalidé et hétérozygotes pour p53, ont une fréquence très nettement augmentée de carcinomes spontanés (peau, côlon, sein) lors de leur vieillissement, une situation très similaire à l’augmentation de la fréquence de ces cancers avec l’âge dans l’espèce humaine [
5]. De plus, ces tumeurs présentent un profil cytogénétique complexe, avec de nombreuses aneuploïdies, translocations non réciproques, amplifications et délétions, tout comme dans les carcinomes humains. Cependant, la présence de télomères dysfonctionnels (instabilité télomérique) est reconnue dans la cellule comme un stress génotoxique et déclenche un arrêt de la division cellulaire. De ce fait, la prolifération à long terme des cellules tumorales ne peut se faire chez les souris Tel-
que si les mécanismes de signalisation de l’ADN endommagé sont défectueux (en raison, par exemple, de mutations délétères du gène p53). En résumé, l’absence de télomérase, physiologique dans les cellules somatiques, peut engendrer une instabilité du génome si les mécanismes de surveillance des dommages à l’ADN sont défectueux. À la lumière des résultats obtenus chez la souris Tel-
et de la détection de signes d’instabilité télomérique dans des cancers humains, il est tentant de proposer que cette instabilité génétique peut induire des altérations de l’expression d’oncogènes ou de gènes suppresseurs de tumeur (Figure 1). Ce scénario est en accord avec l’augmentation de la susceptibilité au cancer de patients présentant des mutations (ATM, DKC, WRN, NBS1) altérant les fonctions télomériques, mais aussi avec la forte instabilité chromosomique observée lors de l’évolution du cancer du côlon chez l’homme [
6] et avec le fait que l’oncogène Tax du virus leucémogène HTLV-1 (T cell leukemia/lymphoma virus) inhibe l’expression de la télomérase dans des lymphocytes T [
7].
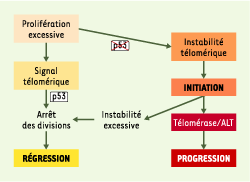
 | Figure 1.
Un modèle de développement tumoral. Ce schéma est fondé sur la compilation de nombreuses données bibliographiques dont certaines sont présentées dans le texte. Une prolifération incontrôlée de cellules dépourvues de télomérase entraîne l’érosion des télomères, ce qui aboutit, après un certain nombre de divisions, à une perte de l’intégrité télomérique et à la production d’un signal entraînant l’arrêt des divisions, par entrée en sénescence réplicative ou par apoptose. Ce point de contrôle nécessite l’activation de p53. Si celle-ci est absente ou non fonctionnelle, la prolifération continue et une instabilité télomérique s’instaure, ce qui fait rapidement courir de grands risques à l’organisme, en exposant individuellement chaque cellule à l’émergence de mutations pouvant contribuer à des étapes initiales de la transformation maligne. Les cellules accumulent cependant tant de mutations qu’elles finissent par mourir massivement, sauf quelques rares cellules qui, en réactivant un mécanisme de stabilisation des extrémités télomériques (télomérase ou ALT, alternative lengthening of telomeres), peuvent contribuer à la progression tumorale. |
Il reste toutefois à évaluer dans quelle mesure et comment une instabilité télomérique, qui pourrait par exemple se produire dans des cellules somatiques ayant proliféré de manière excessive et dans lesquelles l’expression de p53 serait inactivée, contribue à la genèse de certains cancers humains. |
La télomérase comme oncogène La télomérase est réactivée dans plus de 90 % des cancers, toutes origines confondues [
8], ce qui suggère qu’elle joue un rôle dans la progression tumorale. De fait, la quantité de télomérase est corrélée au stade ou au grade de nombreux types de cancers chez l’homme. La réexpression de la télomérase peut restaurer des fonctions télomériques compatibles avec une prolifération à long terme des cellules (Figure 1).À l’inverse, chez la souris, l’inactivation de la télomérase rend les animaux plus résistants à la progression de certains cancers induits expérimentalement [6,
9–
11]. Enfin, différents travaux du laboratoire de R. Weinberg ont montré que des cellules humaines exprimant les antigènes T et t du virus simien SV40 et une mutation Ras ont besoin d’exprimer la télomérase pour devenir tumorigènes [
12–
14]
(Figure 2).
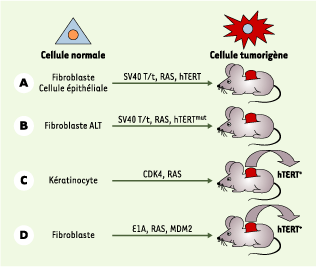
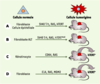 | Figure 2.
Système de cancérogenèse expérimentale pour cellules humaines. A. Il est possible, à la suite d’une série contrôlée de modifications génétiques, de transformer une cellule humaine normale en cellule tumorigène. L’expression simultanée des gènes de la région précoce du virus SV40 (antigènes T et t) et du gène codant pour une forme constitutivement activée de Ras permet de transformer une cellule normale en cellule transformée pouvant pousser sur milieu semi-solide, mais incapable de former des tumeurs chez des souris immunodéprimées. L’expression additionnelle du gène de la sous-unité catalytique de la télomérase (hTERT) est alors suffisante pour rendre cette cellule tumorigène [ 12,
13]. B. Des fibroblastes humains maintenant la taille de leurs télomères grâce au mécanisme ALT (alternative lengthening of telomeres) et exprimant les gènes de la région précoce du virus SV40 et la forme activée de Ras ont des capacités de croissance en milieu semi-solide, mais pas de propriétés tumorigènes. L’expression d’une forme mutée d’hTERT, incapable d’allonger in vivo les télomères, est alors suffisante pour rendre ces cellules tumorigènes [
27]. C. Des cellules épithéliales (kératinocytes) transformées par la surexpression de Ras et CDK4 réactivent leur télomérase lorsqu’elles prolifèrent à long terme [
17]. D. L’expression simultanée des oncogènes E1A, Ras muté et MDM2 est capable de transformer des cellules humaines normales en cellules tumorigènes sans activation de la télomérase. Cependant, la croissance prolongée de ces cellules s’accompagne d’une réactivation de leur télomérase [
16]. |
Cependant, dans certains cas, la réactivation de la télomérase ne constitue pas une étape incontournable du processus malin. Par exemple, il existe des tumeurs qui n’expriment pas la télomérase mais qui maintiennent les télomères par le processus ALT [
15]. De plus, l’expression simultanée des oncogènes E1A, Ras muté et MDM2 est capable de transformer des cellules humaines normales en cellules tumorigènes sans activation de la télomérase [16] (Figure 2). Dans ce dernier cas, cependant, les télomères de ces cellules continuent de se raccourcir et la prolifération prolongée de ces cellules soit in vitro, soit sous forme de tumeur chez la souris, s’accompagne d’une réactivation de la télomérase. Il semble probable que l’expression des trois oncogènes favorise cette réactivation. Un scénario similaire pourrait expliquer la réactivation de la télomérase dans des cellules épithéliales transformées par la surexpression de Ras et CDK4 [17] (Figure 2). |
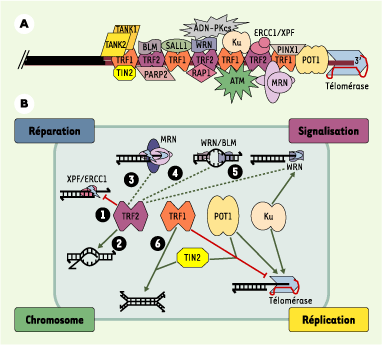
Des machines moléculaires complexes à la fin des chromosomes humains Les télomères présentent une organisation moléculaire complexe subissant de profondes modifications au cours du cycle cellulaire et du développement. De nombreuses protéines télomériques peuvent aussi avoir des fonctions en dehors des extrémités de chromosome : c’est le cas, notamment, de différents facteurs de signalisation et de réparation des dommages à l’ADN (ATM, MRN, Ku…) (Figure 3A). Les complexes télomériques humains sont organisés à partir de protéines spécialisées pour interagir spécifiquement avec l’ADN télomérique, au niveau de sa partie duplexe (TRF1, TRF2) comme de son extrémité 3’ sortante (POT1) (Figure 3A) [
18,
19]. Ces protéines interviennent dans différentes fonctions télomériques, TRF1 semblant plus particulièrement impliquée dans la régulation de la télomérase et TRF2 jouant un rôle clé dans la protection des télomères contre leur fusion [
20]. Cependant, les recherches sur le rôle de ces facteurs débutent seulement, et rien n’empêche d’imaginer que TRF1 ait des fonctions dans la protection des télomères et TRF2 dans la régulation de la télomérase. Les nombreuses interactions entre les protéines ayant une affinité pour l’ADN télomérique et différentes classes de protéines et d’enzymes laisse supposer l’existence d’édifices moléculaires complexes (Figures 3A et 3B). En fait, TRF1, TRF2 et POT1 orchestrent toute une série de transactions moléculaires ayant l’ADN télomérique comme cible (activité chaperon des appariements ADN-ADN, nucléase, hélicase, polymérases…) (Figure 3B). Les télomères peuvent donc être considérés comme des machines moléculaires complexes intégrant différentes fonctions et capables de se remodeler au cours du cycle cellulaire, pendant le développement ou encore lors de la réponse au stress.
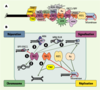 | Figure 3.
Organisation et activités des télomères humains. A. Interactions connues acide nucléique-protéine et protéine-protéine au niveau d’un télomère humain. Les répétitions d’ADN télomérique (TTAGGG) sont représentées par des lignes rouges ; la position relative des protéines le long de l’ADN télomérique est arbitraire, à l’exception des protéines POT1 connues pour interagir avec l’ADN 3’ sortant. B. Les protéines TRF1, TRF2 et POT1 sont engagées dans des interactions qui règlent plusieurs types d’activités concernant la structure de l’ADN télomérique (nucléase, hélicase, polymérase, recombinase, chaperon…). Ainsi, en inactivant XPF1/XRCC1, TRF2 préserve l’intégrité de l’ADN 3’ sortant (1). La protéine TRF2 est également impliquée dans la formation de boucles télomériques (t-loop) par une activité chaperon catalysant l’invasion de l’extrémité 3’ sortante dans le duplexe (2) [
29]. TRF2 interagit avec d’autres enzymes jouant un rôle important dans la conformation et la maturation de L’ADN télomérique : le complexe MRN, qui se comporte in vitro comme une endonucléase et une exonucléase 3’->5’ (3), les protéines WRN et BLM, qui sont des hélicases (4), dont l’activité peut être couplée, dans le cas de WRN, à une activité exonucléase (5). On ne sait pas encore si l’interaction avec TRF2 active ou inhibe les activités 3 à 5 (trait pointillé), mais il est clair que l’ensemble des activités contrôlées par TRF2 joue un rôle clé dans la structure et la conformation de l’ADN télomérique 3’ sortant. De son côté, TRF1 interagit avec de nombreuses protéines capables de moduler l’activité de la télomérase. C’est le cas des protéines TIN2 et POT1 ; ces interactions peuvent expliquer pourquoi le surdosage de TRF1 entraîne une diminution de la taille des télomères. Il a été également décrit que TRF1 favoriserait l’association de deux duplexes d’ADN télomériques (6), pouvant ainsi contribuer à la formation des t- loop ou à celle des associations intertélomériques dans le noyau interphasique. Il devient donc primordial d’élaborer des modèles intégrant ces différentes activités aux grandes fonctions cellulaires dans lesquelles interviennent les télomères (réparation, signalisation, structure des chromosomes et réplication). Cette intégration est certainement complexe, car il semble que les fonctions cellulaires des télomères dépendent de plusieurs activités, et qu’une activité puisse être impliquée dans différentes fonctions. Par exemple, la capacité de TRF2 de contrôler l’activité de XPF/ERCC1 (1) peut expliquer à la fois comment les télomères empêchent la ligature non homologue entre deux télomères, par la voie de réparation des cassures double-brin (appelée NHEJ, non-homologous end-joining), et comment l’ADN 3’ sortant est maintenu pour servir de substrat à la télomérase. |
Le fait que les protéines de la chromatine télomérique contrôlent la télomérase et les fonctions télomériques suggère que leur altération pourrait jouer un rôle dans l’oncogenèse chez l’homme. De fait, des modifications de l’expression de TRF1, TRF2 et POT1 commencent à être observées dans des cancers humains, que ce soit dans des carcinomes gastriques [
21,
22], dans des tumeurs intracrâniennes [
23], dans des tumeurs du sein [
24] ou bien dans des leucémies [
25]. De manière intéressante, l’expression de TRF1, mais pas de TRF2, est corrélée avec l’expression de la télomérase dans des lésions précancéreuses et cancéreuses du poumon [
26]. Une observation similaire a été effectuée dans des leucémies aiguës [25]. Il semble donc que, en accord avec les analyses in vitro, l’activité in vivo de la télomérase dans les tumeurs soit contrôlée par le niveau d’expression ou l’activité de TRF1, et probablement d’autres protéines comme TIN2 et les tankyrases. |
Implications pour la clinique Il émerge des nombreuses études récentes sur l’organisation fonctionelle des télomères que le statut télomérique d’une cellule doit être appréhendé au-delà des simples paramètres de taille des télomères et d’activité de la télomérase. Une exploration des télomères en biologie clinique devrait également inclure une étude de l’expression de l’ensemble des protéines impliquées dans la structure et la fonction des télomères, la recherche d’APB pour mettre en évidence des cellules ayant activé un processus ALT, et des mesures de l’instabilité télomérique (ponts anaphasiques, cassures chromosomiques, fusions télomériques, colocalisation des foyers de réparation et des télomères…). Ces analyses pourraient aider au diagnostic et au pronostic des cancers, ainsi qu’à la prédiction de la réactivité des cancers vis-à-vis de thérapies antitélomérase, voire antitélomère. Des stratégies antitélomérase sont actuellement à l’étude pour limiter la prolifération des tumeurs chez les patients. Ces approches nécessitent de connaître les fonctions de la télomérase impliquées dans la transformation maligne. Jusqu’à présent, il semblait clair que c’était la fonction catalytique de l’enzyme qui devait être ciblée ; cependant, certains travaux suggèrent que la télomérase joue d’autres rôles que de maintenir une taille correcte d’ADN télomérique, et que ces activités non conventionnelles sont importantes pour la transformation maligne [27]. Un de ces rôles pourrait être de moduler l’expression de gènes contrôlant la croissance cellulaire [
28] ou encore de modifier la structure de l’extrémité 3’ monocaténaire de l’ADN télomérique [2].

|
Malgré les informations déjà disponibles sur le rôle de la télomérase dans le processus de cancérisation, de nombreuses questions restent en suspens. Quel est le rôle des protéines télomériques dans les changements associés à la transformation maligne ? Quelles sont les activités non conventionnelles de la télomérase ? Quand sont-elles requises ? L’activité catalytique est-elle la seule cible thérapeutique pertinente de la télomérase ? On peut ainsi imaginer que différents états télomériques coexistent au sein d’une même tumeur, diminuant ainsi les chances de succès de thérapies uniquement ciblées sur l’activité télomérase : ainsi, par exemple, la prolifération de cellules ayant mis en place le mécanisme alternatif d’élongation de l’ADN télomérique (ALT) pourrait être sélectionnée, et donc favorisée lors de ces traitements. |
Les travaux effectués dans notre laboratoire sont soutenus par la Ligue Nationale contre le Cancer.
|
1. Cech TR. Beginning to understand the end of the chromosome. Cell 2004; 116 : 273–9. 2. Masutomi K, Yu EY, Khurts S, et al. Telomerase maintains telomere structure in normal human cells. Cell 2003; 114 : 241–53. 3. Gisselsson D. Chromosome instability in cancer : how, when, and why ? Adv Cancer Res 2003; 87 : 1–29. 4. O’Sullivan JN, Bronner MP, Brentnall TA, et al. Chromosomal instability in ulcerative colitis is related to telomere shortening. Nat Genet 2002; 32 : 280–4. 5. Artandi SE, Chang S, Lee SL, et al. Telomere dysfunction promotes non-reciprocal translocations and epithelial cancers in mice. Nature 2000; 406 : 641–5. 6. Rudolph KL, Millard M, Bosenberg MW, DePinho RA. Telomere dysfunction and evolution of intestinal carcinoma in mice and humans. Nat Genet 2001; 28 : 155–9. 7. Gabet AS, Mortreux F, Charneau P, et al. Inactivation of hTERT transcription by Tax. Oncogene 2003; 22 : 3734–41. 8. Kim NW, Piatyszek MA, Prowse KR, et al. Specific associations of human telomerase activity with immortal cells and cancer. Science 1994; 266 : 2011–4. 9. Greenberg RA, Chin L, Femino A, et al. Short dysfunctional telomeres impair tumorigenesis in the INK4a(delta2/3) cancer-prone mouse. Cell 1999; 97 : 515–25. 10. Gonzalez-Suarez E, Samper E, Flores JM, Blasco MA. Telomerase-deficient mice with short telomeres are resistant to skin tumorigenesis. Nat Genet 2000; 26 : 114–7. 11. Farazi PA, Glickman J, Jiang S, et al. Differential impact of telomere dysfunction on initiation and progression of hepatocellular carcinoma. Cancer Res 2003; 63 : 5021–7. 12. Hahn WC, Counter CM, Lundberg AS, et al. Creation of human tumour cells with defined genetic elements. Nature 1999; 400 : 464–8. 13. Elenbaas B, Spirio L, Koerner F, et al. Human breast cancer cells generated by oncogenic transformation of primary mammary epithelial cells. Genes Dev 2001; 15 : 50–65. 14. Lundberg AS, Randell SH, Stewart SA, et al. Immortalization and transformation of primary human airway epithelial cells by gene transfer. Oncogene 2002; 21 : 4577–86. 15. Bryan TM, Englezou A, Dalla-Pozza L, et al. Evidence for an alternative mechanism for maintaining telomere length in human tumors and tumor-derived cell lines. Nat Med 1997; 3 : 1271–4. 16. Seger YR, Garcia-Cao M, Piccinin S, et al. Transformation of normal human cells in the absence of telomerase activation. Cancer Cell 2002; 2 : 401–13. 17. Lazarov M, Kubo Y, Cai T, et al. CDK4 coexpression with Ras generates malignant human epidermal tumorigenesis. Nat Med 2002; 8 : 1105–14. 18. Brun C, Marcand S, Gilson E. Proteins that bind to double-stranded regions of telomeric DNA. Trends Cell Biol 1997; 7 : 317–24. 19. de Lange T. Protection of mammalian telomeres. Oncogene 2002; 21 : 532–40. 20. Ancelin K, Brunori M, Bauwens S, et al. Targeting assay to study the cis functions of human telomeric proteins : evidence for inhibition of telomerase by TRF1 and for activation of telomere degradation by TRF2. Mol Cell Biol 2002; 22 : 3474–87. 21. Miyachi K, Fujita M, Tanaka N, et al. Correlation between telomerase activity and telomeric-repeat binding factors in gastric cancer. J Exp Clin Cancer Res 2002; 21 : 269–75. 22. Kondo T, Oue N, Yoshida K, et al. Expression of POT1 is associated with tumor stage and telomere length in gastric carcinoma. Cancer Res 2004; 64 : 523–9. 23. Aragona M, De Divitiis O, La Torre D, et al. Immunohistochemical TRF1 expression in human primary intracranial tumors. Anticancer Res 2001; 21 : 2135–9. 24. Saito K, Yagihashi A, Nasu S, et al. Gene expression for suppressors of telomerase activity (telomeric-repeat binding factors) in breast cancer. Jpn J Cancer Res 2002; 93 : 253–8. 25. Ohyashiki JH, Hayashi S, Yahata N, et al. Impaired telomere regulation mechanism by TRF1 (telomere-binding protein), but not TRF2 expression, in acute leukemia cells. Int J Oncol 2001; 18 : 593–8. 26. Nakanishi K, Kawai T, Kumaki F, et al. Expression of mRNAs for telomeric repeat binding factor (TRF)-1 and TRF2 in atypical adenomatous hyperplasia and adenocarcinoma of the lung. Clin Cancer Res 2003; 9 : 1105–11. 27. Stewart SA, Hahn WC, O’Connor BF, et al. Telomerase contributes to tumorigenesis by a telomere length-independent mechanism. Proc Natl Acad Sci USA 2002; 99 : 12606–11. 28. Smith LL, Coller HA, Roberts JM. Telomerase modulates expression of growth-controlling genes and enhances cell proliferation. Nat Cell Biol 2003; 5 : 474–9. 29. Griffith JD, Comeau L, Rosenfield S, et al. Mammalian telomeres end in a large duplex loop. Cell 1999; 97 : 503–14. |