| |
| Med Sci (Paris). 2005 March; 21(3): 267–272. Published online 2005 March 15. doi: 10.1051/medsci/2005213267.Protéines LAP : de nouvelles clés de voûte de l’architecture épithéliale Fanny Jaulin-Bastard, Sebastien Nola, and Jean-Paul Borg* Laboratoire de Pharmacologie moléculaire, UMR 599 Inserm-Institut Paoli-Calmettes, 27, boulevard Leï Roure, 13009 Marseille, France |
En constant renouvellement, les tissus épithéliaux se forment à partir de cellules progénitrices soumises à une succession d’étapes de prolifération et de différenciation finement réglées. Cette plasticité et l’exposition fréquente aux agressions externes contribuent probablement à faire de ces tissus un terrain propice à l’émergence d’anomalies moléculaires et de cancers. En effet, 85 % des tumeurs humaines ont pour origine la transformation maligne de cellules épithéliales, provoquée par le dérèglement d’oncogènes et de gènes suppresseurs de tumeur à l’origine d’une prolifération cellulaire anarchique, d’une résistance accrue à l’apoptose, et d’altérations de la morphologie cellulaire. L’étude des processus de différenciation et de cancérisation du tissu épithélial suscite un vif intérêt et représente un défi du fait de la complexité des mécanismes impliqués. La bonne conservation de l’architecture épithéliale au cours de l’évolution, ainsi que des protéines clés impliquées, permet aux modèles génétiques C. elegans et D. melanogaster d’avoir une place de choix dans ce champ d’investigation et d’enrichir de façon considérable les connaissances obtenues chez les mammifères. |
Le tissu épithélial : un système cellulaire polarisé Les modalités d’organisation d’une monocouche de cellules épithéliales polarisées sont similaires chez la drosophile, le nématode et les mammifères, même si, dans le détail, il existe des spécificités propres à chaque espèce [
1]. Pour assurer leur fonction de barrière et d’échange, les cellules épithéliales sont organisées en deux compartiments membranaires structuralement et fonctionnellement distincts : la membrane apicale et la membrane basolatérale, délimitées par les jonctions étroites et adhérentes (Figure 1). Le pôle apical, en contact avec les fluides, est spécialisé dans l’échange d’ions et de nutriments, alors que le pôle basolatéral assure l’adhérence cellulaire et la communication entre les cellules. Les jonctions étroites représentent une structure protéique fortement cohésive et garantissent l’étanchéité (relative et modulable) épithéliale. Juste au-dessous, les jonctions adhérentes composées de E-cadhérine et du complexe intracellulaire β-caténine/α-caténine, ainsi que du complexe Nectine-AF6 (Figure 1), s’organisent dès les premiers stades de la formation du tissu polarisé et jouent un rôle central dans la cohésion de la monocouche épithéliale.
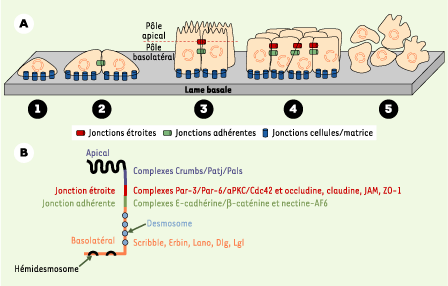
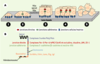 | Figure 1.
Différenciation des cellules épithéliales et tumorigenèse.A. Les cellules épithéliales adhèrent à la lame basale par l’intermédiaire des intégrines (jonctions cellules-matrice en bleu) (1) et, entre elles, par des jonctions adhérentes impliquant les cadhérines (en vert) (2). Les jonctions étroites (en rouge), formées dans un deuxième temps, délimitent le pôle apical et le pôle basolatéral (3). Au cours de la carcinogenèse, les cellules épithéliales prolifèrent de façon incontrôlée (forme bénigne ou hyperplasie) (4), puis perdent leur polarité (forme maligne ou néoplasie) (5). B. Localisation et composition des principaux complexes protéiques impliqués dans la polarité épithéliale. Les desmosomes (disques bleus) et hémidesmosomes (croissants noirs) sont représentés ici, mais pas sur les figures suivantes dans un effort de simplification. |
Au cours de la progression tumorale du stade bénin au stade malin, les cellules épithéliales perdent progressivement leur aspect cohésif et différencié sous l’effet du dérèglement de suppresseurs de tumeurs et d’oncogènes impliqués dans la prolifération cellulaire, l’apoptose, mais également dans la polarité cellulaire. C’est le cas de Lkb1, une sérine-thréonine kinase requise pour la polarité épithéliale, dont la perte de fonction entraîne le syndrome de Peutz-Jeghers, caractérisé par de multiples tumeurs bénignes et malignes [
2]. Chez la souris, l’élimination ciblée du gène α-caténine entraîne des anomalies majeures de l’épiderme et déclenche la formation de tumeurs cutanées en altérant probablement la connexion du complexe jonctionnel E-cadhérine/β-caténine au cytosquelette d’actine [
3]. Ce phénotype tumoral est également observé chez la drosophile lorsque Lethal giant larvae (Lgl), Discs large (Dlg), ou Scribble, trois protéines cytoplasmiques multimodulaires nécessaires pour la formation des jonctions épithéliales, ne sont plus fonctionnelles [
4,
5]. Alors que Dlg et Lgl sont connues depuis plus d’une décennie, la caractérisation de Scribble et de ses homologues est bien plus récente. |
Protéines LAP : une nouvelle famille de protéines jonctionnelles C’est en 2000 que fut dévoilée l’existence d’une nouvelle famille de protéines, baptisée LAP, un acronyme provenant des initiales de LRR and PDZ
(PSD-95/Disc-large/ZO-1) [
6]. Les membres de cette famille possèdent des caractéristiques structurales communes : 16 domaines LRR (leucine rich repeats) du côté amino-terminal, suivis de deux motifs LAPSD (LAP specific domain) a et b et de domaines PDZ (Figure 2) [
7]. Les protéines LAP sont exprimées chez les mammifères (hScrib, Erbin, Lano et Densin-180), ainsi que chez les invertébrés C. elegans (LET-413) et D. melanogaster (Scribble et dLAP1). Outre leur structure commune, Scribble, LET-413 et leurs homologues mammifères sont particulièrement concentrés dans la membrane basolatérale des cellules épithéliales et dans les jonctions septées chez la drosophile [7–
10]. La drosophile ne possède pas de jonctions étroites, mais des jonctions septées, situées sous les jonctions adhérentes, qui assurent la fonction de barrière paracellulaire et qui sont de composition différente des jonctions étroites.
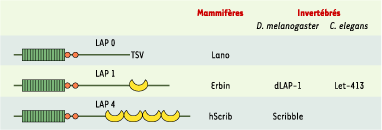
 | Figure 2.
Structure des protéines LAP. Chaque protéine LAP possède 16 motifs LRR (leucine rich repeat) amino-terminaux (rectangles verts), un domaine LAPSD (LAP specific domain) a et b (cercles orange), ainsi que des domaines PDZ (croissants jaunes) (excepté pour Lano). La région centrale de ces protéines (entre les domaines LAPSD et PDZ) est très peu conservée entre les différents membres de cette famille. |
Scribble et Let-413, deux gènes indispensables à la morphogenèse épithéliale Scribble et LET-413 sont requises pour l’établissement et le maintien de la polarité épithéliale chez les invertébrés [
8,
9]. Leur perte de fonction entraîne la mort des embryons en raison de sévères altérations de la polarité cellulaire et des fonctions épithéliales. L’origine de ce phénotype reste encore à élucider au niveau moléculaire, mais deux hypothèses sont actuellement proposées. Premièrement, Scribble et LET-413 pourraient participer à la formation d’une barrière étanche empêchant la diffusion de protéines apicales dans le compartiment basolatéral. Une deuxième hypothèse attribue aux protéines LAP un rôle dans l’adressage de vésicules de transport du compartiment trans-golgien vers la membrane apicale ou les jonctions étroites. La fuite de protéines apicales ou le mauvais adressage de protéines (ou lipides) cruciaux pour la polarité apicobasale seraient à l’origine des défauts observés chez les mutants. Cependant, le manque d’information sur les interacteurs protéiques de Scribble et LET-413 limite considérablement la réflexion sur les mécanismes d’action de ces protéines. Nous avons dernièrement démontré que les domaines LRR ont un rôle central dans la fonction de ces protéines, en les retenant au pôle basolatéral où elles participent probablement à la formation de complexes protéiques importants pour la morphogenèse épithéliale [
11]. Malgré leur forte homologie de séquence avec les domaines LRR de la protéine SUR-8, capable de fixer Ras et de moduler son activité [
12], nous n’avons pas pu mettre en évidence d’interaction entre les domaines LRR des protéines LAP et diverses petites protéines G (Rap, Arf6, Ras, Rac, Cdc42…). Les ligands des domaines LRR ne sont donc pas encore identifiés. Scribble, un suppresseur de tumeur chez la drosophile Au-delà des défauts de polarité épithéliale, la perte de fonction de Scribble entraîne une prolifération accentuée des cellules épithéliales et la formation de tumeurs néoplasiques [ 4]. Des études génétiques ont démontré l’étroite interdépendance fonctionnelle entre scribble, lgl et dlg dans l’homéostasie épithéliale et assignent ces trois suppresseurs de tumeur à une seule et même voie de signalisation connectée aux deux autres voies majeures de la morphogenèse épithéliale : Crumbs/Patj/Pals et Par-3/Par-6/aPKC [ 4,
13–
15]. Le complexe Par-3 contrôle la formation du pôle apical et est réprimé par Scribble, lui-même réprimé par le complexe Crumbs. Le contrôle de ces activités est essentiel pour délimiter les domaines apicaux et basolatéraux des cellules polarisées. L’expression de hScrib, orthologue humain de Scribble, chez des mouches déficientes en Scribble restaure relativement bien la polarité épithéliale, entraîne la régression des tumeurs et permet à un pourcentage non négligeable d’animaux (environ 25 %) d’atteindre l’âge adulte, démontrant une fonction bien conservée au cours de l’évolution [
16]. hScrib, cible d’oncoprotéines virales et acteur de la morphogenèse du tube neural Scribble a deux orthologues chez les mammifères, hScrib et Lano, qui présentent une forte homologie au niveau des domaines LRR et LAPSD. Peu de choses sont connues sur Lano qui, malgré l’absence de domaine PDZ, participe à l’agencement de complexes protéiques contenant ce type de modules [
17]. Pour sa part, hScrib a été initialement identifié comme un partenaire de l’oncoprotéine E6, une protéine virale codée par le papillomavirus humain à haut risque (high risk HPV-16), bien connu pour provoquer la formation de carcinomes génitaux [
18]. L’interaction entre ces protéines implique les deux derniers domaines PDZ de hScrib et la partie carboxyterminale de E6, reconnue comme un déterminant important de l’oncogénicité de la protéine [
19]. L’expression de E6 dans les cellules épithéliales induit la dégradation de hScrib par le protéasome, grâce à l’ubiquitine ligase E6AP associée à E6 [ 18], et participe probablement au pouvoir tumorigène de l’oncovirus (Figure 3).
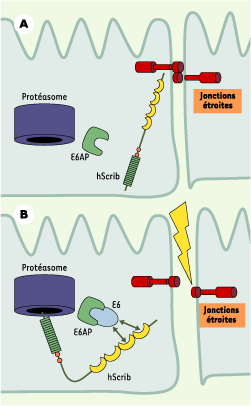
 | Figure 3.
Dégradation de hScrib provoquée par l’oncoprotéine virale E6 et tumorigenèse. La protéine E6AP est une ubiquitine ligase associée à E6, une oncoprotéine virale produite par le papillomavirus à haut risque (HPV-16). Lors de l’infection, l’oncoprotéine s’associe à hScrib et provoque sa dégradation par le protéasome grâce à E6AP, ce qui conduit à une altération de l’homéostasie épithéliale et participe donc à l’efficacité transformante du virus. |
Notre laboratoire a récemment identifié un des ligands « naturels » des domaines PDZ de hScrib : βPIX, un facteur d’échange de Rac1 et Cdc42, deux petites protéines G centrales dans la signalisation cellulaire et le contrôle de la polarité cellulaire [
20]. Comme cela a été évoqué précédemment chez la drosophile [
21,
22], les données fonctionnelles attribuent au complexe hScrib/βPIX un rôle dans l’exocytose réglée de vésicules, une étape majeure dans la migration et la polarité cellulaire. La fonction de hScrib a été en partie élucidée in vivo grâce à la caractérisation de souris circletail porteuses d’une mutation dans le gène hScrib et qui présentent des défauts sévères de la fermeture du tube neural conduisant à la mort, peu après la naissance [
23]. L’origine du déficit est actuellement peu claire, mais les auteurs privilégient un défaut de migration des cellules du neuroépithélium formant le tube neural. Ces souris circletail présentent également un défaut de polarité planaire dans les cellules auditives de l’oreille interne provoquant une orientation anarchique des villosités, une anomalie retrouvée chez d’autres souris mutantes affectées par des défauts du tube neural [
24]. Cependant, les anomalies sévères de tube neural des souris circletail rendent impossible l’observation d’un effet suppresseur de tumeur de hScrib. Il faudra donc attendre la production de souris hScrib−/− permettant l’élimination du gène chez l’adulte (knock-out conditionnel) pour apprécier son éventuel rôle dans la tumorigenèse. Erbin, une « prise multiple » pour acteurs de la prolifération et de la différenciation épithéliale Erbin (ErbB2 interacting protein) a été découverte grâce à un crible de double hybride chez la levure destiné à identifier de nouveaux partenaires de l’oncoprotéine ErbB2, un membre de la famille des récepteurs de l’EGF [ 10,
25] (Figure 4). Des travaux récents ont démontré l’implication de Erbin dans la régulation négative de la voie Ras-MAPK activée par ErbB2 en interagissant avec la forme activée de Ras [
26]. Erbin interagit également avec les protéines Smad, maillons incontournables de la signalisation du TGFβR impliqué dans la transition épithéliale-mésenchyme [
27].
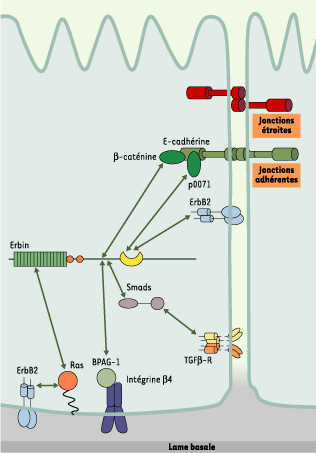
 | Figure 4.
Réseaux moléculaires associés à Erbin. Erbin est une protéine basolatérale associée non seulement à des voies de régulation de la prolifération cellulaire (Ras/MAPK et ErbB2, Smad et récepteur du TGFβ), mais aussi à des complexes protéiques impliqués dans l’interaction entre cellules (β-caténine et p0071, deux caténines associées à E-cadhérine) et cellule-matrice extracellulaire (intégrine β4 et BPAG-1 [bullous pemphigoid antigen-1]). Les flèches indiquent les interactions entre Erbin et ses partenaires. |
Erbin n’est pas seulement impliquée dans des réseaux moléculaires de signalisation, mais est également au cœur d’intéressants complexes protéiques participant à l’adhérence cellulaire. Erbin est associée à BPAG-1 (bullous pemphigoid antigen 1) et à l’intégrine β4, deux protéines des hémidesmosomes, des structures denses aux électrons impliquées dans l’adhérence des cellules aux matrices extracellulaires (Figure 4) [
28]. Rappelons que ces structures sont localisées dans le domaine basal, au contact des matrices extracellulaires, et sont de composition différente des desmosomes localisés dans les membranes latérales (Figure 1). Il reste à déterminer le rôle joué par Erbin dans ce complexe d’adhérence aux matrices extracellulaires. Plus convaincantes sont les données attribuant à Erbin un rôle dans le maintien des contacts entre cellules grâce à son interaction avec des protéines telles que p0071, δ-caténine et ARVCF (armadillo repeat gene deletes in velocardiofacial syndrome), trois protéines de la famille des p120 caténines [
29,
30]. Le domaine PDZ d’Erbin est impliqué dans ces associations installées dans les jonctions adhérentes et dans les desmosomes, les « boutons pressions » de la membrane latérale structurés autour des cadhérines desmosomiques, les desmocollines et les desmogléines. P0071, δ-caténine et ARVCF se fixent à la région juxtamembranaire des cadhérines par leurs domaines armadillo et participent probablement aux fonctions d’adhérence et/ou de signalisation de ces protéines de surface, tout comme p120-caténine. Grâce à p0071, mais également à β-caténine (données non publiées), Erbin est donc connectée à E-cadhérine [30], un acteur central de la formation des jonctions adhérentes (Figure 4). Il semble donc que Erbin entretienne des relations étroites, d’une part avec le couple de protéines jonctionnelles p0071-E-cadhérine, dont le rôle est probablement important pour la formation des jonctions cellulaires, mais, d’autre part, avec la β-caténine qui participe à la fois à la formation des jonctions lorsqu’elle est associée à E-cadhérine, et à la voie de signalisation Wnt lorsqu’elle fait partie du complexe cytoplasmique contenant APC (adenomatous polyposis coli), Axin et GSK-3 [
31]. GSK-3 est une sérine thréonine kinase phosphorylant la β-caténine et entraînant celle-ci vers la dégradation par le protéasome. L’activité constitutive de la β-caténine, remarquée dans divers cancers (côlon, sein…), due à des mutations ou à des troncations de la ʱ-caténine ou de APC, produit une surexpression des oncogènes c-myc et cycline D1. En s’associant à la β-caténine, Erbin pourrait donc moduler la fonction de E-cadhérine et/ou la voie Wnt et ainsi participer au maintien de l’homéostasie épithéliale. Le rôle des différentes interactions moléculaires centrées sur Erbin reste encore à élucider in vivo, mais il est cependant intéressant de noter que ce canevas moléculaire comprend des acteurs majeurs de la prolifération (ErbB2, Ras, β-caténine) et de la différenciation cellulaire (Smad, E-cadhérine, β4 intégrine). Nous retiendrons également de ces premières études que plusieurs des partenaires de Erbin sont codés par des gènes suppresseurs de tumeur ou des oncogènes reconnus (ErbB2, β-caténine, E-cadhérine), suggérant son implication dans la tumorigenèse. Il faudra cependant attendre l’analyse des souris erbin−/−
pour préciser la fonction de cette protéine LAP et son implication en physiopathologie. |
Les études génétiques conduites chez les invertébrés, ainsi que l’identification des réseaux d’interactions moléculaires associés aux protéines LAP chez les mammifères, indiquent que cette famille de protéines est impliquée dans l’établissement et le maintien de la polarité cellulaire, mais également dans le contrôle de la prolifération cellulaire. La conservation des protéines LAP au cours de l’évolution est un argument de poids pour suggérer une fonction conservée entre invertébrés et vertébrés, une hypothèse d’ailleurs en partie vérifiée pour Scribble. Les futures expériences d’extinction in vitro (siRNA) et in vivo (knock-out) devraient permettre de mieux apprécier l’implication de Erbin, hScrib et Lano dans l’installation et le maintien de la polarité épithéliale et leur rôle en pathologie. |
Un grand merci à Daniel Birnbaum pour ses conseils lors de la rédaction de ce manuscrit et pour les discussions stimulantes que nous avons pu avoir. F.J.B. est allocataire d’une bourse du ministère de la Recherche et de la Technologie. S.N. est allocataire d’une bourse de La Ligue Nationale contre le Cancer. Le Laboratoire de Pharmacologie moléculaire est soutenu par l’Inserm, l’Institut Paoli-Calmettes, La Ligue contre Le Cancer (Équipe labellisée), et une Aide Concertée Incitative « Jeune Chercheur » du Ministère et de la Fondation de France.
|
1. Nelson WJ. Adaptation of core mechanisms to generate cell polarity. Nature 2003; 422 : 766–74. 2. Boudeau J, Sapkota G, Alessi DR. LKB1, a protein kinase regulating cell proliferation and polarity. FEBS Lett 2003; 546 : 159–65. 3. Vasioukhin V, Bauer C, Degenstein L, et al. Hyperproliferation and defects in epithelial polarity upon conditional ablation of alpha-catenin in skin. Cell 2001; 104 : 605–17. 4. Bilder D, Li M, Perrimon N. Cooperative regulation of cell polarity and growth by Drosophila tumor suppressors. Science 2000; 289 : 113–6. 5. Humbert P, Russell S, Richardson H. Dlg, Scribble and Lgl in cell polarity, cell proliferation and cancer. BioEssays 2003; 25 : 542–53. 6. Bilder D, Birnbaum D, Borg JP, et al. Collective nomenclature for LAP proteins. Nat Cell Biol 2000; 2 : E114. 7. Santoni MJ, Pontarotti P, Birnbaum D, Borg JP. The LAP family : a phylogenetic point of view. Trends Genet 2002; 18 : 494–7. 8. Bilder D, Perrimon N. Localization of apical epithelial determinants by the basolateral PDZ protein Scribble. Nature 2000; 403 : 676–80. 9. Legouis R, Gansmuller A, Sookhareea S, et al. LET-413 is a basolateral protein required for the assembly of adherens junctions in Caenorhabditis elegans. Nat Cell Biol 2000; 2 : 415–22. 10. Borg JP, Marchetto S, Le Bivic A, et al. ERBIN : a basolateral PDZ protein that interacts with the mammalian ERBB2/HER2 receptor. Nat Cell Biol 2000; 2 : 407–14. 11. Legouis R, Jaulin-Bastard F, Schott S, et al. Basolateral targeting by leucine-rich repeat domains in epithelial cells. EMBO Rep 2003; 4 : 1096–102. 12. Sieburth DS, Sun Q, Han M. SUR-8, a conserved Ras-binding protein with leucinerich repeats, positively regulates Ras-mediated signaling in C. elegans. Cell 1998; 94 : 119–30. 13. Bilder D, Schober M, Perrimon N. Integrated activity of PDZ protein complexes regulates epithelial polarity. Nat Cell Biol 2003; 5 : 53–8. 14. Medina E, Lemmers C, Lane-Guermonprez L, Le Bivic A. Role of the Crumbs complex in the regulation of junction formation in Drosophila and mammalian epithelial cells. Biol Cell 2002; 94 : 305–13. 15. Roh MH, Margolis B. Composition and function of PDZ protein complexes during cell polarization. Am J Physiol Renal Physiol 2003; 285 : F377–87. 16. Dow LE, Brumby AM, Muratore R, et al. hScrib is a functional homologue of the Drosophila tumour suppressor Scribble. Oncogene 2003; 22 : 9225–30. 17. Saito H, Santoni MJ, Arsanto JP, et al. Lano, a novel LAP protein directly connected to MAGUK proteins in epithelial cells. J Biol Chem 2001; 276 : 32051–5. 18. Nakagawa S, Huibregtse JM. Human scribble (Vartul) is targeted for ubiquitinmediated degradation by the high-risk papillomavirus E6 proteins and the E6AP ubiquitin-protein ligase. Mol Cell Biol 2000; 20 : 8244–53. 19. Nguyen MM, Nguyen ML, Caruana G, et al. Requirement of PDZ-containing proteins for cell cycle regulation and differentiation in the mouse lens epithelium. Mol Cell Biol 2003; 23 : 8970–81. 20. Audebert S, Navarro C, Nourry C, et al. Mammalian Scribble forms a tight complex with the αPIX exchange factor. Curr Biol 2004; 14 : 987–95. 21. Parnas D, Haghighi AP, Fetter RD, et al. Regulation of postsynaptic structure and protein localization by the Rho-type guanine nucleotide exchange factor dPix. Neuron 2001; 32 : 415–24. 22. Roche JP, Packard MC, Moeckel-Cole S, Budnik V. Regulation of synaptic plasticity and synaptic vesicle dynamics by the PDZ protein Scribble. J Neurosci 2002; 22 : 6471–9. 23. Murdoch JN, Henderson DJ, Doudney K, et al. Disruption of scribble (Scrb1) causes severe neural tube defects in the circletail mouse. Hum Mol Genet 2003; 12 : 87–98. 24. Schweisguth F. Genetic basis of planar polarity. Med Sci
(Paris) 2004; 20 : 424–30. 25. Huang YZ, Wang Q, Xiong WC, Mei L. Erbin is a protein concentrated at postsynaptic membranes that interacts with PSD-95. J Biol Chem 2001; 276 : 19318–26. 26. Huang YZ, Zang M, Xiong WC, et al. Erbin suppresses the MAP kinase pathway. J Biol Chem 2003; 278 : 1108–14. 27. Warner DR, Pisano MM, Roberts EA, Greene RM. Identification of three novel Smad binding proteins involved in cell polarity. FEBS Lett 2003; 539 : 167–73. 28. Favre B, Fontao L, Koster J, et al. The hemidesmosomal protein bullous pemphigoid antigen 1 and the integrin beta 4 subunit bind to ERBIN. Molecular cloning of multiple alternative splice variants of ERBIN and analysis of their tissue expression. J Biol Chem 2001; 276 : 32427–36. 29. Jaulin-Bastard F, Arsanto JP, Le Bivic A, et al. Interaction between Erbin and a Catenin-related protein in epithelial cells. J Biol Chem 2002; 277 : 2869–75. 30. Laura RP, Witt AS, Held HA, et al. The Erbin PDZ domain binds with high affinity and specificity to the carboxyl termini of delta-catenin and ARVCF. J Biol Chem 2002; 277 : 12906–14. 31. Giles RH, van Es JH, Clevers H. Caught up in a Wnt storm : Wnt signaling in cancer. Biochim Biophys Acta 2003; 1653 : 1–24. |