L’épiderme, la couche la plus externe de la peau, assure une fonction de bar-rière protectrice essentielle pour l’organisme. Il est indispensable à toute vie terrestre car il empêche la perte des fluides corporels et s’oppose aux agressions physiques et chimiques ainsi qu’à la pénétration des agents pathogènes. Ce rempart est assuré par la couche cornée, couche superficielle de l’épiderme en contact avec l’environnement extérieur, constituée de kératinocytes (cornéocytes) énucléés, aplatis, totalement différenciés et inclus dans une matrice lipidique. L’épaisseur de cette couche est finement contrôlée par le processus de desquamation au cours duquel les cornéocytes les plus superficiels se détachent de la surface de la peau. Notre équipe vient de montrer que ce processus est profondément perturbé dans une maladie génétique sévère de la peau, le syndrome de Netherton.
Le syndrome de Netherton (OMIM n° 256500) est une génodermatose rare, à transmission autosomique récessive, caractérisée par une érythrodermie ichtyosiforme congénitale, une dysplasie pilaire spécifique (trichorrhexis invaginata ou cheveux bambous) et des manifestations atopiques [ 1, 2]. Les enfants atteints de cette maladie présentent une érythrodermie exfoliative pouvant persister toute la vie pour les cas les plus sévères, ou laisser place à une ichtyose linéaire circonflexe évoluant par poussées [1]. Des complications menaçant le pronostic vital sont fréquentes en période néonatale (infections bactériennes, déshydratation hypernatrémique, perte de poids rapide) et sont associées à une altération sévère de la barrière cutanée [ 3].
Nous avons précédemment identifié le gène dont les anomalies sont responsables de ce syndrome [ 4]. Il s’agit de SPINK5 (serine protease inhibitor kazal type 5) qui code pour l’inhibiteur de protéases à sérine LEKTI (lympho epithelial kazal type inhibitor), appartenant à la famille des inhibiteurs de type Kazal [ 5] et fortement exprimé dans la couche granuleuse de l’épiderme [ 6]. LEKTI est constituée de 15 domaines inhibiteurs de protéases à sérine et peut inhiber efficacement la trypsine in vitro [5]. Toutes les mutations de SPINK5 identifiées à ce jour chez les patients entraînent l’apparition de codons stop prématurés et conduisent à l’absence d’expression de LEKTI [4, 6]. Une activité de type trypsine anormalement élevée a été mise en évidence dans la couche cornée de patients [ 7], mais les fonctions de LEKTI restaient encore mal comprises. Afin de mieux comprendre le rôle physiologique de LEKTI dans l’homéostasie de l’épiderme, nous avons développé des souris Spink5−/− en invalidant le gène par recombinaison homologue [ 8].
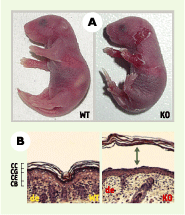
Les souris Spink5−/− présentent dès la naissance des érosions cutanées superficielles résultant d’une perte d’adhérence de la couche cornée à l’épithélium sous-jacent (Figure 1). Ces souris meurent de déshydratation quelques heures après la naissance en raison d’un défaut sévère de la barrière cutanée. Le détachement de l’épiderme se produit à la transition entre couche granuleuse et couche cornée, par clivage asymétrique des desmosomes. Ces anomalies sont similaires à celles observées dans la couche granuleuse superficielle des patients atteints de syndrome de Netherton [ 9]. Nous avons montré chez les souris Spink5−/− que ces anomalies sont provoquées par la dégradation de la desmogléine 1, protéine desmosomale majoritairement exprimée dans les dernières couches vivantes de l’épiderme et responsable des propriétés d’adhérence des desmosomes. Cette dégradation est la conséquence de l’augmentation de l’activité protéolytique des protéases épidermiques SCTE (stratum corneum tryptic enzyme) et SCCE (stratum corneum chymotryptic enzyme). Ces protéases à sérine sont sécrétées à la transition entre la couche granuleuse et la couche cornée, et sont impliquées dans la protéolyse des cornéodesmosomes au cours du processus de desquamation [ 10]. La SCTE peut dégrader la desmogléine 1 in vitro, et LEKTI inhibe la trypsine in vitro [5]. La dégradation de la desmogléine 1 chez les souris Spink5−/− résulte donc très vraisemblablement d’une absence d’inhibition de la SCTE par LEKTI. La SCTE étant aussi impliquée dans l’activation protéolytique de la pro-SCCE, l’augmentation de l’activité de la SCCE chez les souris Spink5−/− pourrait être due à l’activation non contrôlée de la pro-SCCE par la SCTE en l’absence de LEKTI.
| Figure 1.
Décollement de la couche cornée des souris Spink5−/−.
A. Les souris Spink5−/−
(KO) présentent dès la naissance des décollements superficiels étendus de la peau. B. La coloration par hématoxyline/éosine de coupes de peau montre une séparation entre la couche granuleuse (CG) et la couche cornée (CC) de l’épiderme chez les souris Spink5−/−. CB : couche basale ; CE : couche épineuse ; de : derme ; WT : souris normale. |
La perte d’adhérence de la couche cornée chez les souris Spink5−/− rappelle deux affections humaines : le syndrome d’épidermolyse staphylococcique et le pemphigus foliacé, dans lesquels la desmogléine 1 est la cible, respectivement, de la protéase à sérine staphylococcique ETA et d’auto-anticorps anti-desmogléine 1.
Les souris Spink5−/− présentent aussi des anomalies majeures de la différenciation terminale de l’épiderme mises en évidence lorsque la peau des souris nouveau-nés est greffée sur des souris immunodéficientes. La peau greffée montre un épaississement marqué de la couche cornée et des couches suprabasales de l’épiderme, associé à une perte d’adhérence de la couche cornée et à la présence d’infiltrats inflammatoires dermiques. Ces lésions reproduisent fidèlement le phénotype du syndrome de Netherton.
Comme chez les patients atteints du syndrome de Netherton, les altérations de l’épiderme sont associées à des anomalies des follicules pileux. Chez les souris Spink5−/− , les cellules de la gaine épithéliale interne perdent leurs contacts intercellulaires, compromettant ainsi leur rôle dans l’accompagnement de la croissance de la tige pilaire. Ces anomalies pourraient ainsi expliquer la pathogénie des cheveux bambous, dans lesquels la partie distale du cheveux s’invagine dans sa partie proximale.
En conclusion, ces travaux nous ont permis d’élucider les événements moléculaires pathologiques à l’origine de l’érythrodermie exfoliative sévère que présentent les enfants atteints du syndrome de Netherton. L’absence de LEKTI chez les souris Spink5−/− provoque l’augmentation de l’activité protéolytique des protéases épidermiques SCTE et SCCE. L’hyperactivité de ces enzymes conduit à la dégradation de la desmogléine 1, ce qui fragilise les desmosomes et entraîne un défaut de l’adhérence de la couche cornée à l’épithélium sous-jacent. La perte de la barrière cutanée entraîne une déshydratation sévère et facilite la pénétration des pathogènes et des allergènes chez les patients. Nos résultats permettent d’envisager dès à présent le développement de stratégies thérapeutiques visant à réguler l’activité des protéases SCTE et SCCE afin de restaurer la fonction de barrière cutanée chez ces patients. Ces travaux nous conduisent aussi à étudier la fonction de ces protéases épidermiques et de leurs inhibiteurs dans la pathogénie de maladies cutanées beaucoup plus fréquentes comme la dermatite atopique.