| |
| Med Sci (Paris). 2005 August; 21(8-9): 747–752. Published online 2005 August 15. doi: 10.1051/medsci/2005218-9747.Rôles des aquaporines dans le cerveau Céline F. Guérin, Luca Regli, and Jérôme Badaut* Groupe de recherche neurochirurgicale, Centre Hospitalier Universitaire Vaudois, Pavillon 3, Beaumont, 1011 Lausanne, Suisse |
L’eau représente plus de 65 % des molécules chez les êtres vivants. De grandes quantités d’eau diffusent à travers les membranes plasmiques des cellules végétales ou animales. Savoir comment l’eau passe à travers les membranes cellulaires est une des questions fondamentales de la biologie. L’eau peut diffuser directement à travers la bicouche lipidique de la membrane cellulaire, mais le flux par cette voie est lent et non soumis à des régulations. L’existence de pores à eau a été suspectée depuis longtemps dans la membrane des globules rouges, car la perméabilité de ces cellules est supérieure à celle d’une bicouche lipidique de surface équivalente. Le premier membre de la famille des canaux à eau, appelé aquaporine 1 (AQP1), a été identifié en 1992 par Peter Agre et ses collègues [
1]. Actuellement, cette famille de protéines est composée de onze membres chez les mammifères et plus de 150 dans les plantes, les invertébrés et les non-mammifères [
2]. Les AQP sont assemblées en tétramère dont chaque monomère est composé d’un canal à eau. L’AQP est formée par six segments trans-membranaires (Figure 1A) et le poids moléculaire de la protéine est compris entre 26 kDa et 34 kDa [2] (Figure 1B). Malgré une certaine homologie entre les parties carboxy et aminoterminales, la famille des AQP se divise en deux groupes, en fonction de leur perméabilité et de leurs homologies de séquences [2] : les aquaporines sont toutes des AQP uniquement perméables à l’eau alors que les aquaglycéroporines sont des canaux perméables au glycérol, à l’urée, voire à d’autres solutés (Figure 1B). En effet, l’AQP9 laisse diffuser également les monocarboxylates tels que le lactate et le β-hydroxybutyrate et des métaux comme l’arsenic [
3]. La séquence d’acides aminés composant le canal détermine les charges ioniques et le diamètre du pore, responsables de la perméabilité des canaux [3]. Chez les mammifères, les AQP sont largement distribuées dans l’ensemble des organes comme le rein, les poumons mais aussi dans le système nerveux central (SNC) [
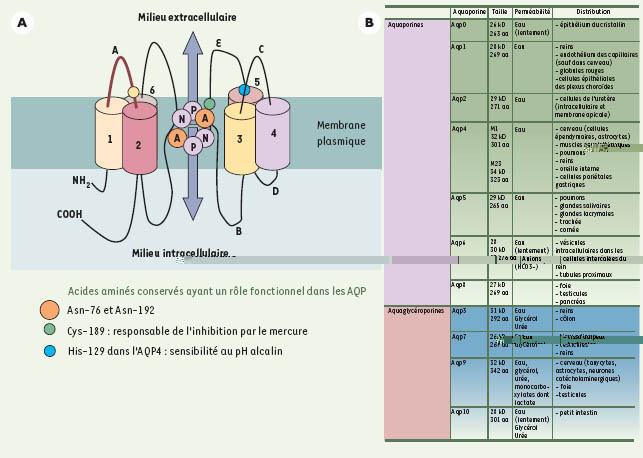
4]. Ces AQP sont des protéines régulées par différentes hormones ou facteurs et sont impliquées dans de nombreuses pathologies cérébrales.  | Figure 1.
Schéma d’une molécule d’aquaporine (A) et tableau des différents sous-types d’AQP exprimés chez les mammifères (B). A. Les AQP sont composées de tétramères et chaque monomère forme un canal à eau. Le monomère est constitué de six segments transmembranaires en hélice α organisés en deux hémi-canaux symétriques (B et E). Ils sont très conservés et contiennent chacun une séquence Asn-Pro-Ala (NPA) qui, juxtaposées, forment le pore dans la membrane plasmique. La perméabilité est déterminée en partie par les asparagines 76 et 192 composant les motifs NPA qui exposent leurs résidus polaires pouvant se lier à l’hydrogène de l’eau. La perméabilité à l’eau des AQP peut être modifiée par le pH qui va provoquer des modifications de charges. Les histidines des boucles externes A et C jouent un rôle important, notamment l’histidine 129 de l’AQP4 qui participe à la sensibilité au pH alcalin en augmentant la perméabilité à l’eau d’un facteur 1,9. Le passage de l’eau à travers certaines AQP est inhibé par le mercure. La cystéine 189 dans la boucle E, proche du motif NPA, est le site responsable de l’inhibition des AQP par le mercure pour AQP1 et AQP9. Une des particularités de AQP4 est de ne pas avoir cette cystéine et d’être insensible au mercure. B. Les onze AQP décrites et clonées chez les mammifères sont classées en deux grandes catégories en fonction de leur homologie de séquence et de leur perméabilité. Les aquaporines sont essentiellement perméables à l’eau. Le coefficient de perméabilité varie en fonction du sous-type, AQP1 laissant passer moins d’eau que AQP4. AQP4 présente deux isoformes M1 et M23 exprimées dans les astrocytes. L’isoforme M23 favorise la formation des OAP (orthogonal arranged particles) localisées dans les pieds astrocytaires. Les aquaglycéroporines sont perméables à l’eau, mais également au glycérol et à l’urée. L’AQP9 est également perméable aux monocarboxylates. aa : acides aminés. Aqp : aquaporines. |
|
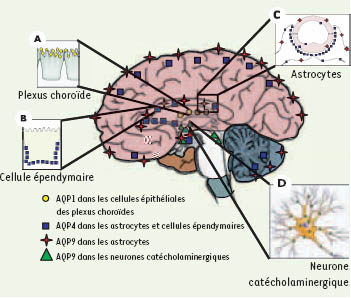
Distribution des aquaporines dans le système nerveux central Actuellement, AQP1, AQP4, AQP9 sont les trois AQP principalement décrites dans le SNC par différents groupes [4] (Figure 2). Sur des cultures primaires de neurones ou d’astrocytes, trois autres AQP ont été décrites, AQP3, AQP5 et AQP8, mais jusqu’ici, la présence de ces AQP n’a jamais été clairement décrite in vivo [4]. Dans cette revue, nous nous sommes focalisés sur le SNC, mais des AQP ont été également identifiées dans l’œil et l’oreille interne : l’AQP1 et l’AQP4, en particulier, pourraient jouer un rôle dans l’audition [
5]. 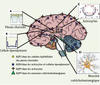 | Figure 2.
Distribution des aquaporines dans le cerveau. L’aquaporine AQP1 (rond jaune) est exprimée à la membrane apicale des cellules épithéliales des plexus choroïdes (A) et participerait à la formation du liquide céphalorachidien. L’AQP4 (carré bleu) est exprimée sur les cellules épendymaires bordant les ventricules (B) et dans tous les astrocytes du système nerveux (C). L’AQP4 est polarisée sur les pieds astrocytaires en contact avec les vaisseaux cérébraux (C). L’AQP4 serait impliquée dans l’homéostasie de l’eau. L’aquaglycéroporine AQP9 est localisée dans les astrocytes (étoile rouge) (C), dans l’endothélium des vaisseaux cérébraux et dans les neurones catécholaminergiques (triangle vert) (D). Les travaux récents suggèrent que l’AQP9 serait impliquée dans le métabolisme énergétique (modifié d’après [
33]). |
L’AQP1, pore à eau et à cations, est principalement localisée sur les cellules épithéliales des plexus choroïdes (Figure 2A). La délétion du gène Aqp1 a pour conséquence de diminuer la production du liquide céphalo-rachidien (LCR), suggérant un rôle de cette AQP dans la formation de celui-ci [
6]. Historiquement, l’AQP4 est la première AQP détectée par hybridation in situ dans le parenchyme cérébral [
7]. L’AQP4 est exprimée dans les cellules épendymaires et sur la glie limitante [
8,
9] (Figure 2). Cette localisation suggère aussi un rôle potentiel de cette AQP dans la formation du LCR. L’AQP4 est exprimée dans les astrocytes [9] et présente une polarisation sur les pieds astrocytaires en contact avec les vaisseaux cérébraux [
10] (Figures 2 et 3). Des expériences récentes de cocultures ont montré que la présence de cellules endothéliales était nécessaire pour induire cette polarisation [
11]. L’AQP4 périvasculaire est localisée dans des figures géométriques observables en microscopie électronique après cryo-fracture, les OAP (orthogonal arranged particles) [
12]. Les OAP sont localisées d’une part dans les pieds astrocytaires en contact avec des vaisseaux, et d’autre part, dans les pieds astrocytaires de la glie limitante en contact avec le LCR [12]. La polarisation de l’AQP4 sur les pieds astrocytaires (Figure 3C) se fait au moyen d’un ancrage de cette protéine par un domaine PDZ sur l’α-syntrophine (α-Syn) ou la dystrophine [
13]. En effet, la polarisation de l’AQP4 autour des vaisseaux disparaît dans les cerveaux de souris présentant une délétion du gène de l’α-Syn (souris α-Syn−/−
) ou de la dystrophine (souris Mdx) [13]. Dans certaines régions cérébrales, l’AQP4 est localisée sur l’ensemble des prolongements astrocytaires, comme dans la substance blanche et dans la couche CA1 de l’hippocampe [8]. L’AQP4 semble être plus exprimée aux endroits où l’espace extracellulaire est faible, suggérant un rôle important de l’AQP4 dans l’homéostasie du milieu extracellulaire [8]. En effet, des études récentes in vitro ont montré que des mouvements d’eau passant par l’AQP4 accompagnaient les flux de potassium dans les astrocytes pendant une activité neuronale [
14]. Par ailleurs, les souris α-Syn−/−
, caractérisées par une absence d’AQP4 sur les pieds astrocytaires périvasculaires, présentent une perturbation de l’homéostasie du potassium et de l’eau [13]. L’ensemble de ces travaux semble indiquer que l’AQP4 est impliquée dans l’homéostasie du milieu extracellulaire en facilitant les mouvements d’eau entre les différents compartiments cellulaires lors d’une activité neuronale. 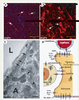 | Figure 3.
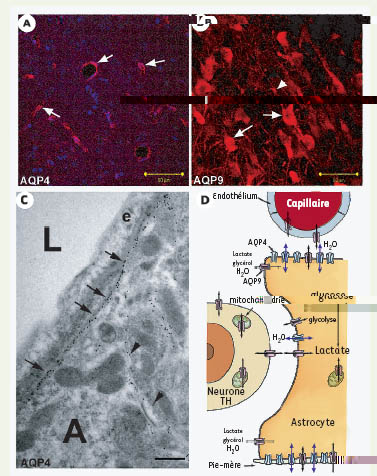
Distribution de AQP4 (A, C) et AQP9 dans le cerveau des rongeurs (B). Distribution cellulaire des AQP dans le parenchyme nerveux (D). A. Marquage immunohistochimique de l’AQP4 (rouge) sur le contour des vaisseaux intracérébraux quel que soit leur diamètre (flèches). B. Marquage immunohistochimique de l’AQP9 (rouge) dans la substantia nigra compacta. Le corps cellulaire (flèches) et les prolongements des neurones (têtes de flèche) sont marqués par l’anti-AQP9. C. Illustration en microscopie électronique de la polarisation de l’AQP4 sur les pieds astrocytaires. Le marquage immunocytochimique de l’AQP4 est visualisé par des particules d’or (flèches et têtes de flèche) sur la membrane cytoplasmique des astrocytes (A). Une forte densité de ces particules est localisée sur les pieds astrocytaires (flèches) en contact avec l’endothélium (e) des capillaires. La densité de ces particules diminue sur le reste de la membrane plasmatique de l’astrocyte (têtes de flèche). La lumière du capillaire est indiquée par L (cette illustration a été gracieusement offerte par le Dr M. Amiry-Moghadam, Université d’Oslo, Norvège). D. Schéma de la distribution cellulaire des deux AQP du parenchyme nerveux. L’AQP4 (en bleu) est exprimée uniquement sur les astrocytes et présente une forte densité sur les pieds astrocytaires en contact avec les vaisseaux cérébraux et la pie-mère. Lors d’une activité neuronale, l’excès de potassium libéré dans le milieu extracellulaire est absorbé par l’astrocyte qui le libère à proximité du vaisseau et de la pie-mère. La localisation de l’AQP4 et les données de la littérature suggèrent que cette aquaporine serait impliquée dans les mouvements d’eau (flèches bleues) accompagnant le flux de potassium dans les astrocytes. L’AQP9 est présente dans l’endothélium des vaisseaux, les astrocytes et dans les neurones catécholaminergiques (révélé par la tyrosine hydroxylase, TH) [
16]. Des études en microscopie électronique ont montré que l’AQP9 est localisée dans la membrane plasmique et dans les mitochondries des astrocytes et des neurones (communication personnelle du Dr M. Amiry-Moghadam, Université d’Oslo, Norvège [
32]). L’AQP9 laisse diffuser l’eau, mais aussi et surtout, le glycérol et les monocarboxylates. Sa présence sur les cellules endothéliales des vaisseaux cérébraux permettrait une diffusion facilitée de ces solutés dans le parenchyme nerveux. Les monocarboxylates et le glycérol sont des substrats énergétiques qui peuvent être utilisés au même titre que le glucose. La présence de l’AQP9 sur ces cellules faciliterait l’accès de ces solutés. L’AQP9 aurait un rôle important dans le métabolisme énergétique cérébral (échelles : A, B = 50 µm ; C = 0,5 µm). |
Par hybridation in situ, des ARNm de l’AQP4 ont été détectés dans les noyaux hypothalamiques osmosensibles, incluant les noyaux supraoptiques et les noyaux paraventriculaires [7]. Dans ces derniers, l’AQP4 est distribuée sur l’ensemble des prolongements astrocytaires. Ainsi, cette dernière faciliterait la diffusion de l’eau de la lumière des vaisseaux vers les neurones osmosensibles et contribuerait également à la détection des variations de pression osmotique plasmatique [8, 9]. Outre les deux aquaporines AQP1 et AQP4, des travaux récents ont montré la présence de l’AQP9, une aquaglycéroporine, dans le SNC (Figures 2 et 3) [3]. En plus de l’eau, l’AQP9 est aussi perméable au glycérol, aux monocarboxylates (dont le lactate) et à l’urée [3]. Cette AQP est exprimée dans les tanycytes [
15], les astrocytes [15, 16] et très récemment, nous avons pu montrer par immunohistochimie la présence de l’AQP9 dans l’endothélium des vaisseaux cérébraux et dans les neurones catécholaminergiques (Figure 2, 3B, 3D) [15]. Dans le noyau du tractus solitaire, l’AQP9 a été observée dans des neurones catécholaminergiques activés lors d’une hypoglycémie [3]. Cette population de neurones n’est pas connue pour être osmosensible, mais elle est plutôt impliquée dans les mécanismes de régulation de l’équilibre énergétique [
17]. Le glycérol et les monocarboxylates sont des substrats énergétiques utilisés par les cellules du SNC [
18,
19] et stimulent les neurones gluco-sensibles au même titre que le glucose [
20]. La présence de l’AQP9 sur l’endothélium, les astrocytes et certains neurones suggère que ce pore facilite la diffusion des substrats comme le glycérol et le lactate dans le SNC en fonction du gradient de concentration (Figure 3D). De plus, l’expression de l’AQP9 est sensible à l’insuline [3]. Ces résultats récents suggèrent que l’AQP9 peut jouer un rôle important dans le métabolisme énergétique cérébral. |
Mécanismes de régulation des aquaporines dans le système nerveux central Les premières études sur la régulation des AQP ont été réalisées sur l’AQP2 du rein qui est sensible à la vasopressine [2]. La régulation de l’activité des AQP peut se faire sur trois niveaux : synthèse de la protéine, translocation de celle-ci à la membrane ou modification des charges ioniques au niveau du pore, ce qui a pour conséquence l’augmentation ou la diminution de la perméabilité de l’aquaporine. La régulation de l’AQP1 a été étudiée dans différents modèles comme l’ovocyte et le rein, mais les mécanismes de régulation de cette protéine n’ont pas été encore étudiés dans le cerveau. Dans ces modèles, le niveau d’expression de l’AQP1 augmente lorsque la voie de phosphorylation de la protéine kinase A (PKA) est activée via la forskoline ou la vasopressine (par l’intermédiaire du récepteur V2) ou l’AMPc [
21]. Il est aussi intéressant de noter que la stimulation de cette voie de signalisation augmente également le niveau d’expression de l’AQP9 dans des astrocytes en culture [3]. Par ailleurs, un choc hyperosmotique sur des cultures d’astrocytes stimule la voie de la p38 MAP-(mitogen-associated protein-kinase) kinase et induit une augmentation de l’expression des AQP4 et AQP9 [21]. L’augmentation du nombre de canaux a pour conséquence une augmentation de la perméabilité à l’eau de la cellule. Le niveau d’expression de l’AQP4 peut être aussi régulé positivement par la vasopressine via les récepteurs V1A [21]. Inversement, la stimulation de la voie de la caséine kinase II (CKII) va permettre la phosphorylation de l’AQP4 et l’internalisation des canaux, diminuant leur nombre à la surface des cellules [
22]. Ainsi, la perméabilité à l’eau des cellules va être diminuée. De même, la perméabilité à l’eau de l’AQP4 est diminuée par l’application de la dopamine ou par stimulation de la voie de phosphorylation de la protéine kinase C (PKC) [21]. La perméabilité du canal est aussi modulée directement par les changements de charges qui sont induits par les variations de pH. La sensibilité au pH de certaines AQP est conférée par des histidines dans les boucles externes A ou C (Figure 1A) [
23]. En particulier, l’histidine en position 129 de la boucle C confère à l’AQP4 la sensibilité au pH. La perméabilité à l’eau est augmentée d’un facteur 1,9 quand le pH devient alcalin (Figure 1A) [23]. Pendant une activité neuronale, le pH intracellulaire des astrocytes présente une alcalinisation transitoire [
24], ce qui aurait pour conséquence d’augmenter la perméabilité à l’eau du canal AQP4. Le flux d’eau ainsi produit accompagnerait la recapture du potassium extracellulaire par les astrocytes [21]. L’AQP9 présente aussi de nombreux sites de phosphorylation pour la PKC et la CKII dans le segment intracellulaire aminoterminal [3]. Le taux d’AQP9 dans des astrocytes en culture diminue lorsque la voie de la PKC est activée [21]. En outre, l’AQP9 est négativement régulée lors de l’application d’insuline sur des cultures d’hépatocytes via la stimulation d’un élément de réponse sensible à l’insuline (IRE) situé dans le promoteur du gène aqp9 [
25]. In
vivo, la diminution de la concentration plasmatique de l’insuline provoque une augmentation de l’expression de l’AQP9 dans le foie [
26]. Les variations de concentration de l’insuline peuvent également modifier le niveau d’expression d’AQP9 dans le cerveau [3]. |
Expression et rôles pathophysiologiques des AQP L’expression des AQP est modifiée dans de nombreuses maladies et semble avoir un rôle important dans la formation de l’œdème. L’AQP1 n’est pas exprimée dans les astrocytes en condition physiologique [
27]. Cette AQP est fortement induite dans les astrocytes des tissus cérébraux humains après une hémorragie sous-arachnoïdienne ou dans les astrocytes réactionnels péri-tumoraux [27]. Par ailleurs, l’expression d’AQP1 est également fortement augmentée dans tous les glioblastomes humains et semble jouer un rôle dans la formation de l’œdème associé à des tumeurs cérébrales [27]. En revanche, une telle induction de l’AQP1 dans les astrocytes n’a jamais été décrite dans le cerveau des rongeurs. L’AQP1 intervient dans la formation du LCR, mais actuellement aucune étude n’a montré son implication dans la formation de l’œdème lors d’une hydrocéphalie. Chez les rongeurs, l’expression d’AQP4 varie à la suite d’une lésion cérébrale ischémique ou traumatique [27]. Chez des patients, une augmentation du taux d’AQP4 a été observée dans les astrocytes proches des capillaires après une lésion hémorragique et dans les tumeurs cérébrales [27]. Les différentes études chez les rongeurs montrent que l’AQP4 joue un rôle important dans la formation de l’œdème [4]. Le niveau d’expression de l’AQP4 diminue dans les premiers temps après la lésion ischémique ou traumatique et augmente ensuite [
28]. Les souris AQP4−/−
[
29] ou les souris α-Syn−/−
[13] présentent une diminution de la formation de l’œdème après une ischémie cérébrale ou une intoxication à l’eau, suggérant un rôle important de l’AQP4 dans le développement de l’œdème cytotoxique en facilitant les mouvements d’eau. Mais des études récentes sur les souris AQP4−/−
montrent que l’absence d’AQP4 favorise aussi le développement de l’œdème vasogénique [
30]. Ces résultats suggèrent que l’AQP4 contribue aux processus œdémateux, mais le rôle positif ou négatif de l’AQP4 dans la formation de l’œdème cérébral n’est pas encore clairement élucidé. L’expression d’AQP9 est également induite dans les astrocytes 48 heures après une ischémie [16]. Cette induction de l’AQP9 dans les astrocytes suggère sa participation à la formation de l’œdème en facilitant les mouvements d’eau. Mais elle peut aussi faciliter la diffusion de l’excès de lactate ou de glycérol extracellulaire vers l’astrocyte. Ce dernier pourrait utiliser ces substrats énergétiques en permettant ainsi à la mitochondrie d’ajuster son taux de métabolites et de préserver ses fonctions respiratoires même en cas de déficience en glucose [
31]. Actuellement, le rôle exact de cette AQP après une ischémie reste encore à déterminer. |
Depuis 1994 et la première publication montrant l’expression d’AQP4 dans le cerveau, le nombre croissant de travaux concernant cette AQP a permis d’avancer partiellement dans la compréhension des mécanismes moléculaires permettant au cerveau de contrôler son volume. La formation de l’œdème n’est plus à considérer comme un phénomène passif n’impliquant que des mouvements d’eau, mais comme une succession de mécanismes moléculaires agissant sur les AQP. Une meilleure compréhension des voies de régulation des AQP est nécessaire pour le développement de nouvelles thérapies qui permettraient de faire face à la formation des œdèmes cérébraux. Enfin, les travaux sur les AQP, notamment l’AQP9, suggèrent que ces canaux ne sont pas uniquement impliqués dans les mouvements d’eau, mais pourraient participer au métabolisme énergétique cérébral et périphérique. |
Les auteurs remercient le Dr JF Brunet (Groupe de Recherche Neurochirurgicale, Lausanne, Suisse) pour les commentaires sur le manuscrit et le Dr M. Amiry-Moghadam (Centre for Molecular Biology and Neuroscience, Université d’Oslo, Norvège) pour l’image en microscopie électronique du marquage immunocytochimique de l’AQP4 et pour les nombreuses discussions. Ce travail a été financé par les fonds de la « Fondazione Per Lo Studio Delle Malattie Neurodegenerative Delle Persone Adulte e Dell’ Anziano » de Lugano, Suisse, le Fond National de la Recherche Suisse (FN 3100A0-108001/1), la fondation Leenhardt, et par une donation de REM.
|
1. Preston GM, Carroll TP, Guggino WB, Agre P. Appearance of water channels in Xenopus oocytes expressing red cell CHIP28 protein. Science 1992; 256 : 385–7. 2. Agre P, King LS, Yasui M, et al. Aquaporin water channels: from atomic structure to clinical medicine. J Physiol (Lond) 2002; 542 : 3–16. 3. Badaut J, Regli L. Distribution and possible roles of aquaporin 9 in the brain. Neuroscience 2004; 129 : 969–79. 4. Badaut J, Lasbennes F, Magistretti PJ, Regli L. Aquaporins in brain : distribution, physiology, and pathophysiology. J Cereb Blood Flow Metab 2002; 22 : 367–78. 5. Li J, Verkman AS. Impaired hearing in mice lacking aquaporin-4 water channels. J Biol Chem 2001; 276 : 31233–7. 6. Oshio K, Watanabe H, Song Y, et al. Reduced cerebrospinal fluid production and intracranial pressure in mice lacking choroid plexus water channel Aquaporin-1. FASEB J 2005; 19 : 76–8. 7. Jung JS, Bhat RV, Preston GM, et al. Molecular characterization of an aquaporin cDNA from brain: candidate osmoreceptor and regulator of water balance. Proc Natl Acad Sci USA 1994; 91 : 13052–6. 8. Badaut J, Verbavatz JM, Freund-Mercier MJ, Lasbennes F. Presence of aquaporin-4 and muscarinic receptors in astrocytes and ependymal cells in rat brain : a clue to a common function ? Neurosci Lett 2000; 292 : 75–8. 9. Nielsen S, Nagelhus EA, Amiry-Moghaddam M, et al. Specialized membrane domains for water transport in glial cells : high-resolution immunogold cytochemistry of aquaporin-4 in rat brain. J Neurosci 1997; 17 : 171–80. 10. Badaut J, Nehlig A, Verbavatz J, et al. Hypervascularization in the magnocellular nuclei of the rat hypothalamus : relationship with the distribution of aquaporin-4 and markers of energy metabolism. J Neuroendocrinol 2000; 12 : 960–9. 11. Nicchia GP, Nico B, Camassa LMA, et al. The role of aquaporin-4 in the blood-brain barrier development and integrity : studies in animal and cell culture models. Neuroscience 2004; 129 : 935–44. 12. Rash JE, Davidson KGV, Yasumura T, Furman CS. Freeze-fracture and immunogold analysis of aquaporin-4 (AQP4) square arrays, with models of AQP4 lattice assembly. Neuroscience 2004; 129 : 915–34. 13. Amiry-Moghaddam M, Frydenlund DS, Ottersen OP. Anchoring of aquaporin-4 in brain : molecular mechanisms and implications for the physiology and pathophysiology of water transport. Neuroscience 2004; 129 : 997–1008. 14. Niermann H, Amiry-Moghaddam M, Holthoff K, et al. A novel role of vasopressin in the brain : modulation of activity-dependent water flux in the neocortex. J Neurosci 2001; 21 : 3045–51. 15. Badaut J, Petit JM, Brunet JF, et al. Distribution of Aquaporin 9 in the adult rat brain : preferential expression in catecholaminergic neurons and in glial cells. Neuroscience 2004; 128 : 27–38. 16. Badaut J, Hirt L, Granziera C, et al. Astrocyte-specific expression of aquaporin-9 in mouse brain is increased after transient focal cerebral ischemia. J Cereb Blood Flow Metab 2001; 21 : 477–82. 17. Penicaud L, Leloup C, Lorsignol A, et al. Brain glucose sensing mechanism and glucose homeostasis. Curr Opin Clin Nutr Metab Care 2002; 5 : 539–43. 18. Magistretti PJ, Pellerin L, Rothman DL, Shulman RG. Energy on demand. Science 1999; 283 : 496–7. 19. Nguyen NH, Brathe A, Hassel B. Neuronal uptake and metabolism of glycerol and the neuronal expression of mitochondrial glycerol-3-phosphate dehydrogenase. J Neurochem 2003; 85 : 831–42. 20. Yang XJ, Kow LM, Funabashi T, Mobbs CV. Hypothalamic glucose sensor : similarities to and differences from pancreatic beta-cell mechanisms. Diabetes 1999 48 : 1763–72. 21. Gunnarson E, Zelenina M, Aperia A. Regulation of brain aquaporins. Neuroscience 2004; 129 : 945–53. 22. Madrid R, Le Maout S, Barrault MB, et al. Polarized trafficking and surface expression of the AQP4 water channel are coordinated by serial and regulated interactions with different clathrin-adaptor complexes. EMBO J 2001; 20 : 7008–21. 23. Nemeth-Cahalan KL, Kalman K, Hall JE. Molecular basis of pH and Ca2+ regulation of aquaporin water permeability. J Gen Physiol 2004; 123 : 573–80. 24. Chesler M. Regulation and modulation of pH in the brain. Physiol Rev 2003; 83 : 1183–1221. 25. Kuriyama H, Shimomura I, Kishida K, et al. Coordinated regulation of fat-specific and liver-specific glycerol channels, aquaporin adipose and aquaporin 9. Diabetes 2002; 51 : 2915–21. 26. Carbrey JM, Gorelick-Feldman DA, Kozono D, et al. Aquaglyceroporin AQP9 : solute permeation and metabolic control of expression in liver. Proc Natl Acad Sci USA 2003; 100 : 2945–50. 27. Badaut J, Brunet JF, Grollimund L, et al. Aquaporin 1 and 4 expression after human acute subarachnoid hemorrhage. Acta Neurochir 2003; 86 (suppl) : 495–8. 28. Unterberg AW, Stover J, Kress B, Kiening KL. Edema and brain trauma. Neuroscience 2004; 129 : 1019–27. 29. Manley GT, Fujimura M, Ma T, et al. Aquaporin-4 deletion in mice reduces brain edema after acute water intoxication and ischemic stroke. Nat Med 2000; 6 : 159–63. 30. Manley GT, Binder DK, Papadopoulos MC, Verkman AS. New insights into water transport and edema in the central nervous system from phenotype analysis of aquaporin-4 null mice. Neuroscience 2004; 129 : 981–9. 31. Dugan LL, Kim-Han JS. Astrocyte mitochondria in vitro models of ischemia. J Bioenerg
Biomembr 2004; 36 : 317–21. 32. Lindland H, Roberg B, Torgner I, et al.
Aqp9-the first mitochondrial water channel. Washington DC : Society for Neuroscience, 2004 : 197.13 (abstract). 33. Amiry-Moghaddam M, Ottersen OP. The molecular basis of water transport in the brain. Nat Rev Neursci 2003; 4 : 991–1001. |