| |
| Med Sci (Paris). 2005 August; 21(8-9): 773–779. Published online 2005 August 15. doi: 10.1051/medsci/2005218-9773.Enrichissement de l’alimentation des animaux avec les acides gras ω-3 : Impact sur la valeur nutritionnelle de leurs produits pour l’homme Jean-Marie Bourre* Inserm U.705, CNRS UMR 7157, 200, rue du Faubourg Saint-Denis, 75745 Paris Cedex 10, France |
Comme cela a été rappelé dans une revue récente de médecine/sciences [
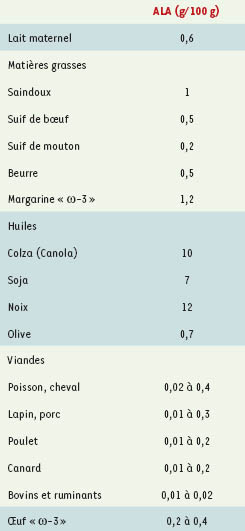
1], les acides gras oméga-3 constituent une famille dont le premier élément est l’acide α-linolénique (ALA, 18:3[n-3], 18 : 3ω3, 18:3 oméga-3). Les autres membres sont constitués de chaînes carbonées plus longues et plus insaturées dérivées de l’ALA, les principaux étant l’EPA (acide eicosapentaénoïque, dit timnodonique) : 20 : 5ω3, 20:5 oméga-3, 20:5(n-3), et le DHA (acide docosahéxanoïque, dit cervonique) : 22 : 6ω3, 22:6 oméga-3, 22:6(n-3). Très schématiquement, l’ALA est principalement présent dans le monde végétal (huiles de colza, de noix) et dans les œufs naturels, pastoraux, dits « ω-3 », l’EPA et le DHA dans le monde animal (en faibles quantités chez les mammifères et les oiseaux, en fortes quantités chez les produits de la pêche et de l’aquaculture, pour autant qu’ils soient gras). Les teneurs en ALA des principaux aliments courants sont données dans le Tableau I, celles d’EPA et de DHA dans le Tableau II. Le DHA est l’acide gras ω-3 majoritairement impliqué dans les compositions des membranes biologiques ; il peut être obtenu soit par transformation hépatique de l’ALA (mais le rendement semble insuffisant, tout au moins à certains âges de la vie et dans bon nombre de situations physiopathologiques), soit directement dans les produits aquatiques, notamment les poissons gras, et dans les œufs pastoraux.  | Tableau I.
Sources d’ALA pour l’homme (d’après [
28]). En France, contrairement à d’autres pays, l’huile de lin, pourtant riche en ALA (54 g/100 g), est interdite à la consommation humaine, pure ou en combinaison avec d’autres huiles. Les huiles de pépins de groseilles et de cassis sont très riches en ALA (25 g/100 g et 12 g/100 g, respectivement), mais sont peu utilisées. Les viandes de polygastriques (bovins, ovins ou caprins) et leurs dérivés ne sont pas détaillés, car leurs contenus en ALA sont très faibles. L’œuf « ω-3 » est commercialisé sous les noms de Benefic ® et Columbus ®. En revanche, l’œuf standard ne contient que 0,015 g/100 g d’ALA aux ωtats-Unis, et 0,05 g/100 g en France (type Glon ®). |
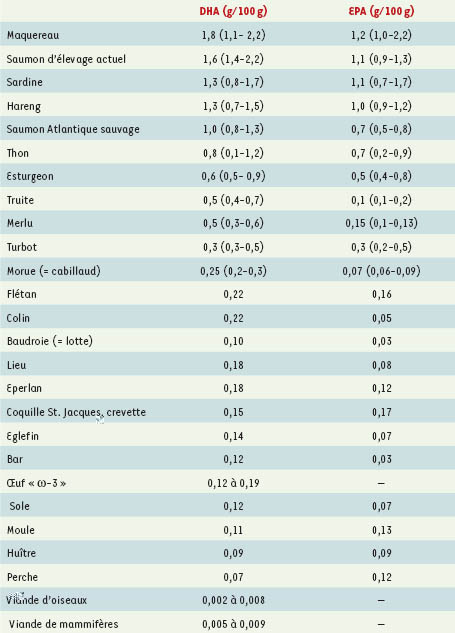
 | Tableau II.
Sources d’EPA et de DHA pour l’homme (d’après [ 28,
29]). Ces valeurs constituent les moyennes pondérées des résultats obtenus par divers auteurs : les écarts sont en effet très importants, selon les teneurs en lipides, les lieux de pêches, les saisons, la température de l’eau, le sexe, le poids, les parties anatomiques… De ce fait, les écarts ont été précisés dans ce tableau pour les poissons les plus gras. Selon qu’il s’agit de thon albacore, germon, listao ou rouge, les teneurs en lipides sont très différentes, et par conséquent aussi celles en acides gras ω-3. Les saumons d’élevage actuels, comme probablement les autres poissons d’élevage, sont fréquemment nourris avec des huiles de poisson, expliquant leur richesse en acides gras oméga-3, mais cette qualité pourrait ne pas perdurer ( voir texte). Les viandes d’oiseaux et de mammifères, monogastriques ou polygastriques (bovins, ovins ou caprins), et leurs dérivés (lait, fromages, beurre, produits laitiers) ne sont pas détaillés, car leurs contenus en EPA et DHA sont très faibles, exceptés pour certains produits tripiers, qui ne sont plus consommés en quantités utiles (foie), voire interdits à la consommation (cervelle de certaines espèces). L’œuf « ω-3 » est commercialisé sous les noms de Benefic ® et Columbus ®. En revanche, l’œuf standard ne contient que 0,033 g/100 g de DHA aux ωtats-Unis, et 0,04 g/100 g en France (type Glon ®). |
Sur le plan de la santé, les ω-3 sont mis en exergue dans le cadre de la prévention et du traitement des maladies cardiovasculaires, notamment ischémiques obstructives. Ils sont aussi impliqués dans l’élaboration des structures du cerveau et de ses fonctions cognitives [
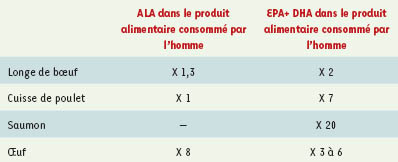
2]. D’autres domaines font l’objet de recherches, notamment l’inflammation, certaines pathologies rhumatologiques ou dermatologiques (le psoriasis), les cancers et, récemment, la psychiatrie [1]. L’objectif de cette revue est d’évaluer la pertinence de l’objectif d’amélioration du contenu en ω-3 de produits d’origine animale en nourrissant les animaux avec des lipides adaptés. Les possibilités d’enrichissement sont présentés dans les Tableaux III et IV.  | Tableau III.
Facteurs de multiplication les plus favorables obtenus en nourrissant les animaux avec de l’ALA (graines de lin ou de colza) (d’après [ 28]). En ce qui concerne les œufs, les teneurs en acides gras oméga-3 sont voisines quand ils sont enrichis naturellement de manière optimale, ce qui permet de rapprocher, voire dépasser, les teneurs des œufs pastoraux « sauvages », c’est-à-dire crétois. En revanche, en ce qui concerne les œufs « industriels » actuels, les teneurs varient selon les aliments donnés aux poules pondeuses, et selon les pays. De ce fait, pour atteindre le même niveau, certains œufs sont enrichis 40 fois, alors que d’autres ne le sont que 20 fois. |
 | Tableau IV.
Facteurs de multiplication les plus favorables obtenus en nourrissant les animaux avec des huiles de poisson (EPA + DHA) (d’après [ 28]). |
L’évaluation de cet enrichissement en ω-3 est justifiée par le fait que les apports nutritionnels de l’alimentation humaine sont insuffisants en ALA. En effet, une étude réalisée en Aquitaine [
3] a montré que les femmes n’absorbent dans leur alimentation qu’environ 40 % de la dose journalière d’ALA indiquée dans les apports nutritionnels conseillés (ANC) [
4]. Des résultats analogues ont été obtenus en Bretagne [
5], et sur tout le territoire français dans l’étude SUVIMAX [
6], ainsi que dans d’autres pays, notamment le Canada, la Suède et les États-Unis. En ce qui concerne les très longues chaînes carbonées ω-3 (EPA et DHA), des estimations de consommations [6] montrent que les adultes français (les tranches d’âge étant de 35-60 ans pour les femmes et 45-60 ans pour les hommes) consomment en moyenne environ 2 fois plus que les ANC français. Toutefois, il est très important de noter que des variations considérables sont relevées selon les individus : ainsi, sur un effectif beaucoup plus faible étudié en Bretagne, la consommation atteignait moins de la moitié des ANC [5], un résultat en accord avec ceux obtenus dans d’autres pays. |
Les lipides de réserve (lipides neutres, principalement les triglycérides), dont les quantités varient considérablement selon la situation anatomique et l’état d’engraissement de l’animal, présentent des profils en acides gras qui dépendent notablement de l’alimentation de l’animal. Les lipides de structure (principalement les phospholipides membranaires) sont globalement plus stables. Toutefois, selon les espèces animales, les mécanismes physiologiques et biochimiques de la digestion induisent des modifications (parfois considérables) des lipides absorbés [
7]. Par exemple, chez les polygastriques (bovins, ovins, caprins), les bactéries du rumen hydrogènent les acides gras poly-insaturés des végétaux, les transformant notamment en acides gras saturés, leur faisant perdre leur intérêt nutritionnel ; de ce fait, leur viande est plus de 2 fois moins riche en ces acides gras poly-insaturés que la viande des monogastriques (lapin, porc, cheval). Une étude montre ainsi que le pouvoir hydrogénant du rumen du mouton est relativement important, et atteint les acides gras mono-insaturés et poly-insaturés ; les très longues chaînes poly-insaturées sont toutefois moins hydrogénées [
8]. En d’autres termes, la viande de porc ou de lapin est incontestablement plus riche en acides gras poly-insaturés que la viande bovine. Et les tentatives d’enrichissement en acides gras poly-insaturés, en ajoutant par exemple dans l’alimentation des graines de lin (extrêmement riches en ALA), ou des produits de la mer ou leurs succédanés, sont beaucoup plus efficaces avec le porc qu’avec le bœuf ou l’agneau. En ce qui concerne le beurre, et dans une moindre mesure les fromages, la valorisation par la dénomination « beurre ω-3 » constitue un argument nutritionnellement inacceptable, alors même que l’enrichissement est non négligeable : en effet, les quantités d’acides gras ω-3 restent très faibles par rapport aux besoins de l’homme et la quantité d’acides gras saturés reste trop importante, bien que légèrement diminuée. Incidemment, des différences de contenu du beurre en ALA sont notables selon les saisons, puisqu’elles sont de 0,35 g/100 g de beurre au printemps, 0,43 g/100 g en été et 0,26 g/100 g en hiver [
9]. Outre l’incorporation de graines de lin ou de colza dans la nourriture des vaches, celle des huiles de poisson constitue un moyen intéressant pour augmenter la teneur en EPA du lait [
10] ; toutefois, l’utilisation de ces huiles modifie la lactation [
11]. Si les acides gras ω-3 sont protégés des mécanismes d’hydrogénation réalisés par les micro-organismes du rumen, par exemple à l’aide de micro-encapsulation ou par traitement chimique, ils sont alors partiellement retrouvés dans les tissus et le lait des ruminants, ce qui a été vérifié chez la chèvre. Cependant, le débat se déplace alors sur le caractère naturel de ce type d’alimentation. |
Certes, le contenu des poissons en ALA représente en général moins de 1 % des acides gras, mais les poissons gras sont très riches en EPA et en DHA. Or, selon la nature des graisses qui leurs sont données, les quantités d’acides gras ω-3 peuvent varier considérablement dans leur chair, d’un facteur 1 à 20, car l’alimentation influence de façon importante la qualité de la chair du poisson [
12]. L’objectif n’est donc pas d’enrichir les poissons en acides gras ω-3, mais de respecter les teneurs qu’ils présentent spontanément quand ils sont convenablement nourris, soit en leur fournissant en élevage des aliments similaires (au moins en composition chimique) à ceux qu’ils consomment naturellement à l’état sauvage, soit en enrichissant ceux qui leurs sont donnés avec les acides gras ω-3 pertinents. On peut soit utiliser des produits riches en ALA (par exemple graines de lin ou de colza), soit des produits riches en EPA et en DHA (huiles de poisson, extraits d’algues, de phytoplancton, de zooplancton ou de petits organismes marins tels que les crustacés, produits de cultures d’organismes marins monocellulaires). L’ALA est manifestement intéressant chez les poissons végétaliens comme la carpe, qui possèdent les équipements enzymatiques assurant la transformation de l’ALA en EPA et DHA. En revanche, l’ALA est peu efficace chez les poissons carnivores, dont les activités enzymatiques sont réduites : il convient donc de les nourrir avec les mélange EPA + DHA (au rang des animaux terrestres, il en est de même pour les félidés). La quantité de DHA dans leur chair est alors directement fonction de sa concentration dans l’alimentation, notamment pour les truites [
13] et les saumons [
14,
15]. D’une manière générale, les poissons d’élevage présentent un rapport oméga-3/oméga-6 moins bon que celui trouvé chez les poissons sauvages [
16], mais cette observation est sans conséquence puisque les contenus en acides ω-3 sont toujours très largement supérieurs à ceux des ω-6. Pour des raisons de production de farines animales (des protéines), les huiles de poisson sont actuellement utilisées en alimentation animale, car relativement peu onéreuses ; dans un futur proche (comme dans un passé récent), notamment du fait de l’augmentation prévisible de la demande, de l’épuisement des réserves marines du fait de la surexploitation des mers et, enfin, de la contamination de certaines de ces huiles de poisson par les dioxines, les PCB ou le mercure, les huiles et graisses végétales pourraient à nouveau être utilisées, en particulier l’huile de palme et de coprah, ce qui est à éviter dans la perspective de l’alimentation humaine. La question pratique pour les éleveurs est donc de déterminer la durée d’une alimentation riche en ω-3 à donner aux poissons avant leur abattage, afin que leur chair présente une composition en acides gras ω-3 proche de celle du poisson sauvage. |
La physiologie digestive des oiseaux préserve relativement bien les acides gras poly-insaturés qu’ils consomment. Un effet dose est observé dans les tissus de l’animal, notamment pour les teneurs en ALA, qui peuvent passer d’environ 4 g/100 g à 22 g/100 g d’acides gras. Cet effet est moins net avec le DHA, d’autant que de fortes teneurs alimentaires en graines de lin diminuent légèrement cet acide, tandis que l’ALA est augmenté. La volaille est donc considérée, dans une étude américaine, comme un excellent moyen de modifier favorablement le statut nutritionnel en ω-3 [
17]. |
Contrairement au dogme qui a longtemps prévalu, la composition de l’œuf n’est pas constante, mais varie en fonction de la nourriture fournie aux poules pondeuses : la nature des acides gras du jaune d’œuf est ainsi en relation avec la nature des graisses mangées par la poule. Dans les œufs dits « industriels », par rapport aux œufs grecs pastoraux « sauvages », la quantité d’ALA est multipliée par 14 (et par 42 si les poules sont nourries avec des graines de lin), celle de DHA par 6 (par 5 si les poules sont nourries avec des graines de lin) [
18]. Une explication en est la consommation par les poules grecques de divers végétaux, dont particulièrement le pourpier (variété de salade), d’escargots et de limaces. L’enrichissement est proportionnel à la quantité d’acides gras ω-3 présents dans l’alimentation de la poule. Il est logiquement plus important avec des graines de lin qu’avec des graines de colza [
19]. La relation est d’ailleurs linéaire entre le contenu en ALA dans les aliments et sa teneur dans le jaune d’œuf [
20]. Par exemple, une alimentation destinée aux poules pondeuses [
21] contenant 0 %, 10 % ou 20 % d’huile de graine de lin provoque une augmentation croissante du contenu des œufs en ALA (de 28, 261 et 527 mg par œuf, respectivement) et en DHA (51, 81 et 87 mg par œuf), tout en ne modifiant pas leur teneur en cholestérol. Les effets des ω-3 contenus dans les œufs ont été évalués à travers des études de paramètres physiologiques, notamment lipidiques sériques, chez l’animal et l’homme. Une étude [21] conclut, pour répondre aux prescriptions gouvernementales (canadiennes, en l’occurrence) et promouvoir l’augmentation de la consommation d’acides gras ω-3, que les œufs constituent un aliment très intéressant. Trois œufs « oméga-3 » apportent approximativement autant d’acides gras oméga-3 qu’une portion de poisson [
22]. Actuellement, des œufs multi-enrichis de manière naturelle sont mis sur le marché dans certains pays (Benefic® en Europe, Columbus® dans le monde) : cet enrichissement concerne notamment le contenu en acides gras ω-3, en vitamines D et E, en minéraux (iode, sélénium) et en caroténoïdes (lutéine et zéaxanthine). En alimentation infantile, des extraits de jaune d’œufs, le plus souvent des lécithines (issues de poules nourries avec des aliments judicieusement choisis), ont été ajoutés par quelques marques de laits adaptés aux nourrissons : de ce fait, ces laits présentaient l’avantage de fournir les mêmes quantités d’acides gras à très longues chaînes – notamment les acides gras ω-3 – que le lait de femme. Le contenu en acides gras du plasma sanguin et des globules rouges est alors identique chez les enfants nourris au sein et chez ceux recevant un lait adapté contenant des extraits de jaune d’œuf enrichi en acides gras ω-3 [
23]. Parallèlement, le lait de femmes consommant des œufs enrichis en acides gras ω-3 contient lui aussi de plus grandes quantités de ces acides gras [
24]. |
Conclusions et perspectives La modification de la composition des formulations destinées aux animaux induit des effets mesurables sur l’homme qui les consomme. La reconstitution d’une alimentation humaine utilisant des produits d’animaux nourris avec des graines de lin a ainsi été réalisée [5], doublant l’apport alimentaire d’ALA (passant de 0,75 g/j à 1,65 g/j) et permettant d’approcher les ANC, le total des ω-3 passant de 0,86 g/j à 1,91 g/j. Le rapport linoléique (acide gras oméga-6)/ALA est divisé par 2 (passant de 14,9 à 6,8), environ, atteignant presque les recommandations (le chiffre est de 5). Les effets sur les lipides sanguins des consommateurs sont mesurables, avec un doublement de la teneur de l’ALA dans le sérum (de 0,44 à 0,93), le rapport ω-6 totaux/ω-3 totaux passant de 14,3 à 10,2. Les modifications organoleptiques et technologiques d’une l’alimentation dont le contenu en acides gras a été modifié sont toutefois à prendre en compte [
25]. L’objet de cet article était d’évaluer la contribution réelle, à la couverture des besoins en acides gras ω-3 de l’homme, de la consommation de produits animaux dont le contenu en acides gras ω-3 est modifié par l’utilisation d’aliments, destinés aux animaux, riches eux-mêmes en ω-3. Les aliments enrichis par addition finale d’acides gras ω-3, par exemple le lait enrichi en huile de poisson micro-encapsulée, le pain enrichi en ω-3 par le même procédé ou avec des graines de lin, n’ont, à dessein, pas été inclus dans cette analyse. De même, les études d’animaux transgéniques exprimant les désaturases et élongases produits de la pêche et de l’aquaculture leur permettant de contenir des quantités beaucoup plus grandes d’acides gras ω-3 ne constituent actuellement qu’une voie d’exploration, et sort du cadre de cette revue : rentrent dans cette catégorie le porc exprimant une désaturase de l’épinard [
26] ou la souris exprimant une protéine de Caenorhabditis elegans, fat-1, capable de transformer l’acide linoléique, ω-6, en ALA [
27]. Dans cet esprit, il est par ailleurs proposé de créer des végétaux transgéniques produisant l’ALA, l’EPA et le DHA, permettant de court-circuiter la filière poisson (avec le mauvais prétexte qu’elle peut être polluée), ce qui semble inacceptable sur le plan de la nutrition humaine, ne serait-ce que parce que les poissons bénéficient de multiples points de valorisation nutritionnelle, dont certains leur sont spécifiques : outre les acides gras ω-3, des protéines de qualité, des vitamines D et B12, des minéraux comme l’iode et le sélénium… En pratique alimentaire [28], il est aisé de pallier le déficit en ALA avec les huiles de colza ou de noix (celle de soja est trop riche en acides gras ω-6), ainsi qu’avec des variétés d’œufs « ω-3 » (dénommées Columbus® ou Benefic®, à l’exclusion de toute autre qualité d’œuf, y compris « label » ou « bio ») et les noix ; les combinaisons d’huiles dont l’assemblage contient plus de 50 % d’huile de colza sont très intéressantes, comme Isio-protect®, sachant que les ANC pour l’ALA sont de 2 g pour les hommes, 1,6 g pour les femmes (2 g quand elles sont enceintes et 2,2 g quand elles allaitent) et de 1,5 g pour les personnes âgées. Si toutes les études réalisées dans les pays industrialisés montrent que la consommation d’ALA est largement insuffisante, les apports en DHA semblent divers selon les études et les pays, alors que les recommandations en France [4] sont de 120 mg/j pour les hommes, 100 mg/j pour les femmes (250 mg/j quand elles sont enceintes ou qu’elles allaitent) et de 100 mg/j chez les personnes âgées. Le déficit chez les femmes enceintes, particulièrement préoccupant [3,
30,
31], pourrait être résorbé par la consommation de poissons gras sauvages, généralement très riches en EPA et DHA, mais aussi de poissons d’élevage dont la nourriture aura été satisfaisante, d’autant que les élevages assurent une composition constante, tandis que les variations au sein d’une même espèce de poisson peuvent être très importantes selon les lieux et les saisons [
32]. La valeur nutritionnelle des poissons en termes de lipides, déterminée par la quantité d’acides gras ω-3, peut varier considérablement selon la nature des graisses qui les ont alimentés. L’objectif de prévention de certains aspects des maladies cardiovasculaires peut ainsi être atteint, ou au contraire contrarié, selon la nature des acides gras présents dans la chair de poisson (et dans les œufs), conséquence directe de la nature des graisses avec lesquelles ils ont été nourris. Il en est de même pour d’autres maladies, comme certains cancers, notamment du sein et du côlon [
33], de la prostate [
34,
35], quelques pathologies à composante inflammatoire [
36] et peut-être même le diabète de type 2 [
37]. En ce qui concerne les « œufs ω-3 », le surcoût de l’alimentation animale est d’environ 5 %, soit 2 % à la production, ce qui devrait se traduire à moyen terme (quand les filières dédiées seront en place) par une augmentation du prix de quelques % pour le consommateur. Les différences sont probablement du même ordre de grandeur pour les poissons. Il importe donc que les cahiers des charges, ceux de la distribution et de la restauration collective notamment, ne se contentent plus d’exiger des teneurs minimales en toxiques, mais définissent aussi la valeur nutritionnelle réelle des aliments, qui doivent prioritairement nourrir sans intoxiquer. En conclusion, on peut dire que l’apport d’acides gras ω-3 dans l’alimentation des animaux induit des résultats considérables pour les poissons et les œufs, importants pour la volaille, intéressants pour le porc et très modestes pour les bovins et les ovins, tout au moins par rapport à la couverture des besoins nutritionnels [28]. |
1. Bourre JM. Acides gras oméga-3 et troubles psychiatriques. Med Sci (Paris) 2005; 21 : 216–21. 2. Bourre JM. Effets des nutriments (des aliments) sur les structures et les fonctions du cerveau : le point sur la diététique du cerveau. Rev Neurol 2004; 160 : 767–92. 3. Combe N, Boué C. Apports alimentaires en acides linoléique et alpha-linolénique d’une population d’Aquitaine. OCL 2001; 8 : 118–21. 4. Legrand P, Bourre JM, Descomps B, et al. Lipides. In : Martin A, ed. Apports nutritionnels conseillés pour la population française. Paris : Tec et Doc Lavoisier, 2000 : 63–82. 5. Weill P, Schmitt B, Chesneau G, et al. Effects of introducing linseed in livestock diet on blood fatty acid composition of consumers of animal products. Ann Nutr Metab 2002; 46 : 182–91. 6. Astorg P, Arnault N, Czernichow S, et al. Dietary intakes and food sources of n-6 and n-3 PUFA in French adult men and women. Lipids 2004; 39 : 527–35. 7. Mourot J, Hermier D. Lipids in monogastric animal meat. Reprod Nutr Dev 2001; 41 : 109–18. 8. Ashes J, Siebert B, Gulati S, et al. Incorporation of n-3 fatty acids of fish oil into tissue and serum lipid of ruminants. Lipids 1992; 27 : 629–31. 9. Ledoux M, Chardigny JM, Darbois M, et al. Variations saisonnières et régionales des taux d’acides linoléiques conjugués dans les beurres français. Sci Des Alim 2003; 23 : 443–62. 10. Keady TW, Mayne CS, Fitzpatrick DA. Effects of supplementation of dairy cattle with fish oil on silage intake, milk yield and milk composition. J Dairy Res 2000; 67 : 137–53. 11. Chilliard Y, Ferlay A, Rouel J, Lamberet GA. Review of nutritional and physiological factors affecting goat milk lipid synthesis and lipolysis. J Dairy Sci 2003; 86 : 1751–70. 12. Medale F, Lefevre F, Corraze G. Qualité nutritionnelle et diététique des poissons : constituants de la chair et facteurs de variation. Cah Nutr Diet 2003; 1 : 37–44. 13. Boggio S, Hardy R, Babbitt J, Brannon E. The influence of dietary lipid source and alpha-tocopheryl acetate level of product quality of rainbow trout (Salmo gairdneri). Aquaculture 1985; 51 : 13–24. 14. Dosanjh B, Higgs D, Plotnikoff D, et al. Efficacy of canola oil, pork lard and marine oil singly or in combination as supplemental dietary lipid sources for juvenil coho salmon (Oncorhynchus kisutch). Aquaculture 1984; 36 : 333–45. 15. Bell J, Henderson R, Tocher D, Sargent J. Replacement of dietary fish oil with increasing levels of linseed oil : modification of flesh fatty acid compositions in Atlantic salmon (Salmo salar) using a fish oil finishing diet. Lipids 2004; 39 : 223–32. 16. Van Vliet T, Katan M. Lower ration of n-3 to n-6 fatty acids in cultured than in wild fish. Am J Clin Nutr 1990; 51 : 1–2. 17. Van Elswyk ME, Hatch SD, Stella GG, et al. Poultry-based alternatives for enhancing the ω 3 fatty acid content of American diets. World Rev Nutr Diet 1998; 83 : 102–15. 18. Simopoulos AP, Salem N. n-3 fatty acids in eggs from range-fed greek chickens. N Engl J Med 1989; 321 : 1412. 19. Cherian G, Sim JS. Effect of feeding full fat flax and canola seeds to laying hens on the fatty acid composition of eggs, embryos, and newly hatched chicks. Poultry Sci 1991; 70 : 917–22. 20. Anderson GJ, Connor WE, Corliss JD, Lin DS. Rapid modulation of the n-3 docosahexaenoic acid levels in the brain and retina of the newly hatched chick. J Lipid Res 1989; 30 : 433–41. 21. Ferrier LK, Caston LJ, Leeson S, et al. Alpha-linolenic acid- and docosahexaenoic acid-enriched eggs from hens fed flaxseed : influence on blood lipids and platelet phospholipid fatty acids in humans. Am J Clin Nutr 1995; 62 : 81–6. 22. Lewis NM, Schalch K, Scheideler SE. Serum lipid response to n-3 fatty acid enriched eggs in persons with hypercholesterolemia. J Am Diet Assoc 2000; 100 : 365–7. 23. Bondia-Martinez E, Lopez-Sabater MC, Castellote-Bargallo AI, et al. Fatty acid composition of plasma and erythrocytes in term infants fed human milk and formulae with and without docosahexaenoic and arachidonic acids from egg yolk lecithin. Early Hum Dev 1998; 53 : S109-S19. 24. Cherian G, Sim JS. Changes in the breast milk fatty acids and plasma lipids of nursing mothers following consumption of n-3 polyunsaturated fatty acid enriched eggs. Nutrition 1996; 12 : 8–12. 25. Mourot J, Camara M, Fevrier C. Effects of dietary fats of vegetable and animal origin on lipid synthesis in pigs. CR Acad Sci Paris III 1995; 318 : 965–70. 26. Saeki K, Matsumoto K, Kinoshita M, et al. Functional expression of a Delta12 fatty acid desaturase gene from spinach in transgenic pigs. Proc Natl Acad Sci USA 2004;101 : 6361–6. 27. Ge Y, Wang X, Chen Z, et al. Gene transfer of the Caenorhabditis elegans n-3 fatty acid desaturase inhibits neuronal apoptosis. J Neurochem 2002; 82 : 1360–6. 28. Bourre JM. La vérité sur les oméga-3. Paris : Odile Jacob, 2004. 29. Ackman RG. Nutritional composition of fats in seafoods. Prog Food Nutr Sci 1989; 13 : 161–289. 30. Denomme J, Stark KD, Holub BJ. Directly quantitated dietary (n-3) fatty acid intakes of pregnant Canadian women are lower than current dietary recommendations. J Nutr 2002; 135 : 206–11. 31. Meyer BJ, Mann NJ, Lewis JL, et al. Dietary intakes and food sources of ω-6 and ω-3 polyunsaturated fatty acids. Lipids 2003; 38 : 391–8. 32. Cahu C, Salen P, de Lorgeril M. Farmed and wild fish in the prevention of cardiovascular diseases : assessing possible differences in lipid nutritional values. Nutr Metab Cardiovasc Dis 2004; 14 : 34–41. 33. Chajes V, Bougnoux P. ω-6/ω-3 polyunsaturated fatty acid ratio and cancer. World Rev Nutr Diet 2003; 92 : 133–51. 34. Norat T, Bingham S, Ferrari P, et al. Meat, fish, and colorectal cancer risk : the European Prospective Investigation into cancer and nutrition. J Natl Cancer Inst 2005; 97: 906–16. 35. Dewailly E, Mulvad G, Sloth PH, et al. Inuit are protected against prostate cancer. Cancer Epidemiol Biomarkers Prev 2003;12: 926–7. 36. Mori TA, Beilin LJ. ω-3 fatty acids and inflammation. Curr Atheroscler Rep 2004; 6: 461–7. 37. Nettleton JA, Katz R. N-3 long-chain polyunsaturated fatty acids in type 2 diabetes : A review. J Am Diet Assoc 2005; 105 : 428–40. |