De même que la puissance d’un ordinateur dépend du nombre de ses micro-constituants, le fonctionnement d’un cerveau dépend du nombre de ses neurones, qui est notamment reflété par la taille cérébrale. Les mécanismes développementaux responsables du contrôle de la taille cérébrale incluent la régulation de la prolifération, de la différenciation, de la survie et de la migration des cellules neurales. Le nombre de gènes identifiés qui contrôlent la taille cérébrale ne cesse de croître depuis quelques années, en particulier grâce à l’analyse de modèles de souris transgéniques, ainsi que par l’identification de gènes impliqués dans des pathologies humaines caractérisées par un cerveau de taille anormale, comme les microcéphalies [ 1].
À ce cortège de gènes déterminant la taille cérébrale vient maintenant s’ajouter, de façon inattendue, une famille de facteurs de guidage axonal, les éphrines et leurs récepteurs Eph. Une étude récente a montré en effet que certaines éphrines peuvent contrôler la taille du cortex cérébral chez la souris, en régulant négativement le nombre de progéniteurs neuraux, via un mécanisme d’activation de l’apoptose [ 2]. Ce résultat est d’autant plus étonnant que l’implication des éphrines et leurs récepteurs Eph dans les cascades apoptotiques n’était pas connue : ces facteurs sont surtout bien caractérisés comme agents de guidage cellulaire et axonal, notamment au niveau du cortex cérébral [ 3, 4].
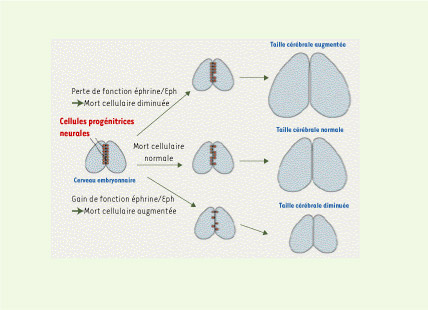
Comment en est-on arrivé à faire le lien entre éphrines, taille cérébrale et apoptose ? Afin d’étudier plus avant l’implication des éphrines dans la genèse des connexions corticales, nous avions produit des souris transgéniques présentant une expression ectopique de l’éphrine-A5 dans le cortex en développement. L’analyse de ces souris nous a révélé une surprise… de taille [2]. En effet, à la suite de l’expression ectopique du ligand éphrine-A5 par les progéniteurs corticaux, les souris présentaient une diminution sévère de la taille du cortex cérébral. L’analyse subséquente de ces souris a permis de montrer que cette microcéphalie corticale résultait d’une déplétion prématurée en cellules progénitrices du cortex, consécutive à une vague apoptotique induite par l’expression ectopique d’éphrine dans ces cellules (Figure 1). En outre, cette vague apoptotique était observée en l’absence de toute altération notable de la prolifération, de la différenciation et de la migration neurale dans le cortex, suggérant un effet directement pro-apoptotique des éphrines dans ce modèle.
| Figure 1.
Les cellules progénitrices neurales (en rouge) sont à l’origine de l’ensemble des neurones engendrés au cours du développement cérébral. Une certaine proportion de ces cellules meurt par apoptose, notamment sous l’effet de signaux éphrine/Eph. En cas de gain de fonction de la voie éphrine/Eph, la mort cellulaire des progéniteurs est augmentée, causant une déplétion des progéniteurs ; il en résulte une diminution de la taille cérébrale à la naissance. En cas de perte de fonction de la voie éphrine/Eph, la mort cellulaire des progéniteurs est diminuée, avec, pour résultat, une augmentation de la taille du cerveau. |
Afin de tester cette hypothèse, des expériences in vitro ont été réalisées, qui ont montré que l’éphrine-A5 recombinante était capable d’induire rapidement la mort de progéniteurs neuronaux dissociés, et que cette mort cellulaire impliquait l’activation de la caspase 3, confirmant ainsi l’effet direct des éphrines et de leurs récepteurs sur une ou plusieurs cascades apoptotiques [2].
Par la suite, afin d’évaluer l’importance physiologique de cette voie pro-apoptotique dépendante des éphrines, des souris présentant une invalidation du gène du récepteur EphA7 (récepteur de l’éphrine-A5 exprimé dans les progéniteurs corticaux) ont été étudiées. L’analyse de ces mutants par perte de fonction a permis de mettre en évidence un phénotype exactement inverse à celui précédemment observé dans le modèle de gain de fonction : une diminution de l’apoptose des progéniteurs corticaux, corrélée à une augmentation de la taille du cortex (Figure 1). En outre, une hypercroissance exencéphalique de tout le cerveau antérieur a pu être observée dans les cas les plus extrêmes. Ce dernier phénotype rappelle de façon frappante celui observé à la suite de l’invalidation de plusieurs gènes de cascades apoptotiques (caspases 3-9, APAF-1) [ 5]. Ces observations suggèrent donc que certaines éphrines sont nécessaires au contrôle de la taille du cortex cérébral, via une régulation des voies pro-apoptotiques des progéniteurs neuraux [2].
Si l’importance de la mort cellulaire des neurones dans le développement cérébral est bien établie depuis des décennies, la signification physiologique de l’apoptose des progéniteurs neuraux reste un domaine controversé [5]. Dans ce contexte, l’identification des éphrines comme signaux pro-apoptotiques suggère que ces facteurs pourraient être utilisés dans le contrôle spatial et temporel de la mort cellulaire des progéniteurs, comme cela a été démontré pour certains gènes HOX au cours du développement neural de la drosophile [ 6]. Par ailleurs, une étude de bio-informatique publiée récemment [ 7] a montré que des gènes de plusieurs caspases, eux-mêmes régulés par les éphrines [2], avaient subi une sélection positive au cours de l’évolution des hominidés. Ainsi, il est tentant de spéculer que des changements évolutifs du contrôle de la mort cellulaire neurale feraient partie des facteurs ayant permis l’émergence d’un cerveau de plus grande taille dans notre espèce.
Les éphrines sont loin d’être les seuls facteurs de guidage impliqués dans les mécanismes de mort cellulaire : ainsi, les nétrines et leurs récepteurs, les sémaphorines, la molécule RGM (repulsive guidance molecule) ont également été impliqués dans le contrôle de la mort cellulaire [ 8– 11]. Dans les plupart des cas, cependant, l’apoptose induite résulte de l’absence de stimulation des récepteurs par leurs ligands, selon le concept de récepteur de dépendance [ 10]. Dans le cas des éphrines, l’apoptose semble au contraire résulter d’une stimulation directe par les ligands, d’une façon analogue à la mort induite par le ligand Fas ou certaines neurotrophines [ 12]. De façon intrigante, d’autres données récentes ont impliqué des effecteurs ou régulateurs de l’apoptose (comme la caspase 3 ou lAP1) dans le contrôle du guidage axonal et cellulaire [ 13, 14], suggérant que les voies de transduction pro-apoptotiques et de guidage cellulaire pourraient être liées, peut-être à travers le contrôle du cytosquelette.
Récemment, une autre étude a mis en évidence un effet anti-prolifératif de certaines éphrines sur les cellules souches neurales chez la souris adulte, influençant ainsi la neurogenèse du bulbe olfactif [ 15]. À l’instar des neurotrophines, les éphrines semblent donc constituer des facteurs multipotentiels capables de contrôler des fonctions très différentes (guidage axonal et cellulaire, prolifération, apoptose) en fonction du contexte cellulaire. Les mécanismes sous-jacents à cette pléïotropie restent inconnus à ce jour, mais, quoi qu’il en soit, la mise en évidence des effets pro-apoptotiques et anti-prolifératifs des éphrines pourrait avoir des implications importantes dans d’autres aspects de la biologie du développement et des cellules souches, voire dans l’oncogenèse, puisque le dérèglement de certains gènes ephrin/Eph semble être associé au développement de tumeurs humaines [ 16].