Les muscles squelettiques de l’adulte sont composés de fibres post-mitotiques plurinucléées possédant des propriétés contractiles. À ces fibres musculaires sont associées des cellules souches musculaires adultes appelées cellules satellites. Ces cellules sont la plupart du temps quiescentes; elles sont reconnaissables à leur localisation entre la lame basale et le sarcolemme des fibres musculaires ainsi qu’à l’expression de marqueurs moléculaires tels que Pax7 et M-cadhérine (pour revue, voir [ 1]). Les cellules satellites sont activées à la suite d’une lésion de la fibre musculaire provoquée par une blessure, un effort intense ou au cours de myopathies entraînant la dégénérescence des fibres. Une fois activées, les cellules satellites entrent en prolifération, se différencient et fusionnent pour régénérer les fibres endommagées. Une partie des cellules en prolifération retourne toutefois à l’état quiescent, permettant ainsi le maintien du pool de cellules. Ces cellules souches ont donc un rôle crucial pour la croissance et la régénération musculaire. Cependant, leur origine embryonnaire et leur mise en place au sein des muscles étaient sujettes à controverse [1].
Des expériences anciennes, réalisées dans le groupe de Madeleine Kieny, avaient analysé l’origine embryonnaire des cellules satellites chez l’oiseau [ 2], grâce à l’utilisation de la technique de transplantation hétérospécifique de tissus d’embryons de caille dans celui de poulet (greffe caille-poule, mise au point par Nicole le Douarin [ 3]). Cette technique utilise la propriété qu’ont les cellules de caille d’être reconnaissables des cellules de poulet par leur morphologie. Cette différence permet donc d’analyser le devenir des tissus transplantés au cours du développement embryonnaire. Pour tester la capacité des somites (les somites sont des structures embryonnaires mésodermiques segmentaires situées de part et d’autre du tube neural de l’embryon) à donner naissance aux cellules satellites, Armand et al. [2] ont remplacé des somites d’embryons de poulet à 2 jours de développement par des somites de caille du même stade. Ils ont observé que de nombreuses cellules satellites présentes au sein des muscles de poulet chimère au stade fœtal présentaient des caractéristiques morphologiques de cellules de caille, démontrant ainsi qu’elles étaient issues des somites greffés.
Ces expériences laissaient toutefois plusieurs questions importantes en suspens.
Les somites sont des structures embryonnaires transitoires, se différenciant en de nombreux dérivés, dont les muscles du tronc et des membres, mais également le derme du dos, les os et le cartilage du squelette axial, ainsi que certains endothéliums, notamment celui de l’aorte dorsale (pour revue, voir [ 4]). Les expériences citées ci-dessus ne permettaient pas de déterminer si les cellules satellites dérivaient directement du lignage musculaire ou d’un autre lignage somitique.
De plus, l’origine somitique des cellules satellites n’a pu être identifiée avec certitude que pour 60 % des cellules analysées dans ces expériences. Il restait donc à déterminer si les cellules satellites représentaient une population homogène ayant une seule origine embryonnaire, ou constituaient une population hétérogène ayant plusieurs origines.
Ces questions revêtent une importance particulière au regard d’observations récentes. Il a été démontré en effet que des cellules dérivées des vaisseaux sanguins, dont l’aorte dorsale embryonnaire, sont capables de contribuer, sous certaines conditions expérimentales, à la formation des muscles chez l’adulte [ 5, 6]. D’autres études ont mis en évidence les propriétés régénératives ainsi que le potentiel myogénique de populations cellulaires, d’origine embryonnaire incertaine, présentes au sein des muscles de l’adulte. Ainsi, les cellules de la side population musculaire (muSP), définies par leur propriété d’exclusion du colorant Hœchst 33342 et isolées par la technique de tri cellulaire activée par fluorescence (FACS), ont le potentiel de donner naissance à des cellules myogéniques lorsqu’elles sont réinjectées dans un muscle lésé [ 7]. D’autres cellules résidentes du muscle, exprimant le marqueur de cellules souches Sca1 et le marqueur panhématopoïétique CD45, peuvent participer à la régénération musculaire lorsqu’elles sont activées par la signalisation Wnt [ 8]. Plus surprenant encore, des cellules non résidentes du muscle, dérivées de la moelle osseuse (dont notamment des cellules souches hématopoïétiques) peuvent être recrutées au sein d’un muscle endommagé depuis la circulation sanguine périphérique, et participer à la formation de fibres [ 9– 11]. Ces observations soulignent l’importance d’accomplir une analyse détaillée de l’origine embryonnaire des cellules satellites des vertébrés.
Pour répondre à cette question, nous avons utilisé deux techniques de lignage: (1)la première est la technique de greffe caille-poule décrite ci-dessus, associée à l’utilisation d’une batterie d’anticorps monoclonaux développés récemment, permettant de reconnaître avec certitude les cellules satellites d’origine caille; (2)la deuxième est une technique d’électroporation développée dans notre laboratoire, qui permet de cibler l’expression d’un gène rapporteur (la protéine fluorescente verte, GFP) dans une sous-population de cellules du somite de l’embryon de poulet [ 12]. L’expression de la GFP permet l’observation des cellules électroporées dans l’embryon vivant; il devient alors possible de suivre leur devenir au cours du développement embryonnaire.
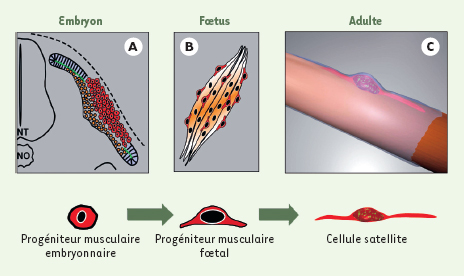
En utilisant ces techniques de lignage, nous avons examiné le devenir d’un compartiment somitique jusqu’ici peu étudié, le dermomyotome central (Figure 1A, en rouge). L’électroporation de ce compartiment avec un vecteur codant la GFP nous a permis de mettre évidence que cette population cellulaire épithéliale subit, 36 heures après la formation du somite, une transition épithélio-mésenchymateuse (EMT). Cette EMT provoque l’entrée massive des cellules du dermomyotome central dans le compartiment musculaire sous-jacent. Ces cellules présentent alors des caractéristiques typiques de progéniteurs musculaires et nous avons montré qu’elles contribuent majoritairement à la croissance des muscles embryonnaires et fœtaux (Figure 1B). Nous avons également montré que des cellules exprimant la GFP et présentant des caractéristiques de cellules satellites étaient présentes chez le fœtus. Pour quantifier la contribution de ce compartiment somitique à la population de cellules satellites chez l’adulte, nous avons alors remplacé le dermomyotome central de somites de poulet par une région équivalente de somite de caille. L’analyse de chimères avant ou après éclosion montre que, dans la région de la greffe, environ 95 % des cellules satellites sont d’origine caille. Nos observations permettent donc de répondre aux questions évoquées ci-dessus, en démontrant qu’il existe, lors du développement normal des embryons des vertébrés, une source unique de progéniteurs musculaires, le dermomyotome central, dont sont issus les progéniteurs musculaires embryonnaires et fœtaux ainsi que la quasi totalité des cellules souches musculaires de l’adulte [ 13] (Figure 1C).
| Figure 1.
Les progéniteurs musculaires embryonnaires, fœtaux et adultes, proviennent d’un seul lignage musculaire. A.
Vue transversale du tronc d’un embryon de poulet. Les cellules du dermomyotome dorsal du somite (en rouge) subissent une transition épithélio-mésenchymateuse et migrent dans le myotome primaire (en jaune) où ils prolifèrent et fusionnent aux fibres musculaires existantes, participant ainsi à la croissance des muscles de l’embryon et du fœtus. B.
Muscle fœtal composé de fibres musculaires contractiles plurinucléées (en orange) et de progéniteurs musculaires indifférenciés (en rouge). C.
Cellule satellite (en rouge) positionnée entre la lame basale (en blanc transparent) et le sarcolemme de la fibre musculaire (en orange). Les cellules progénitrices musculaires ont donc une origine unique, le dermomyotome dorsal du somite, et leur lignage est continu de l’embryon à l’adulte. |
La démonstration selon laquelle les cellules satellites et les progéniteurs musculaires embryonnaires partagent une origine commune ouvre d’importantes perspectives d’application en thérapie cellulaire. Les progéniteurs musculaires embryonnaires étant plus accessibles que les cellules souches musculaires adultes, il est envisageable de les prélever et d’étudier leur propriétés régénératives afin de les utiliser en remplacement des cellules souches adultes.