| |
| Med Sci (Paris). 2005 December; 21(12): 1070–1075. Published online 2005 December 15. doi: 10.1051/medsci/200521121070.La fusion des macrophages : partenaires des cellules Somatiques et cancéreuses ? Agnès Vignery1* and S. Gilgenkrantz2* 1Yale University School of Medicine, Department of Orthopaedics and Rehabilitation, TMP534, 310 Cedar Street, New Haven CT 06510, États-Unis 29, rue Basse, 54330 Clerey-sur-Brenon, France |
Les macrophages sont présents dans tous les tissus. Ils peuvent fusionner entre eux pour devenir des ostéoclastes multinucléés ou des cellules géantes qui jouent un rôle clé dans l’ostéoporose et les maladies inflammatoires chroniques. Pourtant, le mécanisme par lequel ils fusionnent reste encore imprécis. Le récepteur de fusion macrophagique (MFR) et son ligand CD47 confèrent aux macrophages la reconnaissance du « soi » et assurent leur fusion. Bien que le processus soit encore incertain et controversé, il semble bien que les macrophages puissent aussi fusionner avec des cellules somatiques ou tumorales, provoquant respectivement réparation tissulaire ou cancer métastatique. De ce fait, les macrophages représenteraient une arme à double tranchant.
Dérivés des monocytes, les macrophages sont des cellules à plusieurs casquettes qui contrôlent notamment l’homéostasie tissulaire et l’immunité. Quoique depuis longtemps étudiés, ils restent encore mystérieux [
1–
3]. Leur programme de différenciation comporte la capacité de fusionner entre eux pour former soit des ostéoclastes multinucléés dans les os, soit des cellules géantes contre les corps étrangers (Figure 1). En dépit du rôle clé des ostéoclastes dans l’ostéoporose, des cellules géantes dans les maladies inflammatoires chroniques et de l’importance de ces pathologies en médecine, les mécanismes moléculaires présidant à la fusion restent encore à découvrir. De plus, en dehors de cette fusion dite homotypique, un autre type de fusion du macrophage ou de son progéniteur a été décrit plus récemment dans la littérature : la fusion in vivo entre une cellule myélomonocytaire et une cellule somatique adulte telle que l’hépatocyte, la cellule musculaire squelettique, la cellule cérébelleuse de Purkinje ou le cardiomyocyte. Ainsi, la fusion cellulaire apparaîtrait-elle comme un nouveau mécanisme de réparation par lequel les macrophages ou leurs progéniteurs utiliseraient leur capacité de fusion pour participer à la régénération d’un organe. Par ailleurs, un faisceau d’évidences tend à montrer que les macrophages peuvent aussi fusionner avec des cellules tumorales pour stimuler le processus métastatique. Cette hypothèse ne date pas d’hier : elle fut exprimée dès la fin du XIXe siècle, comme le rappelle Pawelek [
4]. Bien que cette éventualité ne soit pas encore confirmée avec certitude, elle semble très probable si l’on tient compte de deux caractéristiques essentielles des macrophages : la mobilité et l’adaptation à de nouveaux microenvironnements.  | Figure 1.
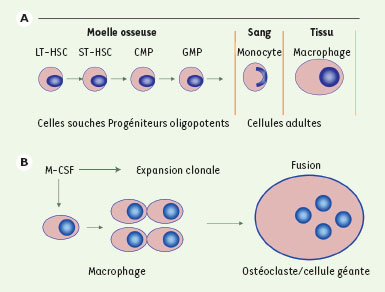
Différenciation des macrophages multinucléés : ostéoclastes et cellules géantes. A. Les macrophages tissulaires proviennent des cellules souches hématopoïétiques « à long terme » de la moelle osseuse (LT-HSC). Ces cellules s’auto-renouvellent et engendrent les cellules souches hématopoïétiques « à court terme » (ST-HSC). La différenciation se produit par l’intermédiaire des progéniteurs myéloïdes communs (CMP) qui donnent les progéniteurs des granulocytes et des macrophages (GMP). Ceux-ci quittent la moelle pour passer dans le sang sous forme de monocytes. Pour quitter la voie sanguine et entrer dans les tissus, les monocytes doivent devenir adhérents. Dès qu’ils se trouvent dans les tissus, les monocytes acquièrent le statut de macrophage. B. Pour fusionner, devenir multinucléés, et de là se différencier en ostéoclastes et en cellules géantes, les macrophages tissulaires doivent entreprendre une extension clonale en réponse à des facteurs de croissance tels que le M-CSF (macrophage-colony stimulating factor). |
Nous dresserons donc dans un premier temps l’état des lieux de nos connaissances sur la fusion homotypique, puis nous discuterons les éléments en faveur de la fusion du macrophage avec les cellules somatiques ou tumorales, en espérant que ces réflexions stimuleront les recherches sur les mécanismes moléculaires de la fusion des macrophages, essentielle à la différenciation ostéoclastique, à la formation des cellules géantes et, peut-être, à la réparation tissulaire et au développement métastatique. |
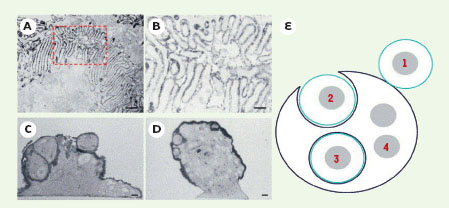
Travaux d’approche et fusion des macrophages entre eux Alors que les mécanismes utilisés par les virus pour pénétrer dans les cellules sont bien connus, on ignore encore tout de ceux – très différents – qui permettent aux macrophages de fusionner entre eux. On sait qu’initialement se développent d’abondantes interdigitations dans les membranes plasmiques adjacentes. Celles-ci peuvent favoriser la concentration de molécules de fusion dans des domaines spécifiques de la membrane plasmique (Figures 2A et 2B) [
5–
7]. En culture cellulaire, les macrophages fusionnent selon un processus d’internalisation (Figures 2C et 2D) [5, 7–
12] qui mène à un modèle que nous avons appelé cellocytose (Figure 2E). Après s’être accolés l’un à l’autre, un des deux macrophages prend les commandes et internalise l’autre, de telle sorte que la cellule internalisée soit enveloppée de deux membranes plasmiques, la sienne et celle de la cellule « maîtresse ». Ensuite, les deux membranes fusionnent et sont recyclées. Le cytoplasme et les organites cellulaires de la cellule internalisée sont intégrés dans le cytoplasme de la cellule l’ayant absorbée, tandis que l’intégrité nucléaire est préservée. Cette intégration pourrait favoriser la concentration de molécules de fusion dans des domaines spécialisés de la membrane plasmique qui doivent contenir la machinerie de fusion. Il en résulte une cellule nouvelle dont la différenciation correspond à la somme des deux cellules parentales, et qui, multinucléée, est capable de résorber des éléments volumineux, tels que l’os ou des corps étrangers. Il est donc essentiel d’améliorer nos connaissances sur les mécanismes moléculaires qui opèrent la fusion pour aboutir à la différenciation en ostéoclastes et en cellules géantes. 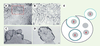 | Figure 2.
La cellocytose des macrophages. A. Aspect des interdigitations membranaires extensives s’établissant entre des macrophages fusionnant (barre : 1 µm). B. Agrandissement de la zone entourée d’un pointillé rouge en A (barre : 0,1 µm). C. Macrophages alvéolaires murins internalisés en culture, membranes intriquées, mais pas encore fusionnées (barre : 5 µm). D. Macrophages alvéolaires multinucléés contenant un grand nombre de noyaux (barre : 5 µm) (photos A à D reproduites avec l’autorisation de A. Vignery et al. [ 5]). E.La cellocytose, représentation schématique d’un modèle hypothétique. 1. Mise en contact de deux macrophages. 2. Un des deux macrophages prend le contrôle et internalise l’autre qui est alors entouré de deux membranes. 3. Les deux membranes fusionnent et peuvent être recyclées pour participer à la formation de la membrane externe du macrophage multinucléé. 4. Il en résulte une nouvelle cellule constituée par la somme des deux parents. Au fur et à mesure que la cellocytose se produit, la cellule multinucléée se développe. Le temps qui s’écoule entre la cellocytose et la fusion des membranes plasmiques permet la visualisation du processus d’internalisation, comme on peut le voir en C et en D.
|
|
Les agents présomptifs du mécanisme de la fusion des macrophages Les composants de la machinerie qui doit opérer la fusion des macrophages furent d’abord identifiés grâce à des anticorps monoclonaux reconnaissant les déterminants de surface et inhibant la fusion en culture cellulaire. La première protéine identifiée de cette manière fut appelée récepteur de fusion des macrophages (MFR) [
9,
10], identifiée simultanément en tant que SIRPα, SHPS-1, BIT, p84 ou encore MyD-1 [
13–
17]. Le choix du nom, MFR, repose sur la ressemblance structurale de la protéine avec CD4, le récepteur de surface cellulaire utilisé par la glycoprotéine gp120 du VIH (pour se lier puis fusionner avec la cellule hôte) [
18,
19]. Comme CD4, MFR est une protéine de la membrane plasmique appartenant à la superfamille des immunoglobulines (IgSF) et qui contient trois boucles Ig extracellulaires (pour revue, voir [
20,
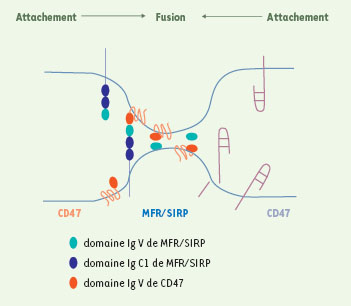
21]). Par la suite, il a été démontré que MFR pouvait se lier à CD47 [12], un autre membre des IgSF, et que les domaines extracellulaires du recombinant soluble de MFR et CD47 bloquaient la fusion [10, 12]. Tandis que l’expression de CD47 est ubiquitaire, celle de MFR est limitée aux cellules myéloïdes et aux neurones. L’expression de MFR est induite transitoirement au début de la fusion des macrophages, alors que l’expression de CD47 reste constante. CD47 contient un domaine extracellulaire Ig variable (IgV), suivi de 5 segments transmembranaires se terminant en une queue cytoplasmique. MFR contient un domaine IgV amino-terminal et deux domaines extracellulaires Ig constant (IgC1) adjacents. Une forme de MFR de poids moléculaire plus faible (MFR-s) est dépourvue des domaines C1 et contient uniquement le domaine V [12] (Figure 3). La boucle IgV de CD47 se lie au domaine IgV des deux formes de MFR, domaine reconnu par les anticorps monoclonaux évoqués ci-dessus. Il est donc possible que, durant la fusion homotypique, CD47 se lie d’abord à la forme longue de MFR, pour consolider l’attachement des macrophages, puis commute sur la forme courte pour rapprocher les membranes plasmiques l’une de l’autre. Dans la liaison de CD47 à la forme courte de MFR et le rapprochement des domaines IgV de CD47-MFR, la distance entre les membranes plasmiques des cellules adjacentes pourrait être réduite à 5-10 nm, ce qui est théoriquement suffisant pour permettre la fusion [
8, 12]. Tout comme l’expression de MFR, celle de CD44, le récepteur du hyaluronane, est induite précocement et transitoirement lors de la fusion macrophagique [
11], suggérant son rôle dans ce processus. Aucun ligand de surface n’a encore été identifié pour CD44, peut-être parce que le domaine extracellulaire de CD44 est détaché des membranes plasmiques des macrophages en train de fusionner [
22]. Si c’est le cas, cela permettrait aux membranes plasmiques des cellules en contact d’entreprendre des interactions plus étroites, ce qui faciliterait la fusion. 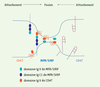 | Figure 3.
Représentation du mécanisme hypothétique de la reconnaissance de soi par les macrophages pour la fusion homotypique. L’adhérence macrophage-macrophage s’effectue par l’attachement du récepteur MFR à CD47, qui permet aux cellules de se reconnaître les unes les autres comme semblables. L’association par étape, d’abord de la forme longue de MFR, puis de la forme courte (MFR-s, pourvu d’un domaine Ig) avec CD47 diminue la distance entre les membranes plasmiques, ce qui pourrait faciliter le pliage du domaine extracellulaire de MFR [
39]. La distance entre les membranes plasmiques des macrophages pourrait se réduire à 5-10 nm si MFR et CD47 se courbaient au moment de la liaison. Dans le même temps, le domaine extracellulaire de CD47 pourrait aussi être replié, facilitant ainsi le contact plus étroit des membranes plasmiques et la fusion des cellules. |
Dans une étude récente, parue après la publication de cet article, le rôle inattendu de la protéine transmembranaire dendritique cellule-spécifique DC-STAMP dans la fusion de cellules à cellules des ostéoclastes et des cellules géantes à corps étrangers a été démontrée [
23], et l’implication de cette découverte a été analysée [
24]. |
Les macrophages doivent d’abord s’identifier comme « soi » pour pouvoir fusionner Puisque l’une des principales fonctions des macrophages est d’internaliser les cellules apoptotiques, les pathogènes et les corps étrangers avant de les acheminer vers les lysosomes pour les dégrader, les macrophages doivent adopter un système alternatif pour la cellocytose conduisant à la fusion. En effet, les cellules ayant subi une cellocytose survivent et sont intégrées en une nouvelle cellule. Les mécanismes utilisés par les macrophages pour internaliser les cellules apoptotiques impliquent des voies qui utilisent différents récepteurs de surface [
25]. Dans le cas des cellules apoptotiques, nous savons que l’apoptose est un processus moléculaire à plusieurs étapes associé à des modifications séquentielles des membranes plasmiques, outre l’expression élevée de la phosphosérine, cruciale pour la reconnaissance effective et la phagocytose des cellules cibles. [
26]. La différence entre la cellocytose et la phagocytose des cellules apoptotiques pourrait donc impliquer des déterminants de surface spécifiques exprimés par les cellules internalisées, tels que CD47. Effectivement, van den Berg et al. ont récemment suggéré que SIRPα-CD47 (référencé ici comme MFR-CD47) pourrait représenter un mécanisme très ancien de reconnaissance du soi [
27]. Cette idée repose sur des travaux originaux d’Oldenborg et al. [
28] démontrant que MFR/SIRPα délivre un signal négatif de régulation ; les hématies dépourvues de CD47 sont rapidement éliminées du flux sanguin par les macrophages de la rate ; CD47, normalement exprimé dans les hématies, empêche l’élimination en se liant à SIRPα. Cette observation fut la première indication que MFR/SIRα-CD47 formaient un complexe intervenant dans un mécanisme primaire de reconnaissance du soi. Le même groupe démontra ensuite que l’élimination et la phagocytose des hématies opsonisées (revêtues d’anticorps) étaient aussi régulées par MFR/SIRα-CD47 [28]. Ces constatations conduisirent van den Berg et al. [27] à formuler l’hypothèse suivante : si les propriétés structurelles et fonctionnelles sont partagées entre récepteurs d’antigènes et SIRP, il doit exister une structure ancestrale commune chez les vertébrés primitifs. Bien que leur proposition soit séduisante, elle ne prend pas en compte la fusion macrophage-macrophage. En poussant un peu plus avant ce modèle, on peut donc suggérer que la fusion macrophagique conduisant à la multinucléation implique un mécanisme de reconnaissance du soi qui fait partie intégrante de notre système de défense inné. Blander et Medzhitov [25] ont à ce propos montré qu’il existait deux mode de différenciation des phagosomes, constitutif et inductible. Seule la voie inductible stimule les récepteurs Toll-like qui ne reconnaissent pas les cellules apoptotiques acheminées par la voie constitutive. Ainsi, le destin des cellules internalisées dépendrait de récepteurs et serait décidé à un stade précoce. C’est pourquoi les cellules internalisées ne seraient pas acheminées vers les lysosomes pour être dégradées. Cette observation fondamentale peut expliquer la survie et l’intégration des macrophages qui ont fusionné entre eux et peut-être aussi de ceux qui ont fusionné avec des cellules somatiques et tumorales. |
La fusion des macrophages avec les cellules somatiques aboutit-elle à la réparation des tissus et des organes ? Vassilopoulos et al. [
29] ainsi que Wang et al. [
30] ont montré que les cellules souches hématopoïétiques peuvent donner naissance à des hépatocytes dans des foies lésés par fusion avec des hépatocytes résidents. La cellule ainsi fusionnée acquiert alors une nouvelle identité, celle de la cellule avec laquelle elle fusionne. Cette observation allait à l’encontre de la notion communément admise qu’il existe dans différents organes des progéniteurs capables de participer au renouvellement des cellules somatiques adultes [
31,
32]. L’ensemble de ces travaux et de ceux qui suivirent ouvrirent en réalité un débat entre les tenants de la transdifférenciation et les tenants de la fusion, qui est encore bien fragile, comme cela a déjà été rapporté dans ces colonnes (→). (→) m/s 2003, n° 6-7,p. 683 et 2004, n°12, p. 1061. Alors qu’une part du débat concerne la nature des cellules souches fusionnantes, qui sont considérées comme appartenant, en partie, à la lignée myéloïde [
33–
35], le mécanisme par lequel les cellules souches myéloïdes fusionnent avec les cellules somatiques n’a pas encore été clarifié. Une meilleure compréhension des mécanismes de fusion devrait permettre au débat de progresser. Les questions clés sont : comment la fusion se fait-elle ? Par quel mécanisme ? Et par quelle voie d’internalisation ? Si les macrophages fusionnent avec les cellules somatiques, ils doivent reconnaître différemment les cellules pré-apoptotiques et apoptotiques, peut-être à travers un ensemble de molécules de surface qui dirigent l’internalisation vers la cellocytose plutôt que vers la dégradation lysosomale, déterminant ainsi le destin des cellules internalisées. Une fois que les macrophages ont internalisé les cellules somatiques, les marqueurs moléculaires des deux cellules fusionnées colocalisent en microscopie optique. Mais les cellules internalisées pourraient ségréger dans un compartiment séparé empêchant le mélange des cytoplasmes, des organites, ainsi que du noyau. A contrario, si les cellules myéloïdes fusionnent vraiment avec les cellules somatiques, et si leurs contenus sont mélangés, il devrait être possible de trouver des marqueurs de reconnaissance de surface capables d’orienter le destin de la cellule internalisée. Cette façon de voir nous ramène à l’observation de Blander et Medzhitov [25] qui relie les voies d’internalisation à la nature de la cellule internalisée et au rôle de MFR/SIRα-CD47 dans la reconnaissance du soi. Finalement, la question la plus triviale est celle-ci : un hépatocyte ou un neurone fusionnerait-il avec une cellule médullaire ? Si le but de la fusion est la régénération, il est difficile de comprendre pourquoi les cellules myéloïdes se déguiseraient en cellules souches pour réparer les tissus ou les organes, le phénomène étant trop rare pour être efficace. Il est aussi possible que les macrophages nouvellement différenciés disposent de cellules apoptotiques précoces et promeuvent des réparations tissulaires endogènes en libérant des facteurs de croissance et des cytokines. Que les macrophages fusionnent avec les cellules somatiques pour réparer les tissus reste donc à démontrer. |
La fusion des macrophages avec les cellules cancéreuses initie-t-elle le processus métastatique ? Les cellules tumorales partagent avec les cellules souches la capacité de se renouveler et de migrer. Quand des cellules tumorales quittent leur tissu primaire pour en envahir un autre, elles sont devenues métastatiques. Les métastases sont l’un des atouts les plus redoutables des cancers, avec la dispersion des cellules tumorales vers des organes éloignés où elles peuvent proliférer. Les métastases résultent d’une augmentation de la motilité des cellules cancéreuses et de leur capacité d’échapper au système immunitaire. Ainsi, les cellules métastatiques semblent avoir au moins une des caractéristiques des macrophages, qui est la mobilité. Une revue exhaustive de la littérature [4] nous rappelle que le concept de métastases vient de la fusion de cellules tumorales et qu’il remonte à plus d’une centaine d’années. En 1871, Mekler émettait l’idée que les hybrides entre cellules cancéreuses immortalisées d’une tumeur primaire et leucocytes pouvaient acquérir la capacité des leucocytes de migrer à travers le corps et de s’établir dans des organes éloignés (cité dans [4]). Dans cette revue, Pawelek considère que « la digestion abortive des cellules tumorales apoptotiques peut être un puissant mécanisme de formation des hybrides ». Pawelek et al. publièrent une série d’articles décrivant l’augmentation du potentiel métastatique des cellules de mélanome artificiellement fusionnées avec des macrophages [
36,
37]. De plus, Duelli et Lazebnik [
38] ont discuté ce concept très peu répandu afin de le réactualiser. Cette fusion avérée de cellules tumorales entre elles ou avec des macrophages est probablement à l’origine d’aberrations chromosomiques, de modifications épigénétiques, et potentiellement à l’origine de processus métastatiques [39]. Les cellules nouvelles ainsi engendrées acquièrent de nouvelles fonctions en augmentant le répertoire cellulaire au sein des organismes. Dans le cas des cellules souches, le mécanisme par lequel la fusion se produit est inconnu. La reconnaissance du soi peut entraîner une cascade d’événements qui aboutit à la fusion. L’internalisation de cellules tumorales par les macrophages peut se servir des mêmes voies que celles utilisées par ces derniers pour fusionner entre eux ou avec les cellules somatiques. Le mélange de composants cellulaires provenant de cellules tumorales avec ceux des macrophages donnerait lieu à de nouvelles cellules tumorales qui deviendraient métastatiques. Si c’est le cas, les ostéoclastes localisés dans les régions de métastases pourraient contenir des noyaux qui proviendraient des tumeurs primaires. De nouveau, on le voit, il est nécessaire de réétudier les métastases, en s’intéressant particulièrement à la reconnaissance du soi et à la cellocytose. Le processus métastatique est une étape essentielle dans l’évolution des cancers. Définir le rôle des macrophages dans cet événement est essentiel. |
Conclusions et perspectives Les macrophages possèdent une machinerie de fusion très sophistiquée qui leur confère un puissant pouvoir destructeur en tant qu’ostéoclastes multinucléés ou cellules géantes. Ils semblent utiliser aussi cette machinerie de fusion pour contrôler le destin d’autres cellules, en devenant des sauveteurs ou des tueurs. Les macrophages peuvent utiliser l’axe MFR-CD47 pour s’identifier et se reconnaître comme « soi », de même que pour reconnaître des cellules somatiques ou des cellules tumorales. Ils peuvent aussi utiliser ce même axe pour rapprocher les membranes plasmiques et fusionner. L’axe MFR-CD47 pourrait donc jouer un double rôle : d’abord reconnaissance du soi, puis rapprochement des cellules conduisant à leur fusion. Certains de ces aspects de la fusion de macrophages, nouveaux et controversés, restent encore insuffisamment étudiés. La fusion cellulaire a été utilisée en laboratoire comme outil de production d’anticorps monoclonaux, comme méthode d’identification des oncogènes et des gènes suppresseurs de tumeurs, ainsi que comme moyen d’identifier les gènes portés par un chromosome. La fusion cellulaire peut aussi devenir un outil thérapeutique pour livrer des gènes ou des médicaments de façon ciblée à des cellules spécifiques. Les applications thérapeutiques d’une telle stratégie comprennent les cancers, les maladies infectieuses et les maladies génétiques. L’exploitation des capacités de fusion des macrophages, jointes à leur mobilité, peut acheminer des gènes ou des molécules vers des cellules ciblées. Il est donc capital d’acquérir une complète compréhension de la machinerie moléculaire qui régit la fusion des macrophages. Une fois celle-ci élucidée, nous serons capable de développer des méthodes préventives pour les maladies dans lesquelles macrophages, cellules somatiques et cellules tumorales sont impliqués. |
1. Greaves DR, Gordon S. Macrophage-specific gene expression: current paradigms and future challenges. Int J Hematol 2002; 76 : 6–15. 2. Medzhitov R, Janeway CA Jr. Decoding the patterns of self and nonself by the innate immune system. Science 2002; 296 : 298–300. 3. Denkers EY. From cells to signaling cascades: manipulation of innate immunity by Toxoplasma gondii. FEMS Immunol Med Microbiol 2003; 39 : 193–203. 4. Pawelek JM. Tumour cell hybridization and metastasis revisited. Melanoma Res 2000; 10 : 507–14. 5. Vignery A, Niven-Fairchild T, Ingbar DH, Caplan M. Polarized distribution of Na+,K+-ATPase in giant cells elicited in vivo and in vitro. J Histochem Cytochem 1989; 37 : 1265–71. 6. Vignery A. Macrophage multinucleation is accompanied by the expression of new soluble and membrane antigens in mice. Am J Pathol 1989; 135 : 565–70. 7. Vignery A Niven-Fairchild T, Shepard MH. Recombinant murine interferon gamma inhibits the fusion of mouse alveolar macrophages in vitro but stimulates the formation of osteoclast-like cells on implanted syngeneic bone particles in vivo. J Bone Miner Res 1990; 5 : 637–44. 8. Vignery A. Osteoclasts and giant cells: macrophage-macrophage fusion mechanism. Int J Exp Pathol 2000; 81 : 291–304 9. Saginario C, Qian HY, Vignery A. Identification of an inducible surface molecule specific to fusing macrophages. Proc Natl Acad Sci USA 1995; 92 : 12210–4. 10. Saginario C, Sterling H, Beckers C, et al. MFR, a putative receptor mediating the fusion of macrophages. Mol Cell Biol 1998; 18 : 6213–23. 11. Sterling H, Saginario C, Vignery A. CD44 occupancy prevents the fusion of macrophages. J Cell Biol 1998; 143 : 837–47. 12. Han X, Sterling H, Chen Y, et al. CD47, a ligand for MFR, participates in macrophage multinucleation. J Biol Chem 2000; 275 : 37984–92. 13. Kharitonenkov A, Chen Z, Sures I, et al. A family of proteins that inhibit signalling through tyrosine kinase receptors. Nature 1997; 386 : 181–6. 14. Fujioka Y, Matozaki T, Noguchi T, et al. A novel membrane glycoprotein, SHPS-1, that binds the SH2-domain-containing protein tyrosine phosphatase SHP-2 in response to mitogens and cell adhesion. Mol Cell Biol 1996; 16 : 6887–99. 15. Sano S, Ohnishi H, Omori A, et al. BIT, an immune antigen receptor-like molecule in the brain. FEBS Lett 1997; 411 : 327–34. 16. Comu S, Weng W, Olinsky S, et al. The urine P84 neural adhesion molecule is SHPS-1, a member of the phosphatase-binding protein family. J Neurosci 1997; 17 : 8702–10. 17. Brooke GP, Parsons KR, Howard CJ. Cloning of two members of the SIRP alpha family of protein tyrosine phosphatase binding proteins in cattle that are expressed on monocytes and a subpopulation of dendritic cells and which mediate binding to CD4 T cells. Eur J Immunol 1998; 28 : 1–11. 18. Dalgleish AG, Beverley PC, Clapham PR, et al. The CD4 (T4) antigen is an essential component of the receptor for the AIDS retrovirus. Nature 1984; 312 : 763–7. 19. Klatzmann D, Champagne E, Chamaret S, et al. T-lymphocyte T4 molecule behaves as the receptor for human retrovirus LAV. Nature 1984; 312 : 767–8. 20. Oshima K, Ruhul Amin AR, Suzuki A, et al. SHPS-1, a multifunctional transmembrane glycoprotein. FEBS Lett 2002; 519 : 1–7. 21. Cant CA, Ullrich A. Signal regulation by family conspiracy. Cell Mol Life Sci 2001; 58 : 117–24. 22. Kajita M, Itoh Y, Chiba T, et al. Membrane-type 1 matrix metalloproteinase cleaves CD44 and promotes cell migration. J Cell Biol 2001; 153 : 893–904. 23. Yagi M, Miyamoto T, Sawatani Y, et al. DC-STAMP is essential for cell-cell fusion in osteoclasts and foreign body giant cells. J Exp Med 2005; 202 : 345–51. 24. Vignery A. Macrophage fusion : the making of osteoclasts and giant cells. J Exp Med 2005; 202 : 337–40. 25. Blander JM, Medzhitov R. Regulation of phagosome maturation by signals from Toll-like receptors. Science 2004; 304 : 1014–8. 26. Williamson P, Schlegel RA. Transbilayer phospholipid movement and the clearance of apoptotic cells. Biochim Biophys Acta 2002; 1585 : 53–63. 27. Van den Berg TK, Yoder JA, Litman GW. On the origins of adaptive immunity: innate immune receptors join the tale. Trends Immunol 2004; 25 : 11–6. 28. Oldenborg PA, Zheleznyak A, Fang YF, et al. Role of CD47 as a marker of self on red blood cells. Science 2000; 288 : 2051–4. 29. Vassilopoulos G, Wang PR, Russell DW. Transplanted bone marrow regenerates liver by cell fusion. Nature 2003; 422 : 901–4. 30. Wang X, Willenbring H, Akkari Y, et al. Cell fusion is the principal source of bone-marrow-derived hepatocytes. Nature 2003; 422 : 897–901. 31. Vassillopoulos G, Russell DW. Cell fusion: an alternative to stem cell plasticity and its therapeutic implication. Curr Opin Genet Dev 2003; 13 : 480–5. 32. Medvinsky A, Smith A. Fusion brings down barriers. Nature 2003; 422 : 823–5. 33. Willenbring H, Bailey AS, Foster M, et al. Myelomonocytic cells are sufficient for therapeutic cell fusion in liver. Nat Med 2004; 10 : 744–8. 34. Camargo FD, Chambers SM, Goodell MA. Hematopoietic myelomonocytic cells are the major source of hepatocyte fusion partners. J Clin Invest 2004; 113 : 1266–71. 35. Camargo FD, Chambers SM, Goodell MA. Stem cell plasticity: from transdifferentiation to macrophage fusion. Cell Prolif 2004; 37 : 55–65. 36. Chakraborty AK, De Freitas Sousa J, Espreafico EM, Pawelek JM. Human monocyte x mouse melanoma fusion hybrids express human gene. Gene 2001; 275 : 103–6. 37. Chakraborty AK, Kolesnikova N, Sousa J, et al. Expression of c-met proto-oncogene in metastatic macrophages X melanoma fusion hybrids: implication of its possible role in MSH-induced motility. Oncol Res 2003; 14 : 163–74. 38. Duelli D, Lazebnik Y. Cell fusion: a hidden enemy ? Cancer Cell 2003; 3 : 445–8. 39. Ohnishi H, Kobayashi H, Okazawa H, et al. Ectodomain shedding of SHPS-1 and its role in regulation of cell migration. J Biol Chem 2004; 279 : 27878–87. |