Vingt ans après leur découverte, l’intérêt croissant que suscitent les facteurs de transcription NF-κB émane de la multiplicité des réponses cellulaires auxquelles ces facteurs sont associés. Ils jouent en effet un rôle clé dans la réponse immune, inflammatoire, proliférative et apoptotique, mais aussi dans la tumorigenèse [ 1– 4]. Ainsi, le dérèglement de l’activité de ces facteurs, via la production de formes anormales de NF-κB, ou une régulation défectueuse de leurs activités transcriptionnelles, est retrouvée de manière récurrente dans de nombreuses formes de cancers telles que les leucémies chroniques lymphoïdes et lymphocytaires à cellules B et de nombreux lymphomes [4]. Plus récemment, il a été mis en évidence que les facteurs NF-κB participent également au développement des tumeurs en activant des gènes de résistance à l’apoptose, rendant ainsi certaines tumeurs résistantes aux traitements chimiothérapiques et radiothérapiques [ 5]. Il apparaît donc clairement que l’élucidation des mécanismes moléculaires permettant l’activation de ces facteurs est indispensable à la conception de thérapeutiques futures fondées sur le contrôle de l’activité transcriptionnelle de ces protéines.
La famille NF-κB compte cinq membres chez les vertébrés : NF-κB1 (p50 et son précurseur p105), NF-κB2 (p52 et son précurseur p100), c-Rel, RelA (p65) et RelB [ 6]. Ces protéines s’associent en une collection variée d’homo- et d’hétérodimères, dont l’activité transcriptionnelle est régulée par deux voies principales. La première, plus connue sous le terme de voie d’activation canonique de NF-κB, s’applique principalement aux dimères RelA/p50 [ 7]. Sous leur forme inactive, les dimères RelA/p50 sont retenus dans le cytoplasme par leur association avec les protéines inhibitrices IκB. En réponse à une grande variété de stimuli comme les cytokines pro-inflammatoires (TNFα, IL-1), lipopolysaccharides bactériens (LPS), virus, protéines virales, ARN double brin, esters de phorbol, agents génotoxiques et radiations, les IκB sont rapidement phosphorylées, ubiquitinylées et, finalement, dégradées. Les dimères RelA/p50 ainsi libérés passent alors dans le noyau et activent la transcription de gènes cibles spécifiques [7]. Plus récemment, une seconde voie d’activation de NF-κB, qui s’applique principalement à RelB, a été caractérisée. Cette voie, maintenant appelée voie alternative d’activation de NF-κB, repose sur la protéolyse induite par différents membres de la superfamille du TNF (tumor necrosis factor) (lymphotoxine β, BAFF) de la protéine p100, l’inhibiteur principal de RelB, et aboutit à la libération, la translocation nucléaire et la liaison à l’ADN des dimères RelB/p50 et RelB/p52 [ 8, 9].
Il est important de noter que le TNFα et la lymphotoxine β, bien que faisant toutes deux partie de la superfamille du TNF, n’induisent pourtant pas les mêmes cascades de signalisation de NF-κB [9]. Ainsi, le TNFα est un inducteur de la voie canonique (RelA) et non de la voie alternative de NF-κB (RelB). Quelle n’a donc pas été notre surprise quand nous avons observé que la stimulation par le TNFα induit pourtant l’accumulation nucléaire de RelB dans les fibroblastes embryonnaires murins (MEF) [ 10] ! Néanmoins, contrairement à RelA, l’accumulation nucléaire de RelB induite par le TNFα n’aboutit pas à une augmentation de sa liaison à l’ADN, suggérant l’existence de mécanismes de régulation de la liaison à l’ADN de RelB dans le noyau de ces cellules. Le TNFα étant l’inducteur par excellence de la voie canonique et donc de l’activité de RelA, nous avons entrepris de décrypter le rôle joué par RelA dans la régulation de RelB en réponse au TNFα.
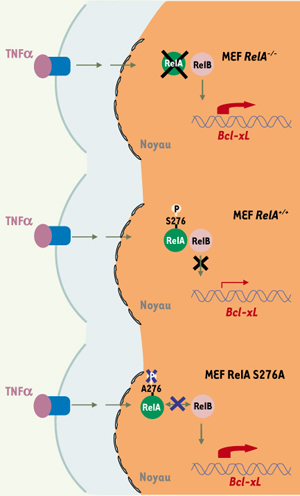
Notre étude a ainsi mis en évidence que la stimulation par le TNFα induit l’association de RelA avec RelB dans le noyau des MEF et que la séquestration de RelB dans les hétérodimères RelA/RelB bloque sa liaison à l’ADN [10]. Nous avons également démontré que la sérine-276 de RelA, dont la phosphorylation est induite par le TNFα in vivo, est cruciale pour la formation du complexe RelA/RelB ainsi que pour l’inhibition subséquente de la liaison à l’ADN de RelB (Figure 1).
| Figure 1.
Modèle du mécanisme de régulation de RelB par RelA en réponse au TNFα. Dans les fibroblastes embryonnaires murins sauvages (MEF RelA+/+
) (milieu), la stimulation par le TNFα induit l’association de RelA avec RelB dans le noyau, ce qui conduit à l’inhibition de la liaison à l’ADN de RelB ainsi qu’à une faible induction de l’expression de certains gènes cibles de NF-κB dont le gène anti-apoptotique Bcl-xL. En revanche, dans les fibroblastes déficients en RelA (MEF RelA−/−
) (haut), RelB est libre de se lier au promoteur de Bcl-xL et d’induire fortement son expression en réponse au TNFα. Le rôle crucial de la phosphorylation de la sérine-276 de RelA dans ce mécanisme est également illustré (bas). La mutation de la sérine-276 de RelA en alanine (MEF RelA S276A) réduit très fortement l’interaction de RelA avec RelB, permettant ainsi à RelB de se lier à l’ADN et d’activer fortement la transcription de Bcl-xL. |
Il était important, dans une seconde étape, de déterminer si l’effet inhibiteur de RelA sur la liaison à l’ADN de RelB pouvait affecter la transcription de gènes cibles de la famille NF-κB. Nous avons ainsi identifié plusieurs gènes cibles, parmi lesquels le gène anti-apoptotique Bcl-xL, dont l’expression est fortement induite par le TNFα dans les fibroblastes déficients en RelA alors qu’une telle induction n’est pas observée dans les cellules sauvages [10]. Cette observation montre bien que RelA, jusqu’alors décrit uniquement comme un activateur transcriptionnel, pouvait également exercer des fonctions répressives servant à limiter la transcription de certains gènes cibles de NF-κB. Nous avons ensuite démontré par interférence ARN que RelB contrôle l’augmentation de l’expression de Bcl-xL induite par le TNFα en l’absence de RelA, et nous avons mis en évidence par immunoprécipitation de chromatine que RelB se lie au promoteur de Bcl-xL [10]. Ces données révèlent donc que l’activité répressive de RelA sur l’expression de Bcl-xL s’exerce bien via la régulation de l’activité de RelB. La sérine-276 de RelA étant cruciale pour la formation du complexe RelA/RelB et le blocage de la liaison à l’ADN de RelB, l’ensemble de nos résultats suggère que l’hétérodimérisation de RelA avec RelB permet de limiter l’expression de certaines cibles transcriptionnelles de RelB, telles que le gène anti-apoptotique Bcl-xL (Figure 1).