Malgré d’importants progrès réalisés au cours de ces dernières décennies, les maladies cardiovasculaires restent à l’heure actuelle la première cause de morbidité et de mortalité dans les pays industrialisés [ 1]. C’est pourquoi l’amélioration des traitements préventifs et thérapeutiques représente un important enjeu humain, économique et social. Elle requiert avant tout une meilleure connaissance des mécanismes cellulaires et moléculaires mis en jeu dans la physiopathologie de l’athérosclérose.
L’athérosclérose est à l’origine de la plupart des maladies cardiovasculaires. Maladie progressive multi-factorielle, elle se caractérise par l’accumulation de lipides et de tissu conjonctif fibreux dans les artères [ 2]. La sécrétion de cytokines et de facteurs de croissance induite localement en réponse à la lésion de la paroi artérielle provoque l’activation et la prolifération des cellules musculaires lisses vasculaires (CML). La formation d’une hyperplasie intimale qui en résulte peut entraîner l’occlusion de la lumière artérielle. Cette induction de la prolifération des CML, associée à la réponse inflammatoire locale dans la paroi vasculaire joue ainsi un rôle décisif dans le développement de l’athérosclérose. Elle intervient aussi dans la survenue de complications après des procédures médicales pour traiter la maladie, telles que la resténose-occlusion secondaire à une angioplastie transluminale avec ou sans mise en place d’une prothèse endocoronaire (stent) - et la vasculopathie du greffon lors d’un pontage veineux [ 3]. La resténose survient chez 30 % à 50 % des patients après une intervention coronarienne percutanée, et 20 % d’entre eux devront subir d’autres interventions, par exemple un pontage, lui-même limité par le risque de rejet de la greffe veineuse à la suite de l’obstruction luminale [ 4].
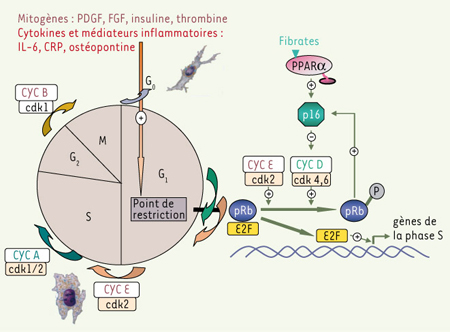
L’activation des CML induit leur changement phénotypique, qui est associé à une altération des mécanismes contrôlant le cycle cellulaire. Alors que les cellules de la paroi artérielle normale sont en phase G0 du cycle cellulaire (état quiescent, différentié et contractile), leur activation induit leur progression à travers la phase G1 et l’entrée en phase S, phase de duplication des chromosomes (état dé-différencié, synthétique et prolifératif, ressemblant à un phénotype de cellules embryonnaires) [ 5]. La transition G1 à S est principalement contrôlée par la phosphorylation de pRB (produit du gène du rétinoblastome) par les kinases dépendantes des cyclines (CDK) [ 6] (Figure 1). Ces CDK sont activées par leur liaison avec des cyclines et inhibées par des inhibiteurs des CDK (CDKI), qui sont exprimés transitoirement et spécifiquement au cours du cycle cellulaire [6]. Ainsi, l’augmentation de la phosphorylation de pRB est considérée comme le point de départ de la formation de l’hyperplasie intimale [3]. La caractérisation des mécanismes mis en jeu dans cette (dé)régulation du cycle cellulaire des CML et la recherche de stratégies pour les contrer apparaît aujourd’hui clairement comme un objectif majeur dans la recherche contre l’athérosclérose et les maladies vasculaires occlusives associées.
| Figure 1.
Les fibrates inhibent la progression du cycle cellulaire de la phase G1 en phase S
via
l’induction de p16 et l’inhibition conséquente de la phosphorylation de pRB. Dans les cellules de mammifères, la phosphorylation du produit du gène du rétinoblastome (pRB) par les kinases dépendantes des cyclines (CDK) permet la libération des facteurs de transcription de la famille E2F et représente le point de restriction (ou point de non-retour) de la transition G1 à S [6]. Elle dépend des niveaux d’expression des cyclines et des inhibiteurs des CDK (CDKI). La fonction de p16 - à la fois CDKI et suppresseur de tumeur - est unique dans son interdépendance avec celle de pRB [6,
12]. |
Les fibrates (tels que le gemfibrozil, bezafibrate, ciprofibrate et fénofibrate), molécules synthétiques, sont des médicaments actuellement administrés seuls ou en combinaison avec les statines aux patients qui ont un risque cardiovasculaire élevé (tels que les patients diabétiques et les patients ayant eu un infarctus) pour empêcher la progression de l’athérosclérose [ 7]. En prévention secondaire, ils diminuent la morbidité due aux maladies cardiovasculaires [7, 8]. Sur le plan moléculaire, ils agissent via la liaison avec le récepteur nucléaire PPARα (peroxisome proliferator-activated receptor α) provoquant sa dimérisation avec un autre récepteur nucléaire, le RXR (retinoid X-receptor) [ 9]. L’hétérodimère se lie alors sur des éléments spécifiques de l’ADN (appelés PPAR-response elements ou PPRE) pour activer l’expression des gènes cibles de PPARα. Par ailleurs, PPARα activé peut aussi réguler indirectement l’expression du gène cible en se liant à des protéines elles-mêmes fixées sur l’ADN [7]. L’effet bénéfique des fibrates a été attribué à leur action métabolique systémique menant à l’amélioration du profil lipidique, caractérisée par une diminution des taux de triglycérides et de VLDL (very low-density lipoproteins), et une augmentation des taux de HDL (high-density lipoproteins) dans le plasma [7]. Cependant, plusieurs études cliniques récentes (BECAIT, LOCAT et DAIS) ont mis en évidence la mise en jeu des voies alternatives à la voie systémique dans l’effet inhibiteur des fibrates sur la progression de la plaque athéromateuse [7]. De plus, dans l’essai de prévention secondaire VA-HIT, la diminution de l’incidence des problèmes cardiovasculaires observée après traitement au gemfibrozil ne pouvait pas être corrélée uniquement à l’augmentation des taux de HDL [8]. Corrélativement, plusieurs données in vitro et ex vivo ont récemment mis en évidence un rôle direct de PPARα sur le contrôle de l’efflux du cholestérol et de la réponse inflammatoire sur les cellules de la paroi vasculaire [7]. Tout récemment, nous avons étudié l’éventuel rôle de PPARα dans le contrôle de la progression du cycle cellulaire des CML [ 10].
Pour ce faire, nous avons utilisé : (1) des CML aortiques primaires humaines et murines induites pour proliférer dans du milieu normal après avoir été synchronisées en G0/G1 par incubation dans du milieu carencé en sérum et facteurs de croissance ; et (2) un modèle murin de lésion mécanique de l’artère carotidienne [ 11] provoquant une destruction de la couche endothéliale et une rupture de la lame élastique interne. À la suite de cette lésion, il se forme une néointima due à l’accumulation excessive de CML et de matrice extracellulaire dans la zone intimale de la paroi artérielle, processus observé au cours de la resténose humaine [11]. Ces travaux nous ont permis de activé par les fibrates inhibe la phosphorylation montrer que PPARα de pRB et la transition G1 à S du cycle cellulaire via l’augmentation de l’expression du CDKI p16INK4A (ou p16).
Jusqu’alors, p16 était connu comme gène suppresseur de tumeur, sa perte de fonction étant impliquée dans l’initiation et le développement de certains cancers : leucémie lymphoblastique aiguë, lymphome, carcinome pulmonaire et mélanome [6, 12, 13]. La fonction de p16 en tant que CDKI est unique, car son activité est interdépendante de celle de pRB : son expression est régulée au niveau transcriptionnel par les niveaux d’expression et de phosphorylation de pRB et elle intervient dans le rétrocontrôle négatif de la transition G1 à S induite par activation mitogène [12] (Figure 1). De façon intéressante, nous avons noté que l’expression de p16 est drastiquement augmentée à la suite de la lésion carotidienne, suggérant que p16 est aussi induit comme rétrocontrôle négatif au stress vasculaire afin de limiter le développement de l’hyperplasie intimale. De plus, la prolifération des CML (primaires ou dans le modèle murin de lésion de l’artère carotidienne) est considérablement augmentée chez des souris invalidées pour l’expression de p16 (souris p16−/− ) [13]. Ces résultats indiquent pour la première fois qu’un suppresseur de tumeur peut être impliqué dans le (dys)fonctionnement vasculaire.
Plusieurs études avaient montré précédemment que, comme pour p16, l’activité de PPARα est induite principalement en réponse aux stress (tels que le jeûne, un régime riche en graisses, une exposition à des facteurs inflammatoires). Nos travaux indiquent aussi un rôle majeur de PPARα dans la réponse à la lésion vasculaire, notamment parce que la déficience de l’expression de PPARα exacerbe l’induction de la prolifération des CML et l’hyperplasie intimale chez les souris PPARα−/− , mais ne modifie pas de façon significative la morphologie de la paroi vasculaire normale [10].
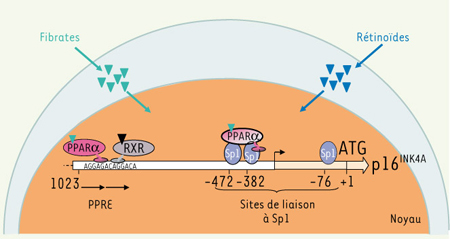
Par ailleurs, une caracterisation moleculaire approfondie des mecanismes impliques dans la voie PPARα/p16 a montre que p16 est un gene cible direct de PPARα. Active par les fibrates, PPARα regule la transcription du gene p16 en se liant directement a l’ADN sur un PPRE canonique et en interagissant avec le facteur de transcription Sp1 a proximite du site d’initiation de la transcription (Figure 2). Ces resultats fournissent ainsi la premiere preuve de la capacite d’un PPAR a interferer directement avec les facteurs du cycle cellulaire.
| Figure 2.
Régulation du gène codant p16 par PPARaactivé par les fibrates. Sous activation par les fibrates, PPARα forme un hétérodimère avec RXR et active l’expression du gène codant p16 via deux mécanismes dits de trans-activation : (1) sa liaison directe avec l’ADN au niveau d’un PPRE consensus (qui correspond à une séquence DR1 dégénérée), comme cela a été bien caractérisé pour de nombreux gènes cibles de PPARα [7], et (2) son interaction avec des protéines Sp1 à proximité du site d’initiation de la transcription (indiqué par la flèche). L’ATG correspond au site d’initiation de la traduction. |
L’ensemble de nos données indiquent donc une fonction particulière pour la voie PPARα/p16 dans la prévention et la limitation de l’hyperplasie intimale en réponse à une lésion vasculaire. Elles suggèrent, qu’outre leur application contre les dyslipidémies, les fibrates pourraient aussi être utilisés dans la prévention et le traitement de la resténose et des autres complications vasculaires occlusives faisant suite aux interventions chirurgicales. Dans le cadre du développement actuel des prothèses endocoronaires coatées, les fibrates (ainsi que les autres molécules activant l’expression et/ou l’activité de p16) pourraient être testés comme une alternative intéressante aux agents anti-mitotiques qui sont actuellement utilisés (tels que la rapamycine), mais pour lesquels il existe un risque d’altération du processus de ré-endothelialisation [4].