| |
| Med Sci (Paris). 2006 June; 22(6-7): 614–620. Published online 2006 June 15. doi: 10.1051/medsci/20062267614.Activation de l’ostéoclasie par les endotoxines bactériennes au cours des maladies parodontales Philippe Doucet1* and Morgan Lowenstein2 1Laboratoire sur la réparation et les remodelages oro-faciaux, EA2496, Faculté de Chirurgie dentaire, Université Paris 5, 1, rue Maurice Arnoux, 92120 Montrouge, France 224, rue Palouzie, 93400 Saint-Ouen, France |
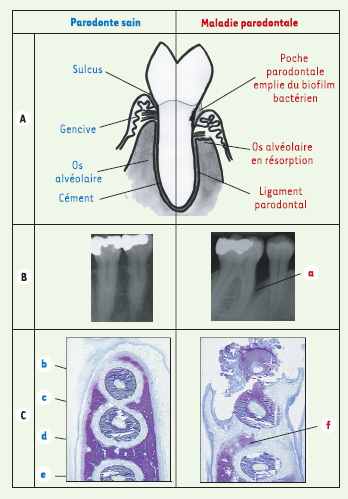
Les maladies parodontales La prévalence des maladies parodontales (ou parodontites) est d’environ 80 % dans les populations adultes occidentales. Ces maladies, qui existent sous forme chronique ou agressive, aboutissent à la destruction du système d’attache de la dent : cette destruction du parodonte a des conséquences importantes sur les plans fonctionnel (douleur, mobilités dentaires, diminution des fonctions masticatoire et phonatoire) et esthétique (rétraction de la gencive, migrations dentaires…). À son stade le plus avancé, elle provoque la chute des dents. La forte prévalence de ces maladies, leurs conséquences cliniques et les coûts importants liés à leurs traitements ou à ceux de leurs séquelles en font un problème sérieux de santé publique. De plus, les parodontites ont une incidence sur certaines pathologies, notamment les maladies cardiovasculaires et le diabète, ce qui rend d’autant plus importante la compréhension de leurs mécanismes de progression. Le parodonte est composé de l’ensemble des tissus de soutien des dents : cément, gencive, ligament parodontal et os alvéolaire. Entre la gencive et la surface dentaire, il existe un espace virtuel (sulcus) colonisé par des bactéries. Lorsque la maladie s’installe, le sulcus s’approfondit pour former une poche parodontale, qui devient un véritable réservoir à bactéries dans lequel se développe un écosystème bactérien difficile à éliminer, car peu accessible aux mesures d’hygiène buccodentaires habituelles (Figure 1). 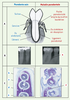 | Figure 1.
Les maladies parodontales. A. Une dent et son parodonte chez un sujet sain et chez un sujet atteint de parodontite. B. Radiographies de dents et de leur support osseux. Noter la volumineuse alvéolyse (a) autour de la dent chez le patient atteint de maladie parodontale. C. Coupes histologiques (bleu de toluidine, x 4) d’une mandibule de hamster sain ou atteint de parodontite. b : racine dentaire, c : ligament parodontal, d : os alvéolaire, e : gencive. Chez le hamster atteint de maladie parodontale, noter les importantes destructions tissulaires, et notamment la forte résorption de l’os alvéolaire (f). |
La cavité buccale, lieu d’échange direct entre l’organisme et son environnement, héberge plus de 300 espèces bactériennes chez l’individu sain. Le passage de l’état sain à l’atteinte parodontale est lié à une modification de la nature et/ou de la quantité des bactéries présentes dans les poches parodontales. L’atteinte parodontale est caractérisée par une augmentation des bactéries à Gram négatif, dans les poches parodontales, de 15 % à l’état normal à plus de 50 % chez l’individu atteint, tandis que le nombre de bactéries est multiplié par un facteur 102 à 105 [
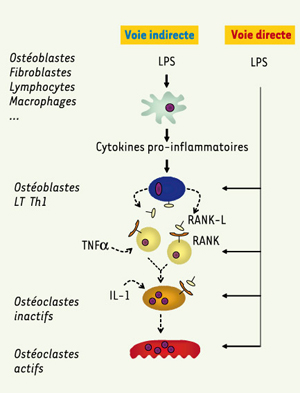
1]. Certaines espèces bactériennes ont été impliquées plus spécifiquement dans l’étiopathogénie des parodontites, notamment Porphyromonas gingivalis, Actinobacillus actinomycetemcomitans et Tannerella forsythensis. Bien que les bactéries puissent se trouver libres au contact des dents, la majorité s’organise en un biofilm bactérien, ou plaque dentaire. Ce biofilm, défini comme une communauté « de populations bactériennes adhérant les unes aux autres et/ou aux surfaces ou interfaces, et emprisonnées dans une matrice », est une structure stable et résistante à l’élimination ; il représente un réservoir d’antigènes bactériens au contact des tissus parodontaux. Le biofilm libère en permanence des composants bactériens antigéniques (LPS, arabinomananes, fimbriae…) qui pénètrent les tissus parodontaux et entraînent leur destruction : les mieux décrits, et probablement les plus pathogènes de ces antigènes, sont les LPS, composants de la paroi externe des bactéries à Gram négatif. Parmi les effets de ces toxines, la destruction de l’os alvéolaire est particulièrement problématique du fait de son irréversibilité. Il existe deux voies d’activation des ostéoclastes par les LPS présents dans les poches parodontales (Figure 2). L’une, indirecte, découle de la libération de cytokines pro-inflammatoires par les cellules présentes sur le site de l’infection ; ces cytokines agissent sur les ostéoblastes et les lymphocytes Th1 et induisent l’expression de RANK-L à leur surface : ce sont les interactions entre RANK-L (ligand de RANK) et RANK (receptor activator of NF-κB), situé à la surface des pré-ostéoclastes et des ostéoclastes inactifs, qui induisent la différenciation et l’activation des ostéoclastes. La seconde voie, décrite plus récemment, est la conséquence d’une action directe des LPS sur les ostéoblastes, les ostéoclastes et les pré-ostéoclastes ; totalement indépendante des cytokines pro-inflammatoires, cette voie vient amplifier la précédente. 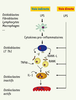 | Figure 2.
Voies directes et indirectes d’activation des ostéoclastes par les LPS.
|
Le récepteur des LPS impliqué dans les maladies parodontales est constitué de deux protéines : CD14, une glycoprotéine (libre ou membranaire) sur laquelle se fixe le LPS, et TLR4 (Toll-like receptor 4), une protéine transmembranaire qui, sous forme dimérique, s’associe à CD14 et assure la transduction du message [
2–
4]. In vivo, la LBP (LPS binding protein) se fixe aux LPS et potentialise leur action ; en présence de LBP, la sensibilité des récepteurs aux LPS est très fortement augmentée. |
Voie indirecte d’activation des ostéoclastes Sécrétion de cytokines pro-inflammatoires par les fibroblastes, les macrophages, les ostéoblastes et les lymphocytes T Une fois stimulés par les LPS, ostéoblastes, macrophages, lymphocytes T CD4 + (LT4) et fibroblastes sécrètent un pool de cytokines pro-inflammatoires (interleukines-1 et 6) (IL-1 et IL-6), prostaglandine E2 (PGE2) et TNF α ( tumor necrosis factor
α) [
5,
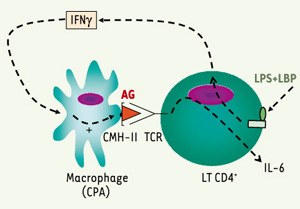
6]. Pour les ostéoblastes, les fibroblastes et les macrophages, l’interaction des LPS avec leurs récepteurs CD14/TLR 4 entraîne une sécrétion directe de ces cytokines. En revanche, celle des LT4 est indirecte, et demande l’intervention d’une cellule présentatrice de l’antigène (CPA) : en réponse aux LPS, les LT sécrètent de l’IFN γ, qui augmente l’expression de CMH-II par les CPA ; l’interaction du CMH-II présentant un antigène avec son récepteur exprimé par les LT4 entraîne alors la sécrétion d’IL-6 par ces lymphocytes [
7] (Figure 3). La production de ces cytokines pro-inflammatoires, notamment d’IL-1 et de TNF α, est principalement assurée par les macrophages [
8]. 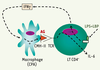 | Figure 3.
Induction de la sécrétion de cytokines pro-inflammatoires par les LT CD4+. En réponse aux LPS, les LT sécrètent de l’IFNγ, qui provoque une surexpression des molécules de CMH-II à la surface des CPA (cellules présentant l’antigène). L’augmentation de la stimulation des TCR (récepteurs des cellules T) par les CMH-II présentant l’antigène entraîne la sécrétion d’IL-6 par les LT. |
La réaction de cette première ligne de défense aux LPS correspond donc à une sécrétion massive de cytokines pro-inflammatoires, constituant le premier pas d’une cascade d’événements aboutissant au déclenchement de la résorption osseuse [
9]. Les cytokines pro-inflammatoires induisent l’expression de RANK-L par les ostéoblastes et les LT En présence de M-CSF ( macrophage-colony stimulating factor), les cytokines pro-inflammatoires (TNF α, IL-1 et 6) induisent la synthèse de RANK-L par les ostéoblastes, et amplifient leur sécrétion de MCSF [
10]. La découverte du rôle des lymphocytes T dans la résorption osseuse est récente [
11]. Les lymphocytes Th1, mais pas les lymphocytes Th2, interviennent dans la résorption osseuse chez le rat [
12] et, de fait, RANK-L est principalement exprimé sur les LT Th1 [
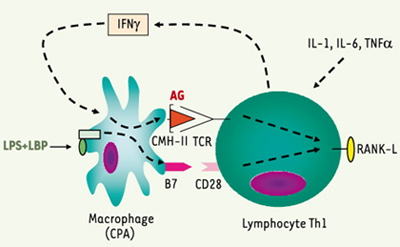
13]. La régulation de l’expression de RANK-L au niveau des LT nécessite deux signaux : la stimulation de leur TCR (récepteur des cellules T) par un antigène présenté par un CMH-II [
14], et la costimulation de leur récepteur CD28 par la protéine B7, située dans la membrane plasmique des CPA (par exemple des macrophages) [12]. Au niveau des macrophages, l’expression de B7 est induite par l’activation des récepteurs des LPS [
15]. L’expression du CMH-II est, quant à elle, régulée par l’IFNγ sécrété par les LT Th1 en réponse aux cytokines pro-inflammatoires (Figure 4). 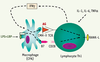 | Figure 4.
Induction de l’expression de RANK-L sur les lymphocytes Th1. En réponse aux cytokines pro-inflammatoires, les LT Th1 sécrètent de l’IFNγ qui provoque une surexpression des molécules de CMH-II à la surface des CPA. Par ailleurs, la stimulation des CPA par les LPS entraîne l’expression de la molécule de costimulation B7. C’est la double stimulation des LT par B7 d’une part, et CMH-II associé à un antigène d’autre part, qui permet l’augmentation de l’expression de RANK-L à leur surface. |
La synthèse de RANK-L au niveau des ostéoblastes et des lymphocytes T est inhibée par l’IL-4, produite par les LT4 de phénotype Th2 : l’IL-4 est donc un inhibiteur de la destruction osseuse par son inhibition de l’expression de RANK-L. Différenciation des pré-ostéoclastes en ostéoclastes inactifs par la voie RANK-L/RANK/OPG L’interaction, par contacts cellulaires, entre RANK-L, situé sur les ostéoblastes et sur les lymphocytes Th1, et RANK, situé sur les pré-ostéoclastes, induit la différenciation des pré-ostéclastes en ostéoclastes inactifs [
16,
17]. La régulation de l’interaction RANK-L/RANK résulte de la modulation de l’expression de RANK-L et RANK, respectivement sur les ostéoblastes et les pré-ostéoclastes, et d’un système de compétition. En effet, les ostéoblastes synthétisent et sécrètent une protéine, l’ostéoprotégérine (OPG), qui se fixe spécifiquement sur RANK-L sous sa forme soluble ou membranaire [ 17] et, par ce biais, inhibe de façon compétitive l’interaction RANK-L/RANK. Dans cette voie de différenciation des pré-ostéoclastes en ostéoclastes, les ostéoblastes jouent donc un rôle central en synthétisant le MCSF et RANK-L, tous deux nécessaires à l’activation des ostéoclastes, et l’OPG, qui permet l’inhibition de cette activation. Différenciation des pré-ostéoclastes en ostéoclastes inactifs par la voie du TNFα Elle se fait par interaction du TNFα avec ses récepteurs TNF-R1 (p55r) et TNF-R2 (p75r) présents à la surface de pré-ostéoclastes. Cette voie d’activation des ostéoclastes est totalement indépendante de la voie RANK-L/RANK, car elle n’est inhibée ni par l’OPG, ni par des anticorps anti-RANK ou anti-RANK-L [
18]. Le MCSF, synthétisé notamment par les ostéoblastes en réponse à l’IL-1, l’IL-6 ou le TNFα, est indispensable à la différenciation des pré-ostéoclastes [
19]. En revanche, sa présence en quantité trop importante dans le milieu semble paradoxalement inhiber la différenciation des ostéoclastes et favoriser la différenciation des macrophages [
20]. La concentration de MCSF dans le milieu semble donc être un facteur crucial dans la différenciation des ostéoclastes. Activation des ostéoclastes inactifs en ostéoclastes actifs Cette activation intervient de deux façons : soit par une interaction entre RANK-L (situé sur les ostéoblastes et les LT) et RANK (situé sur les ostéoclastes inactifs), ce qui entraîne un remaniement du réseau d’actine qui joue un rôle dans l’activation des ostéoclastes ; soit par une interaction entre l’IL-1 et son récepteur IL-1R, situé sur les ostéoclastes. Cette voie d’activation est totalement indépendante de la voie RANK-L/RANK, car elle n’est inhibée ni par l’OPG, ni par des anticorps anti-RANK ou anti-RANK-L. |
Voie directe d’activation des ostéoclastes par les LPS De nouvelles voies d’activation des ostéoclastes par les LPS ont été décrites plus récemment : les LPS peuvent agir directement sur certaines cellules, à certaines étapes de la voie indirecte, et entraîner l’activation des ostéoclastes indépendamment de toute sécrétion de cytokines pro-inflammatoires (Figure 2). Ces modes d’activation de l’ostéoclasie sont regroupés dans la voie directe d’activation des ostéoclastes. Les LPS induisent l’expression de RANK-L sur les ostéoblastes Kikuchi et ses collaborateurs ont montré que l’activation des récepteurs des LPS sur les ostéoblastes induit l’expression de RANK-L, et active ainsi l’ostéoclasie [ 12]. L’expression de RANK-L par les ostéoblastes permet la différenciation des pré-ostéoclastes par interaction RANK-L/RANK. L’activation des ostéoclastes se déroule ensuite comme dans la voie indirecte, soit par la voie IL-1/IL-1R, soit par interaction RANK-L/RANK. Les LPS induisent la différenciation des pré-ostéoclastes en ostéoclastes inactifs
In vitro, les LPS peuvent induire directement un certain nombre d’événements aboutissant à la différenciation des pré-ostéoclastes en ostéoclastes inactifs [
21]. L’activation des ostéoclastes inactifs peut ensuite se dérouler soit par la voie IL-1/IL-1R, soit par interaction RANK-L/RANK. Les ostéoclastes et leurs précurseurs exprimant le récepteur CD14/TLR4, on peut supposer que les LPS peuvent entraîner leur activation, mais cela n’a pas été démontré expérimentalement. |
Survie des ostéoclastes activés Les pré-ostéoclastes, comme les ostéoclastes en culture, meurent au bout de 24 heures en l’absence de stimulus de survie [
22]. Tani-Ishii et ses collaborateurs ont montré que l’IL-1α et le TNFα permettent la survie des ostéoclastes activés par un effet autocrine [
23]. Les ostéoclastes peuvent également être maintenus en survie grâce à l’interaction RANK-L/RANK [
24]. Enfin, l’interaction des LPS avec leurs récepteurs CD14/TLR4 situés à la surface des ostéoclastes induit également la survie des ostéoclastes activés [
25]. |
Régulation de l’ostéoclasie Dans la voie indirecte, l’activation de l’ostéoclasie est donc liée au phénomène inflammatoire, lui-même induit par la présence de LPS. La découverte plus récente de la voie directe, indépendante des phénomènes inflammatoires, a permis d’expliquer qu’une diminution de la synthèse des cytokines pro-inflammatoires ne permet pas toujours de diminuer la sévérité de la destruction osseuse. Effectivement, même en l’absence de ces cytokines, les ostéoclastes peuvent être activés et maintenus en survie grâce à l’action directe des LPS sur les ostéoblastes, les macrophages, les pré-ostéoclastes et les ostéoclastes. Chaque étape de l’activation de la destruction osseuse peut ainsi être induite par le contact des LPS sur ces différentes cellules et venir amplifier, indépendamment des cytokines pro-inflammatoires, l’activation de l’ostéoclasie par la voie indirecte. L’interaction RANK-L/RANK, le plus souvent par contact cellulaire entre un ostéoblaste ou un lymphocyte (qui expriment RANK-L à leur surface) avec un ostéoclaste ou l’un de ses précurseurs, joue un rôle essentiel dans l’activation de la destruction osseuse. En effet, l’expression de RANK-L, en présence de MCSF, est suffisante pour une différenciation complète des pré-ostéoclastes en ostéoclastes actifs [
26]. Une fois activés par des cytokines ou par des LPS, les ostéoblastes ou les lymphocytes Th1 permettent, par cette expression, le passage de chaque étape de l’activation de la destruction osseuse vers la suivante. L’OPG, en se liant à RANK-L et en inhibant par compétition l’interaction RANK-L/RANK, semble être un facteur clé dans la régulation de l’activation des ostéoclastes. La balance RANK-L/RANK/OPG oriente donc vers l’activation ou la répression de l’ostéoclasie. Cette protéine régulatrice est sécrétée par plusieurs types cellulaires, notamment par les ostéoblastes qui, en synthétisant en même temps RANK-L et son inhibiteur OPG, jouent un rôle central dans le contrôle de la régulation de l’ostéoclasie. Les lymphocytes T sont souvent décrits comme des cellules jouant un rôle important dans l’inhibition de la destruction osseuse, notamment grâce à la synthèse de cytokines anti-inflammatoires comme l’IL-4 ou l’IL-10 par les lymphocytes Th2. L’IL-4 inhibe la différenciation des LT4 vers le phénotype Th1 (impliqué dans l’activation de l’ostéoclasie) au profit du phénotype Th2 ; elle inhibe également la synthèse de PGE2 par les macrophages et les fibroblastes, et la synthèse de RANK-L induite par les cytokines pro-inflammatoires. Les LT4 Th1 stimulent également l’activation de l’ostéoclasie par l’intermédiaire de RANK-L [11]. En régulant positivement et négativement la destruction osseuse, les LT4 détiennent un rôle clé dans l’immunorégulation de l’ostéoclasie. |
La destruction de l’os lors d’une parodontite est donc la résultante d’un système complexe d’activation de l’ostéoclasie, faisant intervenir un processus inflammatoire, mais aussi une action directe des LPS sur les différents acteurs de cette activation. Des produits bactériens autres que les LPS, tels que les lipoprotéines, les peptidoglycanes, l’acide lipotéïchoïque ou le lipo-arabinomannane, peuvent induire la résorption osseuse par des mécanismes proches de ceux induits par les LPS [
27]. L’action de ces produits bactériens semble liée à l’activation des récepteurs TLR2/CD14, et non TLR4/CD14. Une meilleure compréhension de tous ces mécanismes devrait permettre d’envisager un découplage des interactions ostéo-immunologiques, permettant ainsi au système immunitaire de lutter contre l’infection sans provoquer de destruction osseuse associée. |
Footnotes |
1. Tanner A, Kent R, Maiden MF, Taubman MA. Clinical, microbiological and immunological profile of healthy, gingivitis and putative active periodontal subjects. J Periodontal Res 1996; 31 : 195–204. 2. Schletter J, Heine H, Ulmer AJ, Rietschel ET. Molecular mechanisms of endotoxin activity. Arch Microbiol 1995; 164 : 383–9. 3. Ulevitch RJ, Tobias PS. Receptor-dependent mechanisms of cell stimulation by bacterial endotoxin. Annu Rev Immunol 1995; 13 : 437–57. 4. Chaudhary PM, Ferguson C, Nguyen V, et al. Cloning and characterization of two Toll/Interleukin-1 receptor-like genes TIL3 and TIL4 : evidence for a multi-gene receptor family in humans. Blood 1998; 91 : 4020–7. 5. Chow JC, Young DW, Golenbock DT, et al. Toll-like receptor-4 mediates lipopolysaccharide-induced signal transduction. J Biol Chem 1999; 274 : 10689–92. 6. Nagasawa T, Kobayashi H, Kiji M, et al. LPS-stimulated human gingival fibroblasts inhibit the differentiation of monocytes into osteoclasts through the production of osteoprotegerin. Clin Exp Immunol 2002; 130 : 338–44. 7. Baker PJ, Dixon M, Evans RT, et al. CD4+ T cells and the proinflammatory cytokines gamma interferon and interleukin-6 contribute to alveolar bone loss in mice. Infect Immun 1999; 67 : 2804–9. 8. Matsuki Y, Yamamoto T, Hara K. Interleukin-1 mRNA-expressing macrophages in human chronically inflamed gingival tissues. Am J Pathol 1991; 138 : 1299–305. 9. Pinner RW, Teutsch SM, Simonsen L, et al. Trends in infectious diseases mortality in the United States. JAMA 1996; 275 : 189–93. 10. Kikuchi T, Matsuguchi T, Tsuboi N, et al. Gene expression of osteoclast differentiation factor is induced by lipopolysaccharide in mouse osteoblasts via Toll-like receptors. J Immunol 2001; 166 : 3574–9. 11. Kong YY, Boyle WJ, Penninger JM. Osteoprotegerin ligand : a common link between osteoclastogenesis, lymph node formation and lymphocyte development. Immunol Cell Biol 1999; 77 : 188–93. 12. Kawai T, Eisen-Lev R, Seki M, et al. Requirement of B7 costimulation for Th1-mediated inflammatory bone resorption in experimental periodontal disease. J Immunol 2000; 164 : 2102–9. 13. Josien R, Wong BR, Li HL, et al. TRANCE, a TNF family member, is differentially expressed on T cell subsets and induces cytokine production in dendritic cells. J Immunol 1999; 162 : 2562–8. 14. Taubman MA, Kawai T. Involvement of T-lymphocytes in periodontal disease and in direct and indirect induction of bone resorption. Crit Rev Oral Biol Med 2001; 12 : 125–35. 15. Verhasselt V, Buelens C, Willems F, et al. Bacterial lipopolysaccharide stimulates the production of cytokines and the expression of costimulatory molecules by human peripheral blood dendritic cells : evidence for a soluble CD14-dependent pathway. J Immunol 1997; 158 : 2919–25. 16. Bell. RANK Ligand and the regulation of skeletal remodeling. J Clin Invest 2003; 111 : 1120–2 17. Yasuda H, Shima N, Nakagawa N, et al. Osteoclast differentiation factor is a ligand for osteoprotegerin/osteoclastogenesis-inhibitory factor and is identical to TRANCE/RANKL. Proc Natl Acad Sci USA 1998; 95 : 3597–602. 18. Kobayashi K, Takahashi N, Jimi E, et al. Tumor necrosis factor alpha stimulates osteoclast differentiation by a mechanism independent of the ODF/RANKL-RANK interaction. J Exp Med 2000; 191 : 275–86. 19. Hofbauer LC, Lacey DL, Dunstan CR, et al. Interleukin-1beta and tumor necrosis factor-alpha, but not interleukin-6, stimulate osteoprotegerin ligand gene expression in human osteoblastic cells. Bone 1999; 25 : 255–9. 20. Perkins SL, Kling SJ. Local concentrations of macrophage colony-stimulating factor mediate osteoclastic differentiation. Am J Physiol 1995; 269 : E1024–30. 21. Zou W, Bar-Shavit Z. Dual modulation of osteoclast differentiation by lipopolysaccharide. J Bone Miner Res 2002; 17 : 1211–8. 22. Takami M, Woo JT, Nagai K. Requirement of osteoblastic cells for the fusion of osteoclasts. J Bone Miner Metab 1998; 16 : 151–7. 23. Tani-Ishii N, Tsunoda A, Teranaka T, Umemoto T. Autocrine regulation of osteoclast formation and bone resorption by IL-1 alpha and TNF alpha. J Dent Res 1999; 78 : 1617–23. 24. Jimi E, Akiyama S, Tsurukai T, et al. Osteoclast differentiation factor acts as a multifunctional regulator in murine osteoclast differentiation and function. J Immunol 1999; 163 : 434–42. 25. Itoh K, Udagawa N, Kobayashi K, et al. Lipopolysaccharide promotes the survival of osteoclasts via Toll-like receptor 4, but cytokine production of osteoclasts in response to lipopolysaccharide is different from that of macrophages. J Immunol 2003; 170 : 3688–95. 26. Lacey DL, Timms E, Tan HL, et al. Osteoprotegerin ligand is a cytokine that regulates osteoclast differentiation and activation. Cell 1998; 93 : 165–76 27. Takeuchi O, Hoshino K, Kawai T, et al. Differential roles of TLR2 and TLR4 in recognition of gram-negative and gram-positive bacterial cell wall components. Immunity 1999; 11 : 443–51. |