| |
| Med Sci (Paris). 2006 June; 22(6-7): 633–638. Published online 2006 June 15. doi: 10.1051/medsci/20062267633.Les protéines FXYD : nouveaux régulateurs de la Na,K-ATPase Benjamin Delprat, Stéphanie Bibert, and Käthi Geering* Département de Pharmacologie et Toxicologie, Université de Lausanne, rue du Bugnon 27, 1005 Lausanne, Suisse |
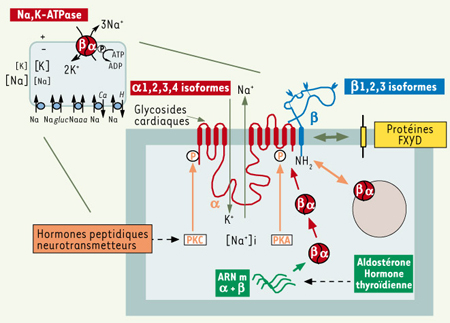
La Na,K-ATPase située dans la membrane plasmique utilise l’énergie de l’hydrolyse de l’ATP pour transporter trois ions Na+ en dehors de la cellule contre deux ions K+
(Figure 1). La Na,K-ATPase est une protéine oligomérique. La sous-unité αcatalytique, constituée de 10 segments transmembranaires, transporte les cations, hydrolyse l’ATP et est le récepteur pharmacologique des glycosides cardiaques [
1]. La sous-unité β, chaperon moléculaire, permet l’insertion membranaire correcte de la sous-unité α pendant sa synthèse et module ses propriétés de transport [
2]. Quatre isoformes α et trois isoformes β, dont l’expression est tissu spécifique, peuvent potentiellement former 12 isozymes différentes possédant des propriétés de transport et pharmacologiques distinctes [
3].  | Figure 1.
Structure et régulation de la Na,K-ATPase. La Na,K-ATPase est une protéine ubiquitaire qui transporte deux ions K+ dans la cellule en échange de trois ions Na+ en utilisant l’énergie de l’hydrolyse de l’ATP. La Na,K-ATPase maintient les gradients de Na+ et de K+ entre le milieu extra et intracellulaire. Le gradient de Na+ produit l’énergie pour l’activité de transporteurs secondaires nécessaires à l’homéostasie cellulaire. La Na,K-ATPase est composée d’une sous-unité α avec 10 segments transmembranaires et d’une sous-unité β. La sous-unité α est la sous-unité catalytique qui hydrolyse l’ATP, transporte les cations et lie les glycosides cardiaques. La sous-unité β est une glycoprotéine qui a une fonction de chaperon moléculaire pour l’insertion de la sous-unité α dans la membrane. Quatre isoformes α et 3 isoformes β sont exprimées de façon tissu-spécifique et peuvent former 12 différentes Na,K-ATPase isozymes avec des propriétés de transport différentes. L’expression de la Na,K-ATPase à la surface cellulaire est régulée par des neurotransmetteurs ou des hormones peptidiques qui activent la protéine kinase A (PKA) ou la protéine kinase C (PKC). La Na,K-ATPase est phosphorylée, ce qui module la distribution de la Na,K-ATPase entre la membrane plasmique et des compartiments intracellulaires. Par ailleurs, l’aldostérone et l’hormone thyroidienne influencent la transcription des gènes codant pour la sous-unité α et β et produisent une augmentation du nombre de Na,K-ATPase à la surface cellulaire. Enfin, l’activité de transport de la Na,K-ATPase est modulée de façon tissu-spécifique par l’interaction avec des membres de la famille des protéines FXYD. gluc : glucose ; aa : acide aminé. |
La Na,K-ATPase est le système de transport responsable du maintien des gradients Na+ et K+ à travers la membrane plasmique. Ces gradients sont essentiels pour maintenir le volume de la cellule et le potentiel de membrane. De plus, le gradient de Na+ fournit l’énergie nécessaire pour l’activité des systèmes de transports secondaires qui approvisionnent la cellule en nutriments et régulent le pH et la concentration de Ca2+ intracellulaire. La Na,K-ATPase est présente dans tous les types cellulaires pour assurer l’homéostasie cellulaire de base, mais contribue aussi aux fonctions des tissus spécialisés. Dans les cellules musculaires, l’activité de la Na,K-ATPase est étroitement couplée à l’activité de l’échangeur Na/Ca et favorise ainsi la contraction du cœur et des muscles squelettiques. La présence de la Na,K-ATPase dans les neurones et dans les cellules gliales permet la reconstitution des gradients Na+ et K+ pendant l’activité neuronale et assure ainsi l’excitabilité neuronale. Dans le rein, la Na,K-ATPase, exclusivement localisée dans la membrane basolatérale des cellules épithéliales, devient la force motrice de la réabsorption du Na+, essentielle au maintien du volume extracellulaire et de la pression sanguine. De nombreux mécanismes sont impliqués dans la régulation de la Na,K-ATPase pour adapter son activité et/ou son expression à divers stimulUS comme la propagation de l’influx nerveux, les exercices physiques et les changements diététiques en Na+ et K+
(Figure 1). La concentration intracellulaire de Na+ étant le facteur limitant pour la fonction de la Na,K-ATPase, toute modification de cette concentration affecte le taux de transport de la Na,K-ATPase. Par ailleurs, des hormones peptidiques ou des neurotransmetteurs peuvent induire une phosphorylation de la Na,K-ATPase par des protéine kinases qui vont moduler son expression à la surface de la cellule. Enfin, les hormones stéroïdiennes, comme l’aldostérone, affectent la transcription des gènes des sous-unités α et β, entraînant un accroissement du nombre de Na,K-ATPase [
4]. Une régulation inappropriée de la Na,K-ATPase a été corrélée avec diverses affections, incluant des troubles cardiovasculaires, neurologiques, rénaux et des maladies métaboliques. Cependant, aucun lien direct n’a véritablement été établi entre l’altération de la fonction de la pompe et un défaut de régulation. Récemment, plusieurs études ont révélé un nouveau mode de régulation impliquant l’interaction de la Na,K-ATPase avec de petites protéines membranaires de la famille de protéines FXYD. Contrairement aux régulations hormonales, ces protéines FXYD n’influencent pas l’expression de la Na,K-ATPase mais modifient plutôt ses propriétés de transport d’une manière tissu et isoforme spécifique. |
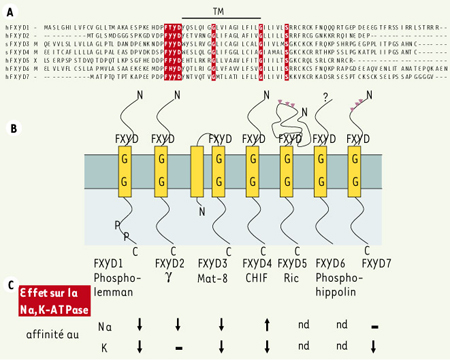
La famille de protéines FXYD La famille de protéines FXYD est formée de petites protéines membranaires caractérisées par une signature contenant le motif FXYD, deux glycines et une sérine conservées [
5] (Figure 2). Chez les mammifères, cette famille comporte sept membres incluant FXYD1 (ou phospholemman) [
6], FXYD2 (ou sous-unité γ de la Na, K-ATPase) [
7], FXYD3 (ou mammary tumor marker Mat-8) [
8], FXYD4 (ou corticosteroid hormone induced factor CHIF) [
9], FXYD5 (related to ion channel RIC ou dysadhérine) [
10], FXYD6 (ou phosphohippolin) [
11] et FXYD7 [
12]. FXYD1 [6], FXYD2 [
13], FXYD4 [
14] et FXYD7 [12] ont un seul segment transmembranaire et la partie carboxyterminale est dirigée vers le cytoplasme.  | Figure 2.
Les protéines FXYD. A. Alignement de séquences des sept membres de la famille des protéines FXYD. Le segment transmembranaire (TM) est indiqué et les acides aminés conservés sont mis en évidence. Le côté aminoterminal de FXYD5 est incomplet et représenté par un X.B. Toutes les protéines FXYD étudiées ont un segment transmembranaire et exposent le côté aminoterminal vers le côté extracellulaire excepté FXYD3 de souris qui a deux segments transmembranaires. Les positions des acides aminés conservés sont schématisées ainsi que les sites de phosphorylation (P) dans FXYD1 et les sites de O-glycosylation (triangles) dans FXYD5 et FXYD7. C. Les protéines FXYD modulent de façon différentielle l’affinité au Na+ et/ou au K+ de la Na,K-ATPase. nd : non déterminé (pour plus de détails, voir texte). |
Longtemps, la fonction des protéines FXYD est restée inconnue. Puisque FXYD1 [
15], FXYD3 [8], FXYD4 [9] et FXYD5 [10] induisent des conductances ioniques spécifiques après injection dans des ovocytes de Xénope, il a été spéculé que les protéines FXYD pourraient être des canaux ioniques ou des régulateurs de canaux ioniques. La signification physiologique de ces observations reste cependant incertaine puisque l’induction de ces conductances ioniques a souvent été observée dans des conditions non physiologiques. Récemment, plusieurs études ont montré que six des sept protéines FXYD interagissent avec la Na,K-ATPase et modulent sa fonction (Figure 2). Dans cet article, nous présentons et discutons les études les plus récentes qui supportent le fait que les protéines FXYD sont des sous-unités auxiliaires tissu spécifique de la Na,K-ATPase, sans pour autant exclure d’autres rôles additionnels. Pour plus d’informations, les lecteurs sont invités à lire également les revues suivantes [
16–
19]. |
FXYD1 est principalement exprimée dans le cœur, le foie et le muscle squelettique [6]. L’expression de FXYD1 dans des ovocytes de xénope ou l’addition de FXYD1 dans des bicouches membranaires planes induit une conductance sélective au chlore, activée par une hyperpolarisation [
20]. De plus, FXYD1 transporte sélectivement l’acide aminé zwitterionique taurine, un osmolyte des cellules animales [20]. Récemment, la mise en évidence de l’interaction de FXYD1 avec la Na,K-ATPase ajoute une perspective nouvelle au rôle physiologique potentiel de FXYD1. En effet, après expression dans des ovocytes de xénope, FXYD1 diminue l’affinité apparente au Na+ et, à un degré moindre, l’affinité apparente au K+ de la Na,K-ATPase [
21]. Dans les tissus contractiles, la diminution de l’affinité au Na+ de la Na,K-ATPase pourrait permettre à celle-ci de fonctionner à activité maximale même après l’augmentation de la concentration intracellulaire de Na+ pendant les potentiels d’action. Cela contribuerait à l’extrusion efficace du Na+ et contrôlerait une contraction musculaire appropriée. Le rôle physiologique de FXYD1 a été étudié à partir de souris déficientes en FXYD1 [
22]. Ces souris montrent une augmentation de la fraction éjectée, une augmentation de la masse cardiaque sans hypertension et une réduction significative de l’activité intrinsèque de la Na,K-ATPase. Ces résultats suggèrent que FXYD1 module la Na,K-ATPase et que l’absence d’expression de FXYD1 réduit l’activité de la Na,K-ATPase, conduisant à des réponses compensatoires. Le mécanisme par lequel FXYD1 influence la Na,K-ATPase in situ dans les tissus natifs reste indéterminé. Les résultats obtenus avec les souris déficientes pour FXYD1 suggèrent que FXYD1 stimule plutôt qu’inhibe la Na,K-ATPase. Aucune différence n’a été vue dans l’affinité apparente au Na+ de la Na,K-ATPase entre les souris sauvages et mutantes, contrairement à la diminution précédemment décrite de l’affinité au Na+ de la Na,K-ATPase par FXYD1 observée dans les ovocytes de xénope [21]. Des expériences récentes indiquent que FXYD1 s’associe non seulement avec la Na,K-ATPase, mais aussi avec l’échangeur Na/Ca. FXYD1 colocalise avec l’échangeur Na/Ca et des expériences de co-immunoprécipitation suggèrent une interaction directe entre les deux protéines [
23]. De plus, la surexpression de FXYD1 dans des myocytes a été corrélée à l’inhibition de l’échangeur Na/Ca et la sous-expression de FXYD1 à une augmentation de la fonction de celui-ci [23]. Puisque la Na,K-ATPase, l’échangeur Na/Ca et FXYD1 co-localisent dans les tubules transverses des cardiomyocytes et que les isozymes α1 et α2 de la Na,K-ATPase interagissent avec l’échangeur Na/Ca, l’importance relative de la Na,K-ATPase ou de l’échangeur Na/Ca, ou peut-être d’autres protéines, sur les effets fonctionnels des souris déficientes pour FXYD1, restent à élucider. FXYD1 étant considérée comme le substrat majeur de la protéine kinase A (PKA) dans le cœur, la phosphorylation pourrait être un des facteurs régulant les diverses fonctions potentielles de FXYD1. |
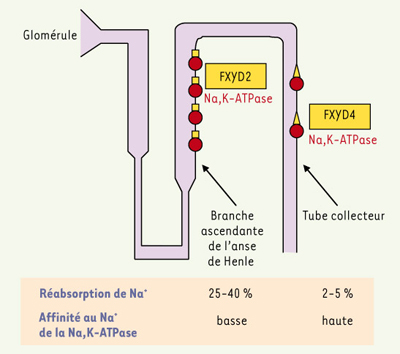
FXYD2 (sous-unité γ de la Na,K-ATPase) Deux variants d’épissage FXYD2a et FXYD2b (γa et γb) ont été identifiés, qui diffèrent seulement dans leur extrême partie aminoterminale [
24]. FXYD2 est exprimée principalement dans le rein avec une distribution segment spécifique de FXYD2a et FXYD2b [
25]. FXYD2a et FXYD2b colocalisent avec la Na,K-ATPase dans la membrane basolatérale de certaines cellules épithéliales rénales. Aucune FXYD2 n’a été détectée dans le tube collecteur [25]. Dans le rein, les deux variants sont exprimés dans le tubule proximal et, à un niveau supérieur, dans la branche large ascendante de l’anse de Henle (siège d’une réabsorption de sodium notable et dont le nombre de Na,K-ATPase par cellule est extrêmement élevé). La forme 2a est également présente au niveau de la macula densa (sensor de la concentration en NaCl du fluide tubulaire issu de l’anse de Henle) et dans la partie initiale du néphron distal. Diverses approches expérimentales suggèrent que FXYD2 pourrait avoir plusieurs effets concomitants et indépendants sur la fonction de la Na,K-ATPase. FXYD2 module l’affinité apparente au K+, au Na+ et à l’ATP de la Na,K-ATPase [14, 25–
27]. La pertinence de la modulation de la Na,K-ATPase par FXYD2 dans le rein reste spéculative. Les FXYD2 sont principalement distribuées dans les segments rénaux qui absorbent la plupart du Na+ filtré (Figure 3). Puisqu’ un effet majeur de FXYD2 semble être une diminution dans l’affinité au Na+ de la Na,K-ATPase, nous pouvons envisager que l’existence d’une Na,K-ATPase à faible affinité au Na+ puisse être favorable à une réabsorption efficace du Na+ dans les segments rénaux à forte capacité de transport de sodium (et donc susceptibles d’être confrontés à des concentrations de sodium transitoirement élevées). De manière significative, la Na,K-ATPase rénale des souris déficientes en FXYD2 présente une augmentation de l’affinité apparente au Na+ [
28], confirmant l’effet sodique de FXYD2 observé dans différents systèmes d’expression. Pourtant, les souris déficientes pour FXYD2 ne montrent aucun défaut de la fonction rénale, suggérant des mécanismes compensatoires qui permettent une excrétion normale de Na+. 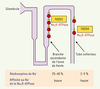 | Figure 3.
La distribution et l’effet fonctionnel de FXYD2 et FXYD4 dans le néphron. La Na,K-ATPase (cercles rouges) située dans la membrane basolatérale des cellules épithéliales du néphron colocalise avec FXYD2 (carrés jaunes) dans la branche ascendante de l’anse de Henle et avec FXYD4 (triangles jaunes) dans le tube collecteur. Une faible affinité au Na+ de la Na,K-ATPase, induite par l’association de FXYD2, favorise une réabsorption efficace de Na+ dans la branche ascendante de l’anse de Henle qui réabsorbe 25-40 % du Na+ filtré au glomérule. Une haute affinité au Na+ de la Na,K-ATPase, induite par l’association de FXYD4, favorise la réabsorption du Na+ dans le tube collecteur qui est le site final de la conservation des électrolytes. |
Une mutation dans une glycine conservée, située dans le domaine transmembranaire de FXYD2, a été liée à des cas d’hypomagnésémie primaire [
29]. Bien que les études sur l’effet de cette mutation aient révélé qu’elle abolit l’association des protéines FXYD avec la Na,K-ATPase, sans changement dans l’expression de la Na,K-ATPase à la surface de la cellule [
30,
31], d’autres expériences sont nécessaires pour élucider si ou comment cet effet peut être associé à la perte de Mg2+, l’augmentation de l’absorption de Ca2+ et l’hypocalciurie observées chez ces patients. |
FXYD3 est principalement exprimée dans l’utérus, l’estomac, le colon et la peau [8]. FXYD3 peut s’associer à la Na,K-ATPase et produire une diminution dans les affinités apparentes au Na+ et K+ de la Na,K-ATPase [
32]. En plus de ces fonctions partagées avec les autres protéines FXYD, FXYD3 présente quelques caractéristiques peu communes. Premièrement, contrairement aux autres FXYD, FXYD3 pourrait avoir deux domaines transmembranaires car son peptide signal n’est pas clivé. Deuxièmement, exprimée dans les ovocytes de xénope, FXYD3 peut s’associer non seulement avec la Na,K-ATPase, mais aussi avec la H,K-ATPase. Cependant, in situ (estomac), FXYD3 est exprimée seulement dans les cellules de la muqueuse qui n’expriment pas la H,K-ATPase. Enfin, après son expression dans les ovocytes de Xénope, FXYD3 module la maturation des glycoprotéines [32]. Actuellement, il est difficile de tirer une conclusion sur la signification physiologique des effets de FXYD3 sur l’affinité apparente au Na+ et K+ de la Na,K-ATPase. Il est à noter que FXYD3 est fortement surexprimée dans certains types de cancers comme les tumeurs mammaires [8] et de la prostate [
33]. Il reste à savoir si la régulation des propriétés fonctionnelles de la Na,K-ATPase, conduisant à des modifications du milieu cellulaire, est importante dans l’inhibition ou le déclenchement de la prolifération des cellules. Enfin, puisque FXYD3 est exprimée non seulement avec la Na,K-ATPase dans les membranes basolatérales, mais est aussi présente dans les membranes apicales des cellules de la muqueuse de l’estomac [32], nous ne pouvons exclure que FXYD3 n’est pas uniquement un modulateur de la Na,K-ATPase et qu’elle possède aussi d’autres fonctions inconnues. |
FXYD4 est exprimée dans le canal collecteur cortical, médullaire et papillaire du rein, et dans le colon distal [
34]. Des évidences récentes suggèrent que FXYD4 s’associe spécifiquement avec la Na,K-ATPase dans des systèmes d’expression et in situ, et module ses propriétés de transport [14,
35]. FXYD4 produit une élévation importante de l’affinité apparente au K+ de la Na,K-ATPase [14] ainsi qu’une augmentation de deux à trois fois dans l’affinité apparente au Na+ intracellulaire [14, 35]. Ce dernier effet de FXYD4 sur la Na,K-ATPase est susceptible d’avoir une pertinence physiologique dans la réabsorption du Na+ dans le canal collecteur qui est le site ultime de la conservation d’électrolytes (Figure 3). Une élévation dans l’affinité au Na+ de la Na,K-ATPase, produite par l’association avec FXYD4 dans ce segment rénal, permet la réabsorption efficace du Na+, même à des faibles concentrations intracellulaires de Na+. L’étude des souris knock out pour FXYD4 confirme au moins de manière partielle que l’effet majeur, si ce n’est unique, de FXYD4 est l’augmentation de l’affinité apparente au Na+ de la Na,K-ATPase. L’absence d’expression de FXYD4 semble être compensée dans le rein mais pas dans le colon distal. En effet, la réabsorption colique de Na+ est réduite, en particulier après traitement aux glucocorticoïdes et après une déplétion sodée [
36]. FXYD4 semble donc favoriser la capacité du côlon à absorber du sodium. |
En comparaison avec les autres protéines FXYD, FXYD5 possède une longue extension aminoterminale [5]. FXYD5 est exprimée dans le rein, l’intestin, la rate et le poumon [
37]. FXYD5 s’associe à la Na,K-ATPase et induit une augmentation de son activité de transport de plus de deux fois. Dans le rein, FXYD5 est non seulement exprimée dans la membrane basolatérale des cellules du tube collecteur, mais aussi dans la membrane apicale des cellules de la branche grêle de l’anse de Henle (épithélium jouant un rôle notable dans les mécanismes de concentration-dilution du rein) [37]. Cela suggère que Ric pourrait avoir des fonctions autres que la modulation de la Na,K-ATPase. Par ailleurs, il a été proposé que FXYD5 jouerait un rôle dans la régulation de la E-cadhérine et dans la formation de métastases [
38]. |
FXYD6 est exprimée dans différents tissus [5]. Dans le cerveau, l’étude de son expression pendant le développement suggère un rôle dans l’excitabilité neuronale du cerveau en développement et adulte [
39]. FXYD6 est peu caractérisée et une possible interaction avec la Na,K-ATPase n’a pas encore été rapportée. |
FXYD7 a été trouvée exclusivement dans le cerveau, dans les neurones et, à un degré moindre, dans les cellules gliales [12]. Après co-expression dans des ovocytes de xénope, FXYD7 s’associe avec les isozymes α1-β1, α2-β1 et α3-β1 mais pas avec les isozymes α-β2 de la Na,K-ATPase. Par ailleurs, dans le cerveau, FXYD7 s’associe exclusivement avec l’isoforme α1 de la Na,K-ATPase [12]. Ces données suggèrent que, dans le cerveau, FXYD7 est spécifiquement associée avec l’isozyme α1-β1 de la Na,K-ATPase. L’analyse électrophysiologique de l’effet modulateur de FXYD7 sur la Na,K-ATPase dans les ovocytes de xénope a révélé que FXYD7 module les propriétés de transport de l’isozyme α1-β1 de manière spécifique, distincte des autres FXYD. L’affinité apparente pour le K+ est augmentée tandis que l’affinité apparente pour le Na+ intracellulaire est inchangée [12]. On peut spéculer que, dans le cerveau, une faible affinité au K+ des isozymes α1-β1 de la Na,K-ATPase, acquise par l’association avec la FXYD7, pourrait être nécessaire à une recapture efficace du K+ extracellulaire pendant l’activité neuronale pour assurer l’excitabilité neuronale. |
Des études expérimentales récentes supportent fortement qu’au moins un rôle fonctionnel des protéines FXYD est la régulation de la Na,K-ATPase de manière tissu et isoforme spécifique. Bien que les effets fonctionnels des protéines FXYD sur le transport et les propriétés cinétiques de la Na,K-ATPase ont été bien caractérisés, il reste beaucoup à apprendre sur la pertinence physiologique de ces effets et sur l’implication potentielle de la perte de régulation par les protéines FXYD de la Na,K-ATPase dans des états physiopathologiques. Pour une meilleure compréhension de ces mécanismes, d’autres expériences sont nécessaires sur les rôles fonctionnels de chaque protéine FXYD, sur leur biosynthèse et leur maturation, leur distribution cellulaire et tissulaire et leurs relations structure-fonction. |
Ce travail a été soutenu par un subside No.3100A0-107513 du Fonds National Suisse de la Recherche Scientifique.
|
Footnotes |
1. Horisberger JD. Recent insights into the structure and mechanism of the sodium pump. Physiology (Bethesda) 2004; 19 : 377–87. 2. Geering K. The functional role of β subunits in oligomeric P-type ATPases. J Bioenerg Biomembr 2001; 33 : 425–38. 3. Crambert G, Hasler U, Beggah AT, et al. Transport and pharmacological properties of nine different human Na,K-ATPase isozymes. J Biol Chem 2000; 275 : 1976–86. 4. Feraille E, Doucet A. Sodium-potassium-adenosinetriphosphatase-dependent sodium transport in the kidney : hormonal control. Physiol Rev 2001; 81 : 345–418. 5. Sweadner KJ, Rael E. The FXYD gene family of small ion transport regulators or channels : cDNA sequence, protein signature sequence, and expression. Genomics 2000; 68 : 41–56. 6. Palmer CJ, Scott BT, Jones LR. Purification and complete sequence determination of the major plasma membrane substrate for cAMP-dependent protein kinase and protein kinase C in myocardium. J Biol Chem 1991; 266 : 11126–30. 7. Mercer RW, Biemesderfer D, Bliss DP, et al. Molecular cloning and immunological characterization of the γ-polypeptide, a small protein associated with the Na,K-ATPase. J Cell Biol 1993; 121 : 579–86. 8. Morrison BW, Moorman JR, Kowdley GC, et al. Mat-8, a novel phospholemman-like protein expressed in human breast tumors, induces a chloride conductance in Xenopus oocytes. J Biol Chem 1995; 270 : 2176–82. 9. Attali B, Latter H, Rachamim N, Garty H, A corticosteroid-induced gene expressing an “IsK-like” K+ channel activity in Xenopus oocytes. Proc Natl Acad Sci USA 1995; 92 : 6092–6. 10. Fu X, Kamps M. E2a-Pbx1 induces aberrant expression of tissue-specific and developmentally regulated genes when expressed in NIH 3T3 fibroblasts. Mol Cell Biol 1997; 17 : 1503–12. 11. Yamaguchi F, Yamaguchi K, Tai Y, et al. Molecular cloning and characterization of a novel phospholemman-like protein from rat hippocampus. Brain Res Mol Brain Res 2001; 86 : 189–92. 12. Béguin P, Crambert G, Monnet-Tschudi F, et al. FXYD7 is a brain-specific regulator of Na,K-ATPase α1-βisozymes. EMBO J 2002; 21 : 3264–73. 13. Béguin P, Wang XY, Firsov D, et al. The γ subunit is a specific component of the Na,K-ATPase and modulates its transport properties. EMBO J 1997; 16 : 4250–60. 14. Béguin P, Crambert G, Guennoun S, et al. CHIF, a member of the FXYD protein family, is a regulator of Na,K-ATPase distinct from the γ-subunit. EMBO J 2001; 20 : 3993–4002. 15. Moorman JR, Palmer CJ, John III JE, et al. Phospholemman expression induces a hyperpolarization-activated chloride current in Xenopus oocytes. J Biol Chem 1992; 267 : 14551–4. 16. Crambert G, Geering K. FXYD proteins : New tissue-specific regulators of the ubiquitous Na,K- ATPase. Sci STKE 2003; 166 : RE1. 17. Cornelius F, Mahmmoud YA. Functional modulation of the sodium pump : The regulatory proteins “Fixit”. News Physiol Sci 2003; 18 : 119–24. 18. Garty H, Karlish SJ. Role of FXYD proteins in ion transport. Annu Rev Physiol 2005; 25 : 25. 19. Therien AG, Pu HX, Karlish SJ, Blostein R. Molecular and functional studies of the gamma subunit of the sodium pump. J Bioenerg Biomembr 2001; 33 : 407–14. 20. Moorman JR, Ackerman SJ, Kowdley GC, et al. Unitary anion currents trough phospholemman channel molecules. Nature 1995; 377 : 737–40. 21. Crambert G, Fuzesi M, Garty H, et al. Phospholemman (FXYD1) associates with Na,K-ATPase and regulates its transport properties. Proc Natl Acad Sci USA 2002; 99 : 11476–81. 22. Jia LG, Donnet C, Bogaev RC, et al. Hypertrophy, increased ejection fraction, and reduced Na-K-ATPase activity in phospholemman-deficient mice. Am J Physiol Heart Circ Physiol 2005; 288 : H1982–8. 23. Mirza MA, Zhang X-Q, Ahlers BA, et al. Effects of phospholemman downregulation on contractility and [Ca2+]i transients in adult rat cardiac myocytes. Am J Physiol Heart Circ Physiol 2004; 286 : H1322–30. 24. Kuster B, Shainskaya A, Pu HX, et al. A new variant of the g subunit of renal Na,K-ATPase. Identification by mass spectrometry, antibody binding, and expression in cultured cells. J Biol Chem 2000; 275 : 18441–6. 25. Pu HX, Cluzeaud F, Goldshlegger R, et al. Functional role and immunocytochemical localization of the γa and γb forms of the Na,K-ATPase γ subunit. J Biol Chem 2001; 276 : 20370–8. 26. Therien AG, Goldshleger R, Karlish SJ, Blostein R. Tissue-specific distribution and modulatory role of the γ subunit of the Na,K-ATPase. J Biol Chem 1997; 272 : 32628–34. 27. Arystarkhova E, Wetzel RK, Asinovski NK, Sweadner KJ. The gamma subunit modulates Na+ and K+ affinity of the renal Na,K-ATPase. J Biol Chem 1999; 274 : 33183–5. 28. Jones DH, Li TY, Arystarkhova E, et al. Na,K-ATPase from mice lacking the γ subunit (FXYD2) exhibits altered Na+ affinity and decreased thermal stability. J Biol Chem 2005; 280 : 19003–11. 29. Meij IC, Koenderink JB, van Bokhoven H, et al. Dominant isolated renal magnesium loss is caused by misrouting of the Na+,K+-ATPase γ-subunit. Nat Genet 2000; 26 : 265–6. 30. Crambert G, Li C, Swee LK, Geering K. FXYD7 : Mapping of functional sites involved in endoplasmic reticulum export, association with and regulation of Na,K-ATPase. J Biol Chem 2004; 279 : 30888–95. 31. Pu HX, Scanzano R, Blostein R. Distinct regulatory effects of the Na,K-ATPase γ subunit. J Biol Chem 2002; 277 : 20270–6. 32. Crambert G, Li C, Claeys D, Geering K. FXYD3 (Mat-8), a new regulator of Na,K-ATPase. Mol Biol Cell 2005; 16 : 2363–71. 33. Grzmil M, Voigt S, Thelen P, et al. Up-regulated expression of the MAT-8 gene in prostate cancer and its siRNA-mediated inhibition of expression induces a decrease in proliferation of human prostate carcinoma cells. Int J Oncol 2004; 24 : 97–105. 34. Shi H, Levy-Holzman R, Cluzeaud F, et al. Membrane topology and immunolocalization of CHIF in kidney and intestine. Am J Physiol 2001; 280 : F505–12. 35. Garty H, Lindzen M, Scanzano R, et al. A functional interaction between CHIF and Na-K-ATPase : implication for regulation by FXYD proteins. Am J Physiol 2002; 283 : F607–15. 36. Goldschimdt I, Grahammer F, Warth R, et al. Kidney and colon electrolyte transport in CHIF knockout mice. Cell Physiol Biochem 2004; 14 : 113–20. 37. Lubarski I, Pihakaski-Maunsbach K, Karlish SJ, et al. Interaction with the Na, K ATPase and tissue distribution of FXYD5 (RIC). J Biol Chem 2005; 7 : 7. 38. Ino Y, Gotoh M, Sakamoto M, et al. Dysadherin, a cancer-associated cell membrane glycoprotein, down-regulates E-cadherin and promotes metastasis. PNAS 2002; 99 : 365–70. 39. Saito S, Matoba R, Kato K, Matsubara K. Expression of a novel member of the ATP1G1/PLM/MAT8 family, phospholemman-like protein (PLP) gene, in the developmental process of mouse cerebellum. Gene 2001; 279 : 149–55. |