Phénomène inévitable dans la vie de l’homme, le déclin hormonal lié à l’âge est un souci important de santé pour une grande proportion de la population masculine vieillissante (environ 30 % des hommes au-dessus de 60 ans ont un niveau de testostérone biodisponible bas) [ 1]. Le processus de vieillissement testiculaire s’accompagne d’une diminution de la concentration sérique et sanguine de testostérone, entraînant l’apparition d’ostéoporose, une réduction de la force musculaire et de la libido, et des changements d’humeur [ 2]. Cependant, la question reste entière : quels sont les mécanismes moléculaires fondamentaux qui conduisent au vieillissement testiculaire ?
Il a été démontré que le vieillissement testiculaire est associé à une augmentation du pourcentage de tubules séminifères dégénérés et à un épuisement des cellules germinales [ 3]. Pendant ce processus, l’accélération de la mort des cellules germinales est causée par un phénomène d’apoptose accru. Des agents cytotoxiques tels que les espèces réactives de l’oxygène (ROS) pourraient favoriser ce phénomène [ 4] et le processus de stéroïdogenèse lui-même est source de production de ROS [ 5, 6].
Chez le Rat Brun de Norvège, modèle très utilisé pour étudier le vieillissement testiculaire, le déclin de la production de testostérone chez les rats âgés s’accompagne d’une perte de fonction, mais pas du nombre, des cellules de Leydig [ 7], suggérant que la réduction de stéroïdogenèse au cours du vieillissement est le résultat de déficits de production de LH. Cependant, il a été démontré que, chez le rat et l’homme, les niveaux sériques de LH ne sont pas réduits au cours du vieillissement [7, 8]. Prises dans leur ensemble, ces observations suggèrent que l’absence de stimulation par la LH n’est pas suffisante pour expliquer pourquoi les cellules de Leydig deviennent hypofonctionelles au cours du vieillissement.
Notre groupe a très récemment démontré que l’absence de PACAP (pituitary adenylate cyclase-activating polypeptide), un neuropeptide fortement exprimé dans les testicules de rat [ 9] et connu pour stimuler la sécrétion de LH in vivo, conduit à un retard du vieillissement testiculaire chez les souris invalidées pour le gène PACAP [ 10]. De manière plus spécifique, les souris mutantes PACAP −/− âgées de 4 mois présentent un niveau de stéroïdogenèse réduit en comparaison avec les souris de type sauvage du même âge. Bien que le niveau de testostérone sérique des animaux PACAP −/− soit bas, la structure testiculaire n’est pas affectée et ces animaux sont fertiles puisqu’ils se reproduisent normalement au sein de notre colonie. Ce dysfonctionnement semble être d’origine mixte, à la fois au niveau testiculaire et pituitaire, étant donné que nous n’avons pas observé de différence quant aux niveaux sériques de gonadotrophines LH et FSH.
Chez les animaux âgés de 15 mois, le testicule de type sauvage présente les signes typiques du vieillissement (dégénérescence des tubules séminifères, épuisement des cellules germinales et présence de vacuolisations au sein des tubules séminifères), tandis que de manière surprenante, la structure testiculaire est conservée chez les animaux PACAP −/−. De plus, nous avons démontré que la perte des cellules germinales retrouvée chez les animaux de type sauvage est associée à une présence accrue des péroxynitrites, marqueurs des ROS, et à un nombre plus élevé de cellules apoptotiques comparé aux souris PACAP −/−. Nous avons également pu partiellement inverser le phénotype testiculaire par injection intrapéritonéale de PACAP à des souris PACAP −/−. De cette manière, nous avons démontré que les niveaux des protéines StAR et P450c17, deux facteurs majeurs de la voie de biosynthèse de testostérone, sont augmentés après ces injections.
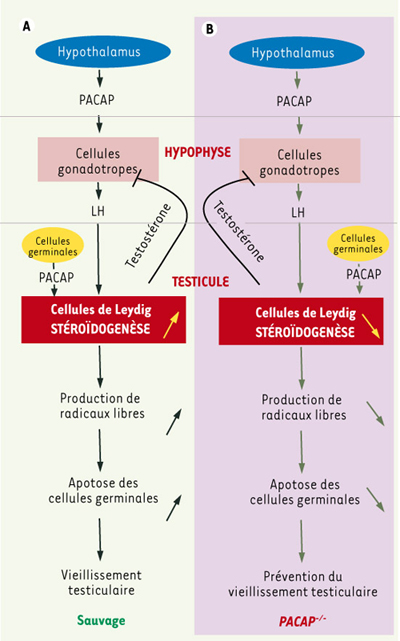
Nos observations suggèrent que le vieillissement testiculaire est retardé chez les souris PACAP −/−. Puisque les niveaux d’expression des molécules marqueurs de la stéroïdogenèse sont bas et constants tout au long de la vie des animaux PACAP −/−, un mécanisme proposé pour expliquer la protection contre la dégénérescence testiculaire est que la production des ROS, sous-produits de la stéroïdogenèse, est diminuée chez les souris PACAP −/− (voir modèle dans la Figure 1).
| Figure 1.
Modèle hypothétique du possible mécanisme moléculaire menant à la prévention du vieillissement testiculaire chez les souris PACAP−/−. Chez les animaux de type sauvage (A), le PACAP, produit par l’hypothalamus, stimule la libération de LH au niveau pituitaire. Au niveau testiculaire, le PACAP est synthétisé par les cellules germinales, et avec la LH, stimule la biosynthèse de testostérone. Ce phénomène conduit à la production de radicaux libres, lesquels induisent l’apoptose des cellules germinales et le vieillissement testiculaire. Chez les souris PACAP−/−
(B) la biosynthèse de testostérone par les cellules de Leydig est réduite. En conséquence, la production de radicaux libres est diminuée et l’apoptose des cellules germinales inhibée. Finalement, ce mécanisme conduit à une prévention du vieillissement testiculaire. |
Qu’en est-il des applications thérapeutiques potentielles et de la possibilité de mettre un frein au vieillissement testiculaire ? À en croire nos résultats, le simple fait de diminuer la stéroïdogenèse testiculaire, pendant une période de temps suffisamment longue, suffirait à retarder le processus de vieillissement. Supprimer l’action du produit du gène PACAP, par voie chimique par exemple, n’est pas impossible, mais ce n’est probablement pas la meilleure stratégie car ce peptide est exprimé de façon ubiquitaire dans l’organisme. De nombreux effets secondaires seraient à craindre.
Parallèlement, une autre étude [7] indique que si des implants de testostérone sont administrés à des rats pendant une période de temps suffisamment longue (8 mois), la stéroïdogenèse testiculaire est diminuée suite au rétrocontrôle négatif exercé par la testostérone au niveau pituitaire, et le vieillissement des cellules de Leydig est retardé. Il est alors possible d’imaginer que l’administration de testostérone puisse, par le biais d’un blocage de la stéroïdogenèse, conduire à un retard du vieillissement testiculaire.