La trypanosomiase africaine humaine, ou maladie du sommeil, résulte d’une infection par des protozoaires parasites appelés trypanosomes, qui sont transmis d’hôte à hôte par des glossines hématophages généralement dénommées mouches tsé-tsé. La sous-espèce Trypanosoma brucei rhodesiense est responsable d’une forme aiguë de la maladie en Afrique de l’Est. Cette maladie est fatale si elle n’est pas traitée à temps. Les trypanosomes échappent au système immunitaire de l’hôte grâce à un mécanisme sophistiqué de variation antigénique [ 1] qui leur permet de changer continuellement l’antigène majeur, le VSG (variant surface glycoprotein), qui couvre la totalité de leur surface. Ce processus de variation laisse peu d’espoir d’éliminer le parasite par vaccination. Par ailleurs, les médicaments actuels, suramine et mélarsoprol, sont toxiques et peu efficaces étant donné l’acquisition de résistance par le parasite [ 2]. Par conséquent, le développement de nouveaux médicaments, plus spécifiques et moins toxiques, est nécessaire.
On sait depuis longtemps que le sérum humain normal tue la plupart des trypanosomes, à l’exception de ceux responsables de la maladie du sommeil. Dans le cas de T. b. rhodesiense, la résistance à la lyse par le sérum humain est due à une seule protéine appelée SRA (serum resistance-associated) [ 3]. Cette protéine interagit fortement et spécifiquement avec une lipoprotéine appelée apolipoprotéine L-I (APOL1), qui s’est révélée être le facteur trypanolytique du sérum humain [ 4]. L’APOL1 contient trois domaines, un domaine formateur de pores ioniques similaire à celui des colicines bactériennes, un domaine dont la structure est sensible au pH et qui est capable d’installer la protéine dans diverses membranes biologiques, et enfin un domaine interactif carboxy-terminal, qui est reconnu par SRA (pour revue récente, voir [ 5]). Cette lipoprotéine, qui est associée à une sous-fraction des HDL, est capturée par endocytose par le trypanosome. En raison de l’acidification consécutive au processus de digestion, un changement conformationnel permet à l’APOL1 de se détacher des particules d’HDL et de s’insérer dans la membrane lysosomiale où l’activité formatrice de pores entraîne un flux irréversible d’ions chlorure du cytoplasme vers le lysosome. Le flux ionique, associé à un passage d’eau, provoque un gonflement osmotique incontrôlable de la vacuole digestive, entraînant la mort du parasite [5]. Seuls les domaines formateurs de pores et d’adressage membranaire sont nécessaires à l’activité trypanolytique de l’APOL1. Par conséquent, la lipoprotéine dépourvue du domaine interagissant avec SRA (Tr-APOL1) est toujours trypanolytique et, surtout, devient capable de tuer également T. b. rhodesiense car elle n’est plus neutralisable par SRA [4].
Tr-APOL1 représente donc un nouveau médicament actif contre la trypanosomiase humaine, à condition que la compétition avec l’APOL1 endogène (10 µg/ml) soit évitée. Cela requiert le ciblage sélectif de Tr-APOL1 sur le parasite.
Les nanocorps (Nb, nanobodies) sont des polypeptides à simple domaine dérivés d’anticorps propres aux camélidés (chameaux, lamas), qui sont capables de se fixer sur des antigènes avec une haute affinité [ 6, 7]. Étant donné leur petite taille (13 kDa) par rapport au Fab, le domaine équivalent des anticorps classiques (55 kDa), et leur comportement strictement monomérique, ces polypeptides représentent des outils idéaux pour cibler la surface du parasite. Des nanocorps reconnaissant spécifiquement cette surface ont été sélectionnés par immunisation de chameaux avec des préparations purifiées d’antigènes de T. brucei, et criblage des anticorps de ces chameaux par expression de bibliothèques d’ADNc sous forme d’affichage en phage display confronté à des VSG de différents clones et sous-espèces de T. brucei. Le critère de sélection était la reconnaissance d’épitopes invariants. En effet, étant donné leur petite taille, les nanocorps peuvent détecter des épitopes qui sont cryptiques pour les anticorps conventionnels, ou même pour les fragments Fab dérivés de ces anticorps, et qui seraient conservés indépendamment de la variation antigénique. C’est ainsi qu’un nanocorps, désigné NbAn33, fut sélectionné sur la base de sa reconnaissance d’un épitope constant de VSG [ 8] (Figure 1A). NbAn33 reconnaît spécifiquement le radical oligomannose, car il s’attache à des résidus Man9 et Man7 synthétiques, se fixe de façon indifférente à divers VSG qui ne partagent que le radical Man5-9 attaché à une asparagine, et ne reconnaît plus le VSG dépourvu de ce radical. Par conséquent, NbAn33 a été utilisé pour la production de différentes chimères Nb-Tr-APOL1 [ 9]. Un conjugué dont le nanocorps était espacé de Tr-APOL1 par la charnière naturelle d’anticorps γ2c de lama (Figure 1B), s’est révélé capable de se fixer spécifiquement à la surface du trypanosome, sans reconnaître de façon détectable différentes cellules de l’hôte comme les globules rouges ou des suspensions cellulaires de foie, de nodules lymphoïdes ou de rate de souris infectées. In vitro, NbAn33-Tr-APOL1 a manifesté une activité trypanolytique très supérieure à celle d’un conjugué contrôle, où le nanocorps utilisé (NbCEA5) reconnaissait un épitope absent de la surface du parasite. In vivo, NbAn33-Tr-APOL1 s’est révélé capable de guérir la trypanosomiase expérimentale chez la souris. Des souris infectées avec des souches virulentes de T. b. rhodesiense, puis traitées par une seule injection intrapéritonéale de NbAn33-Tr-APOL1, sont débarrassées complètement et durablement du parasite sans manifester de symptômes liés au traitement (Figure 2). Des résultats similaires furent observés dans des modèles d’infection plus chronique (trypanosomes pléomorphes, capables de se différencier en formes quiescentes appelées short stumpy). Dans ce cas, l’injection intrapéritonéale de NbAn33-Tr-APOL1 - après (plutôt qu’avant) le premier pic de parasitémie - a permis d’éliminer les parasites pour une longue période, mais l’infection a repris en raison de la survie de parasites dans le foie. La période sans parasites fut néanmoins totalement débarrassée des signes pathologiques liés à l’infection, comme l’anémie, la perte de poids corporel, le gonflement de la rate, les lésions hépatiques et la perte d’activité locomotrice.
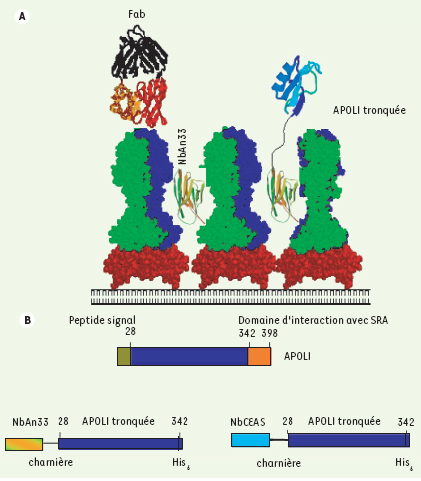
| Figure 1.
A. La surface du trypanosome est couverte par un manteau dense et variable de VSG, rendant les épitopes invariables sous-jacents inaccessibles pour de grandes molécules telles que le fragment Fab des anticorps classiques, présents chez la majorité des vertébrés. Les nanocorps de chameaux, tels que NbAn33, même couplés à une molécule toxique, peuvent atteindre le radical oligomannose présent chez différents VSG. B. La protéine SRA, qui interagit avec le domaine carboxy-terminal du facteur trypanolytique humain, l’APOL1, rend T. b. rhodesiense résistant au sérum humain. L’APOL1 tronquée, dépourvue de domaine interagissant avec SRA, a été fusionnée avec NbAN33 ou avec un nanocorps contrôle (NbCEA5). |
| Figure 2.
Des souris infectées par T.b. rhodesiense ont été traitées au jour 3 par injection intrapéritonéale (flèche) de NbAn33-Tr-APOL1 (courbe bleue) ou de NbCEA5-Tr-APOL1 (courbe rouge). Le ciblage spécifique de l’APOL1 tronquée via le nanocorps élimine les parasites, et les souris survivent au moins jusqu’à la fin de l’expérience, tandis qu’à la dose utilisée l’APOL1 non ciblée ne bloque pas l’infection. |
En conclusion, la version tronquée de l’APOL1 combinée à un nanocorps capable de cibler la surface du parasite constitue une nouvelle molécule trypanocide potentiellement utilisable pour traiter la maladie du sommeil humaine, soit seule, soit en combinaison avec des doses sous-curatives d’autres médicaments. On peut s’attendre à ce que NbAn33-Tr-APOL1 n’induise pas ou peu de réponse immunitaire humorale chez l’homme, car l’APOL1 est un antigène naturel humain, et la séquence des nanocorps est très semblable à celle de domaines variables d’immunoglobulines humaines. Si nécessaire, cette séquence pourrait d’ailleurs être « humanisée » davantage [ 10]. D’autres développements sont possibles, car la substitution de NbAn33 par NbES31, un nanocorps dirigé contre la sous-unité ESAG6 du récepteur trypanosomal de la transferrine, s’est révélée aussi efficace pour éliminer les trypanosomes chez des souris infectées. Enfin, il n’y a aucune raison que la stratégie de ciblage grâce à des nanocorps ne puisse être appliquée à d’autres agents infectieux, en fonction de la disponibilité de nanocorps spécifiques et de molécules naturelles de défense de l’hôte.