Au cours de ces dernières années, le statut du tissu adipeux blanc a évolué, passant de celui d’un simple organe de stockage dont l’excès de développement est cause d’obésité et des maladies métaboliques qui lui sont associées, à celui d’un véritable tissu endocrine jouant un rôle essentiel dans de nombreuses réponses physiologiques de l’organisme. Beaucoup plus récemment, plusieurs laboratoires, dont les nôtres, ont révélé que le tissu adipeux est une source de cellules aux propriétés étonnantes parmi lesquelles des cellules souches. C’est ce dernier point que nous allons discuter.
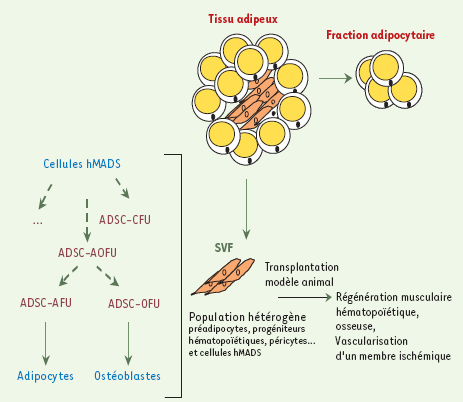
Nous avions montré, dans des travaux antérieurs à l’engouement du tissu adipeux comme source de cellules souches, que le préadipocyte, défini comme le précurseur capable de se différencier en adipocyte, possédait des activités de phagocytose, propriété que l’on pensait restreinte aux seuls macrophages, et que l’injection de la fraction stromale (SVF) du tissu adipeux permettait la reconstitution du système hématopoïétique d’une souris irradiée [ 1]. Plus récemment a été démontrée la présence au sein du tissu adipeux de populations de cellules capables de se différencier ex vivo en divers types cellulaires, ostéoblastes, chondroblastes, cellules endothéliales et myocytes et, de manière encore plus inattendue, cardiomyocytes [ 2– 4]. L’analyse phénotypique par cytométrie en flux de la SVF révèle la présence de multiples progéniteurs engagés dans différentes voies de différenciation [ 5]. Enfin, nous avons identifié de vraies cellules souches multipotentes dans des échantillons de SVF obtenus à partir de déchets opératoires de tissu adipeux de jeunes enfants. Ces cellules, nommées hMADS (human multipotent adipose derived stem), possèdent une forte capacité d’autorenouvellement et peuvent, à l’état clonal, se différencier en plusieurs types cellulaires [4]. L’ensemble des résultats démontre que la fraction stromale du tissu adipeux contient un gradient de cellules progénitrices ayant différentes potentialités de différenciation. Nous proposons de définir une hiérarchie de populations cellulaires du tissu adipeux selon une terminologie comparable à celle qui est utilisée pour classifier les progéniteurs de la moelle osseuse : ADSC-AFU (adipose derived stroma cell-adipocyte forming unit), ADSC-OFU (adipose derived stroma cell-osteoblast forming untit) désignent des progéniteurs de potentialité restreinte, ADSC-AOFU (adipose derived stroma cell-osteoblast-adipocyte forming unit) des progéniteurs bipotents…, les cellules hMADS étant les cellules souches multipotentes immatures (Figure 1). Outre les questions fondamentales posées par la présence de cellules souches du (et dans le) tissu adipeux, ces observations ont un intérêt thérapeutique certain. En effet, contrairement aux autres organes à partir desquels des cellules souches sont isolées (comme la moelle osseuse, la peau, le muscle strié, le cerveau), le tissu adipeux a la particularité unique d’être à la fois abondant (il représente 10 % du poids d’un individu sain et jusqu’à 50% chez un obèse) et facile à prélever, notamment sous anesthésie locale par liposuccion. Ce tissu est ainsi utilisé depuis de nombreuses années en chirurgie plastique et reconstructrice comme tissu de remplissage. Son intérêt comme source de cellules utilisables en médecine régénératrice s’est révélé à la suite de la découverte des populations cellulaires décrites ci-dessus. La réalité de leur potentiel thérapeutique a été démontrée chez la souris pour reconstruire le réseau vasculaire d’un membre ischémié [ 6, 7], la réparation osseuse [ 8], chez le lapin pour réparer un muscle détruit [ 9] (Figure 1). Quant aux cellules hMADS, leur transplantation dans la souris dystrophique mdx (souris déficientes en dystrophine utilisées comme modèle animal de la myopathie de Duchenne) compense le défaut génétique de la souris en induisant l’expression à long terme de dystrophine humaine [4]. Le résultat le plus spectaculaire vient du comportement immunologique inattendu des cellules hMADS puisqu’elles réparent le muscle de souris mdx, immunocompétentes, sans être rejetées. La tolérance immunologique des cellules hMADS peut s’expliquer, au moins en partie, par leur faible expression des molécules HLA de classe I, mais aussi par des propriétés immunosuppressives, comme nous l’avons démontré pour les cellules de la SVF mises en culture primaire et comme cela avait été préalablement montré pour les cellules souches mésenchymateuses de la moelle osseuse [ 10]. Cela renforce l’intérêt thérapeutique des cellules souches du tissu adipeux en laissant entrevoir la possibilité de traitements par allotransplantation, notamment dans le cas de maladies héréditaires, sans nécessité d’un traitement immunosuppresseur important. Les cellules hMADS ne forment pas de tumeurs après transplantation chez la souris immunodéficiente. Néanmoins, dans un avenir proche, il sera essentiel de comprendre comment ces cellules échappent au système immunitaire et d’examiner attentivement dans quelle mesure elles peuvent affecter les réponses immunitaires de l’hôte et notamment la réponse anti-tumorale.
| Figure 1.
Le tissu adipeux peut être dissocié en deux fractions : la fraction adipocytaire ne contenant que les adipocytes gorgés de goutelettes lipidiques, et la fraction stromale (SVF) contenant plusieurs types de cellules progénitrices. Ex vivo, les cellules hMADS peuvent engendrer des cellules capables de se différencier en adipocytes et ostéoblastes (ADSC-AOFU) ou en adipocytes (ADSC-AUF), en ostéoblastes (ADSC-OFU), en chondrocytes (ADSC-CFU). La transplantation chez la souris des cellules de la SVF ou des cellules hMADS purifiées ont permis de mettre en évidence le potentiel thérapeutique des cellules souches du tissu adipeux. |
En conclusion, le tissu adipeux joue à la fois le rôle de Mr Hyde Obésité, en tant qu’acteur principal dans les problèmes d’obésité, et du Dr Jekyll Régénération, en tant que source abondante et facile à prélever de cellules souches pour la médecine régénérative. Après avoir été un handicap, le tissu adipeux risque d’acquérir ses lettres de noblesse.