| |
| Med Sci (Paris). 2006 December; 22(12): 1022–1025. Published online 2006 December 15. doi: 10.1051/medsci/200622121022.L’induction neurale chez les amphibiens Un problème de calcium ? Marc Moreau, Isabelle Néant, Julie Batut, Anne Bibonne, Karen Lee, and Catherine Leclerc* Centre de Biologie du Développement, UMR 5547, 118, route de Narbonne, 31062 Toulouse Cedex 09 et GDR 2688, Toulouse, France MeSH keywords: Amphibiens, Animaux, Calcium, Protéines de transport, Ectoderme, Modèles biologiques, Neurones |
La formation du système nerveux des vertébrés débute au moment de la gastrulation avec l’induction et la formation de la plaque neurale sur la face dorsale de l’embryon. Au stade blastula et jeune gastrula (7 à 9 heures après la fécondation), l’ectoderme de l’amphibien Xenopus laevis peut évoluer vers un destin épidermique ou neural. Les travaux de la dernière décennie ont montré que l’ectoderme se détermine en épiderme en réponse à l’activation de la voie de signalisation BMP4 et prend un destin neural lorsque cette voie est inhibée par des facteurs secrétés par le mésoderme dorsal, tels que noggin, chordin ou follistatine. L’induction neurale se ferait donc selon un mécanisme « par défaut », qui ne nécessiterait que l’inhibition de la voie BMP4 et ne conduirait pas à l’activation d’une cascade de transduction spécifique [
1]. Ce modèle, bien que largement admis, présente des limites. Il a été principalement établi à partir d’expériences réalisées sur des ectodermes isolés et jamais sur l’embryon entier. Le modèle d’induction neurale « par défaut » n’est pas généralisable à l’embryon de poulet ou d’ascidie, où l’induction neurale nécessite un signal instructif faisant entre autres intervenir la voie de signalisation FGF [
2]. Des résultats récents obtenus sur l’embryon de xénope montrent que la répression de la voie de signalisation BMP4 est requise pour supprimer le destin épidermique mais qu’elle n’est pas suffisante pour induire le destin neural [
3]. Un certain nombre de travaux anciens ont permis de penser que le calcium jouait un rôle important dans le déclenchement de l’induction neurale. En 1964 Barth et Barth [
4] furent les premiers à suggérer que l’environnement ionique et en particulier le Ca2+ contrôlait la neuralisation de l’ectoderme de Rana pipiens. De plus la dissociation des cellules de l’ectoderme dans des milieux privés de Ca2+ oriente leur détermination vers la voie neurale [
5,
6]. |
La neuralisation par dissociation des cellules de l’ectoderme est associée à un signal calcique Nous avons montré que la dissociation entraîne une augmentation de la concentration intracellulaire en calcium ([Ca2+]i). Cette augmentation est provoquée par une sortie du Ca2+ intracellulaire due à la modification du gradient calcique entre les milieux intra- et extracellulaires [
7]. Ces résultats ainsi que ceux obtenus par l’équipe de De Robertis [
8] montrent que l’effet observé n’est pas dû à une simple dilution des inducteurs épidermiques (BMP) ou une variation d’affinité de ces molécules vis-à-vis de leurs récepteurs qui entraîneraient une neuralisation de l’ectoderme par défaut comme il a été proposé par certains auteurs [
9]. |
Sur des ectodermes isolés, Noggin induit une augmentation de [Ca 2+]i L’ectoderme, prélevé au stade jeune gastrula, garde la capacité de répondre aux signaux ventraux et dorsaux comme dans l’embryon. En présence d’un signal inducteur tel que noggin, il adoptera un destin neural. Par imagerie calcique nous avons observé que, sur des ectodermes, l’ajout de noggin provoque une augmentation transitoire de [Ca2+]i [
10]. |
La variation de [Ca2+]i provoquée par noggin résulte de l’activation de canaux voltage dépendants sensibles aux dihydropyridines (DHP). Les antagonistes de ces canaux tels la nifédipine bloquent les variations de [Ca2+]i [10]. Il n’est pas exclu que d’autres sources de Ca2+ puissent être impliquées, tout au moins partiellement. Les méthylxanthines telles la caféine sont connues pour libérer du Ca2+ à partir des réserves internes. Nous avons montré, sur des ectodermes isolés que cet agent était un inducteur neural [
11]. |
L’activation directe des canaux Ca 2+ sensibles aux dihydropyridines déclenche l’induction neurale Les ectodermes isolés, stimulés par des dihydropyridines, agonistes spécifiques des canaux sensibles aux DHP tels que le S(-)Bay K 8644, déclenchent une augmentation transitoire de [Ca2+]i qui présente une cinétique comparable à celle provoquée par noggin. Elle est suffisante, dans un contexte BMP actif, pour déclencher l’induction neurale. Les ectodermes ainsi traités se différencient dans les deux lignées neurales, neurones et cellules gliales, identifiables en immunocytochimie [11]. |
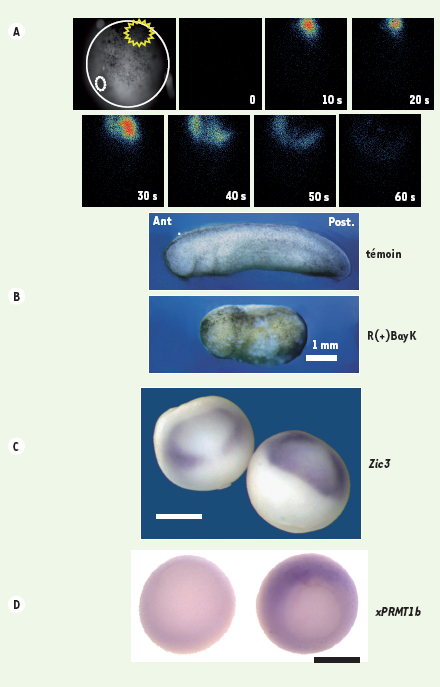
Les observations réalisées sur des ectodermes isolés ( ex vivo) sont-elles le reflet des phénomènes physiologiques se produisant sur l’embryon entier ( in vivo) ? Avec une sonde bioluminescente, l’aequorine, et à l’aide d’un système d’imagerie original par comptage de photons [
12,
13], nous avons visualisé au sein de l’ectoderme dorsal des variations transitoires de [Ca2+]i au cours de la gastrulation. Ces variations sont localisées dans des groupes de 10 à 20 cellules. Le plus grand nombre de variations transitoires est atteint en milieu de gastrulation, pendant la période où se déroule l’induction neurale, soit environ 9 heures après la fécondation chez le xénope (Figure 1A). Il ne se produit pas de variation détectable de [Ca2+]i dans les cellules de l’ectoderme ventral. Il faut rappeler que les cellules ventrales ne reçoivent pas de signaux inducteurs neuraux. Comme dans les ectodermes isolés, les dihydropyridines antagonistes des canaux DHP bloquent ces variations de [Ca2+]i et l’induction neurale est fortement perturbée (Figure 1B). Les embryons présentent des phénotypes de microcéphalie et de microphtalmie ; les phénotypes les plus sévères donnent des embryons dépourvus de tête [10,12].  | Figure 1.
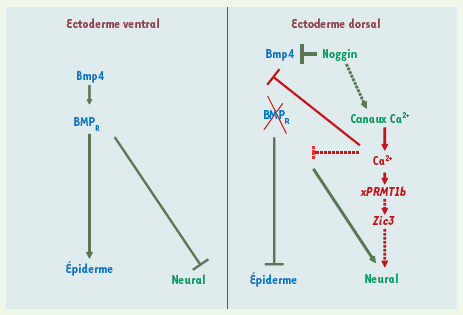
A. Exemple de variations transitoires de Ca 2+ se produisant dans l’ectoderme dorsal de l’embryon de xénope au stade 10,5 (11 heures après la fécondation). Les embryons ont été injectés avec l’aequorine et les variations de Ca 2+ ont été visualisées à l’aide du photo imaging microscope (PIM) selon la technique décrite dans [ 12, 13]. Chaque variation transitoire de Ca 2+ correspond à une intégration de 120 secondes. Échelle : 0,3 mm. B. Les antagonistes des canaux sensibles aux DHP altèrent la formation des structures antérieures du système nerveux. Comparaison des phénotypes obtenus pour des embryons incubés du stade blastula au stade neurula (de 5 à 15 heures après la fécondation) en présence de R(+)BayK 10 µm (antagoniste des canaux sensibles aux DHP) et des embryons témoins. C, D. Les antagonistes des canaux Ca 2+ sensibles aux DHP inhibent l’expression de gènes impliqués dans l’induction neurale. Effet de la nicardipine 500 µM et de la nifédipine 500 µM (antagonistes des canaux sensibles aux DHP) sur l’expression du gène proneural Zic3
(C) et de l’arginine N-méthyltransférase xPRMT1b
(D). À droite, témoin ; à gauche, embryon traité. Échelle : 0,5 mm |
|
Certains facteurs de transcription sont des cibles privilégiées du Ca2+. Ainsi le gène c-fos est activé pendant l’induction neurale, qu’elle soit déclenchée par noggin ou par une augmentation de [Ca2+]i [
14]. Deux gènes proneuraux XlPOU2 et Zic3, sont également activés suite à la stimulation de l’ectoderme par noggin ou par une variation de [Ca2+]i induite par les DHP ou par la caféine. Inversement, le blocage des signaux calciques inhibe l’expression des gènes proneuraux [12, 14] (Figure 1C). Afin de mieux comprendre le rôle du Ca2+ au cours de l’induction neurale, par une approche soustractive, nous avons recherché des gènes précoces de la détermination neurale contrôlés par le Ca2+. Une banque soustractive d’ADNc a été construite à partir d’ectodermes isolés induits par une augmentation de [Ca2+]i provoquée par la caféine versus non induits. Une trentaine de gènes précoces contrôlés par le Ca2+ et qui s’expriment dans les futurs territoires neuraux ont ainsi été sélectionnés [
15]. Nous avons plus particulièrement porté notre attention sur une arginine N-méthyl-transférase, xPRMT1b. C’est un gène de réponse directe au Ca2+ et son expression est détectée dès le début de la gastrulation, dans tout l’ectoderme ainsi que dans le mésoderme dorsal. Son expression est ensuite restreinte aux territoires neuraux dans les stades plus tardifs (Figure 1D). Le rôle de xPRMT1b au cours de l’induction neurale a été abordé par gain (surexpression de l’ARN messager) et perte de fonction (approche morpholino). En particulier, dans l’embryon, la perte de fonction de xPRMT1b bloque le développement de la partie antérieure du système nerveux. Nos résultats suggèrent que l’enzyme xPRMT1b fait le lien entre l’augmentation de [Ca2+]i et les événements en aval de l’induction neurale [15,
16] (Figure 2). 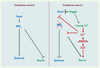 | Figure 2.
Modèle instructif de l’induction neurale. Dans l’ectoderme dorsal le Ca2+ joue un rôle central pour (1) contrôler l’expression de gènes neuraux (en particulier XPRMT1b et Zic3) et (2) participer à l’inhibition de l’expression de bmp4. Le Ca2+ pourrait aussi réprimer la voie épidermique en aval du récepteur BMP4. Ce Ca2+ provient d’un influx via des canaux Ca2+ sensible aux DHP. Noggin est capable d’activer ces canaux selon un mécanisme indirect encore inconnu. |
|
Ces travaux montrent le rôle primordial que peuvent jouer les canaux sensibles aux DHP dans le processus d’induction neurale. Nous soulignerons deux niveaux.
-
Le premier concerne le concept de compétence neurale. La compétence neurale est une propriété transitoire de l’ectoderme. Elle correspond pendant la gastrulation à une fenêtre de temps (entre 8 et 14 heures après la fécondation) pendant laquelle l’ectoderme peut être induit par un signal neuralisant. L’ectoderme au stade gastrula répond d’une manière optimale au signal alors que l’ectoderme de la gastrula âgée ne répond plus ; les bases moléculaires de cette propriété ne sont pas connues. Les expériences précédentes suggèrent que les canaux calciques sensibles aux DHP jouent un rôle crucial dans le déclenchement de l’induction neurale. Nous avons analysé l’ontogenèse de ces canaux au niveau des cellules de l’ectoderme de deux amphibiens ; Pleurodeles waltl et Xenopus laevis depuis le stade non compétent jusqu’à la perte de compétence. Nos résultats démontrent sans ambiguïté une stricte corrélation entre l’acquisition de la compétence neurale et la densité des canaux calciques sensibles aux DHP. La densité des canaux calciques sensibles aux DHP n’est plus mesurable lorsque la compétence a disparu [
17,
18]. Chez le pleurodèle, une stratégie anti-sens pour perturber l’expression du canal sensible aux DHP au niveau des cellules de l’ectoderme dorsal inhibe la neurulation et le développement de l’embryon se poursuit avec une absence de structures nerveuses antérieures (encéphale, yeux) [
19]. Chez le xénope, la surexpression des différentes sous-unités composant le canal sensible aux DHP produit une dorsalisation de l’embryon [
20].
-
Le second niveau nous amène à moduler le concept d’induction neurale par défaut. Nous montrons que le Ca2+ est nécessaire et suffisant pour orienter les cellules de l’ectoderme dans un destin neural même dans un contexte ou BMP est actif ce qui donne un rôle instructif au Ca2+. Ce rôle est relayé par l’activation d’une cascade de gènes nécessaire à la neuralisation de l’ectoderme. En particulier nous avons montré qu’une enzyme activé par le Ca2+ avait un rôle instructif dans le choix du destin cellulaire (neural ou épidermique).
|
1. Weinstein DC, Hemmati-Brivanlou A. Neural induction. Annu Rev Cell Dev Biol 1999; 15 : 411–33. 2. Stern CD. Neural induction: old problem, new findings, yet more questions. Development 2005; 132 : 2007–21. 3. Delaune E, Lemaire P, Kodjabachian L. Neural induction in Xenopus requires early FGF signalling in addition to BMP inhibition. Development 2005; 132 : 299–310. 4. Barth LG, Barth LJ. Sequential induction of the presumptive epidermis of the Rana pipiens gastrula. Biol Bull 1964; 127 : 413–27. 5. Grunz H, Tacke L. Neural differentiation of Xenopus laevis ectoderm takes place after disaggregation and delayed reaggregation without inducer. Cell Differ Dev 1989; 28 : 211–7. 6. Saint-Jeannet JP, Huang S, Duprat AM. Modulation of neural commitment by changes in target cell contacts in Pleurodeles waltl.
Dev Biol 1990; 141 : 93–103. 7. Moreau M, Leclerc C. The choice between epidermal and neural fate: a matter of calcium. Int J Dev Biol 2004; 48 : 75–84. 8. Kuroda H, Fuentealba L, Ikeda A, et al. Default neural induction: neuralization of dissociated Xenopus cells is mediated by Ras/MAPK activation. Genes Dev 2005; 19 : 1022–7. 9. Wilson PA, Hemmati-Brivanlou A. Induction of epidermis and inhibition of neural fate by Bmp-4. Nature 1995; 376 : 331–3. 10. Leclerc C, Daguzan C, Nicolas MT, et al. L-type calcium channel activation controls the in vivo transduction of the neuralizing signal in the amphibian embryos. Mech Dev 1997; 64 : 105–10. 11. Moreau M, Leclerc C, Gualandris-Parisot L, et al. Increased internal Ca2+ mediates neural induction in the amphibian embryo. Proc Natl Acad Sci USA 1994; 91 : 12639–43. 12. Leclerc C, Webb SE, Daguzan C, et al. Imaging patterns of calcium transients during neural induction in Xenopus laevis embryos. J Cell Sci 2000; 113 : 3519–29. 13. Webb SE, Lee KW, Karplus E, et al. Localized calcium transients accompany furrow positioning, propagation, and deepening during the early cleavage period of zebrafish embryos. Dev Biol 1997; 192 : 78–92. 14. Leclerc C, Duprat AM, Moreau M. Noggin upregulates Fos expression by a calcium-mediated pathway in amphibian embryos. Dev Growth Differ 1999; 41 : 227–38. 15. Batut J, Vandel L, Leclerc C, et al. The Ca2+-induced methyltransferase xPRMT1b controls neural fate in amphibian embryo. Proc Natl Acad Sci USA 2005; 102 : 15128–33. 16. Neant I, Leclerc C, Batut J, et al. An increase in intracellular free calcium controls the expression of an arginine N-methyl-transferase involved in neural determination in amphibian embryo. Med Sci (Paris) 2006; 22 : 346–48. 17. Drean G, Leclerc C, Duprat AM, et al. Expression of L-type Ca2+ channel during early embryogenesis in Xenopus laevis. Int J Dev Biol 1995; 39 : 1027–32. 18. Leclerc C, Duprat AM, Moreau M. In vivo labelling of L-type Ca2+ channels by fluorescent dihydropyridine: correlation between ontogenesis of the channels and the acquisition of neural competence in ecotderm cells from Pleurodeles waltl embryos. Cell Calcium 1995; 17 : 216–24. 19. Leclerc C, Rizzo C, Daguzan C, et al. Neural determination in Xenopus laevis embryos: control of early neural gene expression by calcium. J Soc Biol 2001; 195 : 327–37. 20. Palma V, Kukuljan M, Mayor R. Calcium mediates dorsoventral patterning of mesoderm in Xenopus. Curr Biol 2001; 11 : 1606–10. |