| |
| Med Sci (Paris). 2006 December; 22(12): 1081–1086. Published online 2006 December 15. doi: 10.1051/medsci/200622121081.L’adaptateur 3BP2 Quelle place pour cette protéine dans la signalisation des leucocytes ? Marcel Deckert* Inserm U576, Régulation des réponses immune et inflammatoire, Hôpital de l’Archet, Route Saint-Antoine de Ginestière, 06202 Nice, France |
Les protéines adaptatrices sont composées de domaines structuraux conservés qui stabilisent les interactions protéine-protéine et protéine-lipide [
1]. Ces domaines leur permettent de connecter plusieurs protéines entre elles sur une durée précise, et de localiser de façon optimale dans la cellule différents complexes multiprotéiques. Bien que dépourvues d’activité enzymatique, leur structure modulaire leur fait jouer un rôle crucial dans la signalisation cellulaire, en particulier dans les processus très dynamiques nécessitant une grande amplitude de réaction. Ainsi, dans le système immunitaire, au cours de l’interaction entre le lymphocyte T et la cellule présentatrice de l’antigène, l’activation des kinases des familles Src et Syk déclenche la formation de complexes multiprotéiques assemblés par les protéines adaptatrices qui permettent une régulation fine de la plasticité cellulaire et des réponses lymphocytaires [
2]. Cet assemblage de complexes signalisateurs par les protéines adaptatrices est retrouvé pour tous les types de récepteurs membranaires, quelle que soit la réponse cellulaire impliquée : prolifération, mort cellulaire, différenciation, motilité et polarisation, et quel que soit le type cellulaire. Le nombre croissant de pathologies associées à des modifications de la fonction des protéines adaptatrices est une preuve supplémentaire de l’importance de ces protéines dans la signalisation cellulaire. L’adaptateur 3BP2 a été initialement identifié comme une protéine interagissant avec la kinase c-Abl, puis comme un partenaire des kinases de la famille Syk. Si le rôle physiologique de 3BP2 reste à ce jour mal connu, des études ont montré qu’il intervenait dans la signalisation par les immunorécepteurs, au travers de son association avec un ensemble de molécules essentielles à la biologie des leucocytes. L’identification de mutations de 3BP2 dans une maladie rare appelée chérubisme laisse entrevoir un rôle plus large de 3BP2 dans la biologie des cellules hématopoïétiques. Cette revue fait le point des connaissances actuelles des mécanismes moléculaires impliquant la protéine adaptatrice 3BP2 dans la signalisation des leucocytes. |
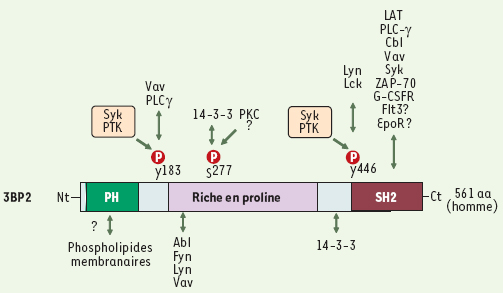
3BP2 : structure et partenaires moléculaires 3BP2 a été initialement identifiée comme une protéine interagissant avec le domaine SH3 de la protéine tyrosine kinase c-Abl [
3], puis par la suite comme un partenaire de la kinase Syk [
4]. Chez l’homme, le gène 3bp2/sh3bp2 est composé de 13 exons sur la région chromosomique 4p16.3 et code pour un messager principal de 2,4 kb ubiquitaire dans les tissus humains, avec une forte prédominance dans les cellules d’origine hématopoïétique ou lymphoïde [4,
5]. Le produit de ce gène est une protéine de 561 et 559 acides aminés chez l’homme et la souris, respectivement ; ces protéines présentent une remarquable identité, ce qui suggère qu’elles assurent des fonctions similaires chez les rongeurs et les humains. La protéine 3BP2 a une organisation modulaire typique d’une molécule adaptatrice, avec un domaine PH aminoterminal, une région centrale riche en proline et un domaine SH2 carboxyterminal. Ces domaines lui permettent d’interagir avec de nombreux intermédiaires de la signalisation intracellulaire, favorisant ainsi l’assemblage de complexes multimoléculaires essentiels à la transmission des signaux reçus par le leucocyte (Figure 1). La présence d’un domaine PH suggère que 3BP2 puisse lier des phospholipides membranaires, même si cela n’a pas été étudié jusqu’à présent. Ce domaine paraît indispensable, car sa délétion réduit la capacité de 3BP2 à augmenter l’activité de facteurs nucléaires comme NFAT dans les cellules T et B [4,
6]. Le domaine riche en proline, qui s’étend entre les domaines PH et SH2 sur plus de 200 acides aminés, contient de multiples motifs PxxP représentant des sites de fixation pour des protéines à domaine SH3, parmi lesquelles Abl [3], Vav [6], Fyn [4] et Lyn [
7]. Le criblage de banques de peptides dégénérés par le groupe de Cantley a montré que la séquence de fixation optimale pour le domaine SH2 de 3BP2 se compose des acides aminés phosphoTyr-Glu-Asn (pYEN), un motif retrouvé dans plusieurs molécules de signalisation incluant les récepteurs tyrosine kinases Flt3/Flk2, EpoR, et G-CSFR [
8]. L’interaction entre une forme recombinante du domaine SH2 de 3BP2 et un résidu phosphotyrosine du domaine intracytoplasmique du G-CSFR, connu pour lier Grb2 et Shc, a été récemment décrite, mais les conséquences fonctionnelles de cette interaction pour les cellules hématopoïétiques restent inconnues [
9]. Le domaine SH2 de 3BP2 peut également se lier au motif YEN présent dans la partie intracytoplasmique de l’adapteur transmembranaire LAT exprimé par les cellules T et NK [4,
10]. Il interagit aussi avec d’autres protéines phosphorylées ne contenant pas le motif YEN, parmi lesquelles les kinases Syk et ZAP-70 [4, 6], Vav2 [6], PLC-γ, et Cbl [4, 6, 10,
11], ce qui suggère l’existence d’autres mécanismes d’association.  | Figure 1.
Structure et partenaires moléculaires de 3BP2. La protéine adaptatrice 3BP2 est composée d’un domaine PH (pleckstrin homology) aminoterminal, d’une région centrale riche en proline et d’un domaine SH2 (Src-homology 2) carboxyterminal. Les protéines associées aux différents domaines de la protéine adaptatrice 3BP2 et les résidus tyrosine et sérine modifiés par phosphorylation (cercles rouges) sont indiqués. |
3BP2 est modifiée par phosphorylation de résidus tyrosine après stimulation des immunorécepteurs (récepteurs de l’antigène des cellules T et B, récepteurs des immunoglobulines), et peut être phosphorylée in vitro par les kinases de la famille Syk sur les résidus Tyr174, Tyr183 et Tyr446 [7,
12]. Le résidu phospho-Tyr183 représente un site de fixation du domaine SH2 de Vav1 [11], alors que le résidu phopho-Tyr446 interagit avec les domaines SH2 de Lyn et Lck [7, 12]. L’importance de ces événements est illustrée par le fait que la surexpression de formes mutées de 3BP2 sur les résidus Tyr183 ou Tyr446 réduit la signalisation par 3BP2 dans les cellules T ([12] et Deckert, résultats non publiés) et NK [11]. À l’inverse, et bien que 3BP2 interagisse avec Abl, on ne sait encore si 3BP2 est un substrat d’Abl, et dans quelles circonstances. Enfin, 3BP2 peut être phosphorylée sur des résidus sérine par la PKC, et se complexer avec les protéines 14-3-3 via les sérines 225 et 277 [
13]. L’impact de ces phosphorylations sur la fonction de 3BP2 est inconnu, mais elles pourraient réguler négativement la signalisation par 3BP2 dans les cellules T et les mastocytes [13,
14]. |
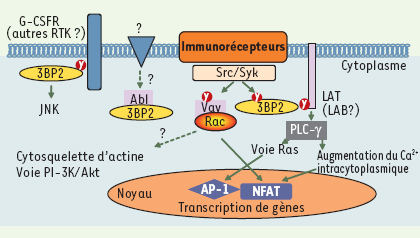
Quelle fonction pour 3BP2 dans la signalisation leucocytaire ? En l’absence de modèles animaux, la fonction exacte de 3BP2 reste inconnue. Cependant, les données publiées, fondées sur des approches de type gain ou perte de fonction, indiquent que 3BP2 joue un rôle régulateur dans la signalisation des immunorécepteurs dépendante des kinases Src et Syk (Figure 2). Ainsi, 3BP2 a été impliquée dans la stimulation par le récepteur FcγRIII de la cytotoxicité des cellules NK [11], la dégranulation induite par l’aggrégation des récepteurs FcεRI [10], ou encore l’activation, par les récepteurs de l’antigène de cellules T (TCR) et B (BCR), de NFAT et AP-1, deux facteurs transcriptionnels essentiels à l’homéostasie des leucocytes [4, 12]. Dans ce contexte, une fonction probable de 3BP2 est à rechercher dans une cascade de signalisation dépendante de la PLC-γ, régulant le métabolisme lipidique et calcique des leucocytes stimulés par les immunorécepteurs. Ainsi, dans les cellules T et les mastocytes, 3BP2 interagit avec LAT dans les radeaux glycolipidiques membranaires et potentialise l’activation de la PLC-γ. La surexpression de 3BP2 dans la lignée T Jurkat induit une augmentation considérable des activités NFAT/AP-1 stimulées par le TCR, par une voie dépendante de la petite GTPase Ras et de la calcineurine, une sérine/thréonine phosphatase activée par le calcium et cible de la cyclosporine A [4, 12]. Dans une lignée de cellules basophiles, la surexpression d’une forme dominante négative de 3BP2 réduit fortement la phosphorylation de PLC-γ1/2, l’augmentation de calcium intracytoplasmique et la dégranulation induite par le FcεRI [10]. Des approches de type perte de fonction, incluant la suppression de l’expression de 3BP2 par des petits ARN interférants et l’expression d’une forme dominante négative, soulignent encore l’importance de 3BP2 pour l’activation du facteur nucléaire NFAT par le TCR et le BCR [6, 12]. 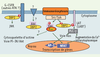 | Figure 2.
Signalisation par 3BP2 dans les leucocytes. La stimulation par les immunorécepteurs (TCR, BCR ou FcR) conduit à l’activation des protéine tyrosine kinases des familles Src et Syk qui phosphorylent des protéines de signalisation, parmi lesquelles l’adaptateur 3BP2, qui à son tour recrute d’autres protéines et enzymes associées dans des complexes multimoléculaires de signalisation. Ces complexes régulent les réponses cellulaires telles que la libération de calcium intracytoplasmique ou l’activation de la voie de la petite GTPase Ras, notamment impliquées dans l’activation de gènes via les facteurs de transcription NFAT et AP-1. L’implication potentielle de 3BP2 dans d’autres voies de signalisation des cellules leucocytaires est indiquée par des flèches en pointillés et des points d’interrogation. |
Les mécanismes précis par lesquels 3BP2 régule ces évenements restent inconnus, mais son association avec les protéines Vav, des facteurs d’échanges nucléotidiques des petites GTPases Rho qui jouent un rôle central dans la régulation des flux calciques, et NFAT, par les immunorécepteurs [
15], est probablement cruciale. En effet, 3BP2 interagit avec les protéines Vav de plusieurs manières : une interaction basale entre le domaine riche en proline de 3BP2 et l’un des domaines SH3 des protéines Vav ; une interaction induite par l’activation cellulaire entre le domaine SH2 de 3BP2 et les protéines Vav phosphorylées sur des résidus tyrosine ; une interaction entre la tyrosine 183 phosphorylée de 3BP2 et le domaine SH2 de Vav1. De plus, une forme dominante négative de Rac1, une petite GTPase régulée par Vav1, inhibe l’activation de NFAT/AP-1 induite par 3BP2 [6], et il semble que 3BP2 favorise l’échange du GDP par le GTP sur Rac1 par Vav1 [6, 14]. Il est intéressant de noter que le domaine SH2 des protéines Vav s’associe également avec l’adaptateur SLP-76 [
16,
17], d’où la question : les complexes 3BP2/Vav et SLP-76/Vav ont-ils des fonctions spécifiques dans les différents processus régulés par les protéines Vav comme la transcription de gènes et la réorganisation du cytosquelette d’actine ? Enfin, un rôle de 3BP2 dans la signalisation d’autres types de récepteurs des leucocytes a été décrit. Ainsi, la fixation de 3BP2 au G-CSFR participe à l’activation de la MAP-kinase JNK par le G-CSF dans la lignée de cellules BaF3 [9], et 3BP2 a été récemment impliquée dans l’activation de la MAP-kinase ERK2 et l’activité cytotoxique des cellules NK stimulée par CD244, un membre de la famille CD150/SLAM [
18]. |
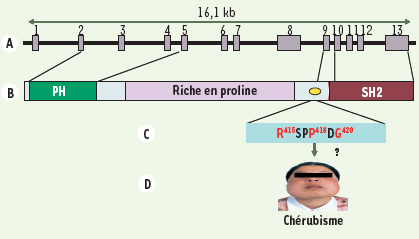
L’observation que le gène 3bp2 est localisé dans la région chromosomique 4p16.3, fréquemment délétée dans les cancers de la vessie [5] et le syndrome de Wolf-Hirschhorn [
19], suggère une implication physiopathologique de 3BP2 dans l’homéostasie cellulaire. Cette notion a été illustrée par la découverte en 2001 de mutations du gène 3bp2/sh3bp2 dans une maladie génétique rare du développement craniofacial, appelée chérubisme [
20], découverte qui laisse entrevoir un rôle plus large de 3BP2 dans la biologie des cellules hématopoïétiques. Le chérubisme est une dysplasie osseuse atteignant la mâchoire, décrite pour la première fois par Frangenheim en 1914, puis par Jones en 1933 [
21]. C’est une affection autosomale dominante dont les critères cliniques majeurs sont un élargissement de la mâchoire, un faciès joufflu de chérubin, des anomalies de la première dentition, des anomalies endocriniennes parfois associées à un élargissement des ganglions lymphatiques du cou et la présence, dans les os de la mâchoire, de kystes remplis d’ostéoclastes multinucléés et de granulomes à cellules géantes [
22]. Des mutations ponctuelles du gène 3bp2 sur le chromosome 4p16.3 ont été associées au chérubisme [20]. Toutes les mutations de 3bp2 identifiées sont localisées dans l’exon 9 du gène et conduisent à la substitution d’un seul acide aminé dans la séquence RSPPDG de la protéine, située entre la fin de la région riche en proline et le domaine SH2 (Figure 3). La mutation la plus fréquente est la substitution du résidu proline 418 par une leucine, une arginine ou une glutamine, mais des mutations de la glycine 420 en acide glutamique ou arginine, et de l’arginine 415 en proline ou glutamine ont également été identifiées [20]. Des études ultérieures (menées par des équipes différentes) ont également mis en évidence la présence de ces mutations ponctuelles chez d’autres individus atteints de chérubisme [
23,
24]. Les altérations fonctionnelles dues aux protéines 3BP2 mutantes sont actuellement inconnues. Cependant, la présence dans les os de la mâchoire d’un excès d’ostéoclastes multinucléés suggère que les protéines 3BP2 mutantes altèrent les voies de signalisation des ostéoclastes, des cellules essentielles à l’homéostasie osseuse et se différenciant à partir de progéniteurs myélomonocytaires de la moelle osseuse sous l’action du récepteur RANK, notamment, ainsi que d’autres signaux [
25]. Il faut noter qu’une étude récente a montré que la surexpression de mutants « chérubisme » de 3BP2 dans la lignée basophile RBL-2H3 a un effet dominant négatif sur la signalisation du récepteur FcεRI [14]. Des altérations moléculaires analogues restent toutefois à démontrer dans les ostéoclastes ou les autres cellules régulant le remodelage osseux. 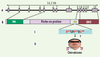 | Figure 3.
Mutations de 3BP2 et chérubisme. A, B. Taille et structure schématique du gène 3bp2/sh3bp2, et position relative des domaines de la protéine par rapport aux 13 exons du gène. C. Région de 6 acides aminés RSPPDG de 3BP2 en amont du domaine SH2, dans laquelle toutes les mutations associées au chérubisme ont été retrouvées (résidus affectés en rouge). D. Phénotype représentatif d’un patient atteint de chérubisme, avec un élargissement de la face provoqué par une dégradation excessive des os de la mâchoire et des anomalies de la dentition. |
De façon intéressante, plusieurs partenaires protéiques de 3BP2 ont été impliqués dans le développement osseux, parmi lesquels les kinases Abl [
26], Src [
27] et Syk [
28], ainsi que le facteur d’échange Vav3 [
29]. De plus, AP-1 et NFAT, deux facteurs de transcription dont les activités sont régulées par 3BP2 dans les leucocytes, jouent un rôle majeur dans le développement osseux [25]. Enfin, certains patients atteints de chérubisme présentent une lympho-adénopathie cervicale [21]. L’intervention dans cette pathologie de lymphocytes activés lors d’une poussée inflammatoire n’est donc pas à exclure, car ils sont capables d’activer l’ostéoclastogenèse à la suite de l’interaction de RANK avec son ligand RANKL exprimé par les progéniteurs des ostéoclastes [
30]. Dans ce contexte, il serait intéressant de déterminer si les protéines 3BP2 mutantes dans le chérubisme altèrent la maturation des ostéoclastes ou l’homéostasie lymphocytaire, et par quels mécanismes. |
De nombreuses études génétiques et biochimiques ont montré que les protéines adaptatrices dépourvues d’activité enzymatique intrinsèque jouent un rôle essentiel dans la biologie de la plupart des types cellulaires. Malgré un nombre croissant de données soulignant l’importance de l’adaptateur 3BP2 dans les cellules hématopoïétiques et la signalisation des immunorécepteurs, sa fonction physiologique doit encore être établie. Son implication dans les mécanismes moléculaires régulant l’activation, la prolifération et la survie des leucocytes au cours des réponses immune et allergique reste, notamment, inconnue. Les interactions de 3BP2 avec la kinase Abl et les récepteurs tyrosine kinases impliqués dans le développement et l’activation des cellules hématopoïétiques (par exemple Flt3, EpoR, G-CSFR) devront également être évaluées. Le motif YENX, qui constitue la séquence de liaison optimale du domaine SH2 de 3BP2, est présent sur de nombreux récepteurs membranaires, suggérant un rôle pour 3BP2 dans d’autres voies de signalisation. Le développement à venir de modèles cellulaires et animaux élaborés devrait certainement permettre de répondre à ces nombreuses questions et d’élucider le rôle de 3BP2 dans la signalisation des leucocytes et la physiopathologique du chérubisme.

|
Je tiens à remercier tous les membres de notre laboratoire, passés et présents, qui ont participé aux travaux sur 3BP2, ainsi que l’Association pour la recherche sur le cancer, le Ministère de la Recherche et l’Inserm, qui ont permis leur réalisation.
|
Footnotes |
1. Pawson T, Scott JD. Signaling through scaffold, anchoring, and adaptor proteins. Science 1997; 278 : 2075–80. 2. Jordan MS, Singer AL, Koretzky GA. Adaptors as central mediators of signal transduction in immune cells. Nat Immunol 2003; 4 : 110–6. 3. Ren R, Mayer BJ, Cicchetti P, Baltimore D. Identification of a ten-amino acid proline-rich SH3 binding site. Science 1993; 259 : 1157–61. 4. Deckert M, Tartare-Deckert S, Hernandez J, et al. Adaptor function for the Syk kinases-interacting protein 3BP2 in IL-2 gene activation. Immunity 1998; 9 : 595–605. 5. Bell SM, Shaw M, Jou YS, et al. Identification and characterization of the human homologue of SH3BP2, an SH3 binding domain protein within a common region of deletion at 4p16.3 involved in bladder cancer. Genomics 1997; 44 : 163–70. 6. Foucault I, Le Bras S, Charvet C, et al. The adaptor protein 3BP2 associates with VAV guanine nucleotide exchange factors to regulate NFAT activation by the B-cell antigen receptor. Blood 2005; 105 : 1106–13. 7. Maeno K, Sada K, Kyo S, et al. Adaptor protein 3BP2 is a potential ligand of Src homology 2 and 3 domains of Lyn protein-tyrosine kinase. J Biol Chem 2003; 278 : 24912–20. 8. Songyang Z, Shoelson SE, McGlade J, et al. Specific motifs recognized by the SH2 domains of Csk, 3BP2, fps/fes, GRB-2, HCP, SHC, Syk, and Vav. Mol Cell Biol 1994; 14 : 2777–85. 9. Kendrick TS, Lipscombe RJ, Rausch O, et al. Contribution of the membrane-distal tyrosine in intracellular signaling by the granulocyte colony-stimulating factor receptor. J Biol Chem 2004; 279 : 326–40. 10. Sada K, Miah SM, Maeno K, et al. Regulation of FcεRI-mediated degranulation by an adaptor protein 3BP2 in rat basophilic leukemia RBL-2H3 cells. Blood 2002; 100 : 2138–44. 11. Jevremovic D, Billadeau DD, Schoon RA, et al. Regulation of NK cell-mediated cytotoxicity by the adaptor protein 3BP2. J Immunol 2001; 166 : 7219–28. 12. Qu X, Kawauchi-Kamata K, Miah SM, et al. Tyrosine phosphorylation of adaptor protein 3BP2 induces T cell receptor-mediated activation of transcription factor. Biochemistry 2005; 44 : 3891–8. 13. Foucault I, Liu YC, Bernard A, Deckert M. The chaperone protein 14-3-3 interacts with 3BP2/SH3BP2 and regulates its adapter function. J Biol Chem 2003; 278 : 7146–53. 14. Miah SM, Hatani T, Qu X, et al. Point mutations of 3BP2 identified in human-inherited disease cherubism result in the loss of function. Genes Cells 2004; 9 : 993–1004. 15. Turner M, Billadeau DD. VAV proteins as signal integrators for multi-subunit immune-recognition receptors. Nat Rev Immunol 2002; 2 : 476–86. 16. Wu J, Motto DG, Koretzky GA, Weiss A. Vav and SLP-76 interact and functionally cooperate in IL-2 gene activation. Immunity 1996; 4 : 593–602. 17. Zakaria S, Gomez TS, Savoy DN, et al. Differential regulation of TCR-mediated gene transcription by Vav family members. J Exp Med 2004; 199 : 429–34. 18. Saborit-Villarroya I, Del Valle JM, Romero X, et al. The adaptor protein 3BP2 binds human CD244 and links this receptor to Vav signaling, ERK activation, and NK cell killing. J Immunol 2005; 175 : 4226–35. 19. Zollino M, Di Stefano C, Zampino G, et al. Genotype-phenotype correlations and clinical diagnostic criteria in Wolf-Hirschhorn syndrome. Am J Med Genet 2000; 94 : 254–61. 20. Ueki Y, Tiziani V, Santanna C, et al. Mutations in the gene encoding c-Abl-binding protein SH3BP2 cause cherubism. Nat Genet 2001; 28 : 125–6. 21. Jones WA. Cherubism: A thumbnail sketch of its diagnosis and a conservative method of treatment. Oral Surg Oral Med Oral Pathol 1965; 20 : 648–53. 22. Southgate J, Sarma U, Townend JV, et al. Study of the cell biology and biochemistry of cherubism. J Clin Pathol 1998; 51 : 831–7. 23. Imai Y, Kanno K, Moriya T, et al. A missense mutation in the SH3BP2 gene on chromosome 4p16.3 found in a case of nonfamilial cherubism. Cleft Palate Craniofac J 2003; 40 : 632–8. 24. Lo B, Faiyaz-Ul-Haque M, Kennedy S, et al. Novel mutation in the gene encoding c-Abl-binding protein SH3BP2 causes cherubism. Am J Med Genet 2003; 121A : 37–40. 25. Takayanagi H. Mechanistic insight into osteoclast differentiation in osteoimmunology. J Mol Med 2005; 83 : 170–9. 26. Li B, Boast S, de los Santos K, et al. Mice deficient in Abl are osteoporotic and have defects in osteoblast maturation. Nat Genet 2000; 24 : 304–8. 27. Soriano P, Montgomery C, Geske R, Bradley A. Targeted disruption of the c-src proto-oncogene leads to osteopetrosis in mice. Cell 1991; 64 : 693–702. 28. Mocsai A, Humphrey MB, Van Ziffle JA, et al. The immunomodulatory adapter proteins DAP12 and Fc receptor gamma-chain (FcRγ) regulate development of functional osteoclasts through the Syk tyrosine kinase. Proc Natl Acad Sci USA 2004; 101 : 6158–63. 29. Faccio R, Teitelbaum SL, Fujikawa K, et al. Vav3 regulates osteoclast function and bone mass. Nat Med 2005; 11 : 284–90. 30. Theill LE, Boyle WJ, Penninger JM. RANK-L and RANK: T cells, bone loss, and mammalian evolution. Annu Rev Immunol 2002; 20 : 795–823. |