| |
| Med Sci (Paris). 2007 January; 23(1): 21–24. Published online 2007 January 15. doi: 10.1051/medsci/200723121.Les ligands Delta et la niche du développement lymphoïde Emmanuelle Six,1,2* Isabelle André Schmutz,1,2 and Marina Cavazzana-Calvo1,2,3 1Inserm, U768, Paris, F-75015, France 2Université Paris-Descartes, Faculté de Médecine René Descartes, IFR94, Paris, F-75015, France 3AP-HP, Hôpital Necker-Enfants Malades, Département de Biothérapie, Paris, F-75015, France MeSH keywords: Animaux, Protéines de Drosophila, Sang foetal, Humains, Nouveau-né, Ligands, Système lymphatique, Modèles animaux, Modèles biologiques, Protéines tissu nerveux, Récepteurs de surface cellulaire, Récepteurs Notch, Transduction du signal |
C’est en 1917 que Thomas Morgan décrit pour la première fois une souche de drosophile mutante présentant des encoches à l’extrémité de ses ailes en raison d’une mutation dans un gène nommé alors notch (Figure 1). Les mutations dans le gène codant l’un des ligands du récepteur Notch induisent quant à elles un épaississement des veines de l’aile en forme de Delta. La voie de signalisation Notch a été conservée au cours de l’évolution et contrôle l’engagement d’un progéniteur dans une voie de différenciation donnée [
1,
2].  | Figure 1.
Souche de drosophile mutante (Thomas Morgan, 1917). |
Elle est essentielle à de nombreux processus au cours du développement et chez l’adulte, tels que la neurogenèse, l’hématopoïèse ou encore la différenciation des cellules épithéliales de l’intestin [
3]. La transduction du signal est déclenchée par l’interaction entre un récepteur Notch et l’un de ses ligands, chacun exprimé à la surface de deux cellules voisines. Il existe chez les mammifères quatre récepteurs Notch (1 à 4) et cinq ligands, Delta1, -3 et -4 et Jagged1, -2. Cette interaction ligand-récepteur induit deux clivages protéolytiques successifs du récepteur Notch, libérant un domaine intracellulaire actif Notch-IC, qui migre dans le noyau où il participe avec les facteurs CSL/RBPJκ et Mastermind à un complexe activateur de la transcription. Ce complexe active l’expression de gènes cibles, dont les plus connus sont les facteurs de transcription de la famille bHLH : HES (hairy enhancer of split) [
4] (Figure 1B). |
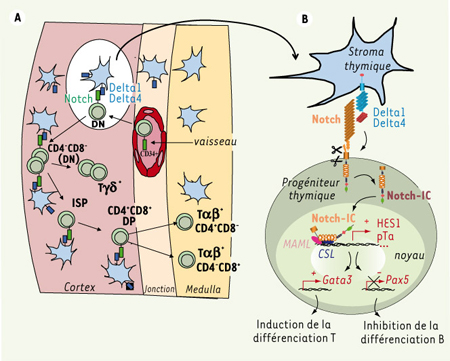
Rôle de la signalisation Notch dans la lymphopoïèse L’implication de Notch dans des translocations chromosomiques impliquées dans des leucémies aiguës lymphoblastiques T a constitué le premier pas vers la mise en évidence du rôle clé de cette molécule dans le développement lymphoïde [2]. Ce rôle a été confirmé par des expériences d’inactivation conditionnelle de Notch1 à la naissance ou de surexpression de la forme active Notch-IC chez la souris. Alors que l’inactivation de Notch1 conduit à un blocage complet de la différenciation lymphoïde T et au développement ectopique de lymphocytes B dans le thymus [
5], son expression sous forme constitutivement active induit le développement ectopique de lymphocytes T dans la moelle osseuse et une inhibition simultanée du développement lymphoïde B au stade pro-B [
6]. Ces travaux démontrent donc que la signalisation via le récepteur Notch1 joue un rôle fondamental dans l’induction de la différenciation lymphoïde T via, entre autres, l’activation du gène pTα, et l’inhibition du développement lymphoïde B par la répression du facteur Pax 5, indispensable à l’initiation du développement lymphoïde B [
7] (Figure 1B). |
Les ligands Delta dans la différenciation lymphoïde T : rôle du microenvironnement Si le rôle du récepteur Notch est bien caractérisé, en revanche la question du ou des ligands responsable(s) du contrôle de la différenciation lymphoïde est restée longtemps en suspens. L’activation de la signalisation Notch dans le compartiment hématopoïétique met en jeu une communication intercellulaire entre les cellules souches hématopoïétiques (CSH) et les cellules stromales qui constituent leur microenvironnement. L’analyse comparative du profil d’expression des ligands de Notch dans la moelle osseuse et le thymus murins a révélé que les ligands Delta1 et Delta4 ont une expression restreinte au microenvironnement thymique et sont particulièrement concentrés dans la région corticale et à la jonction corticomédullaire où arrivent via la circulation les progéniteurs lymphoïdes produits dans la moelle osseuse et où se produisent les premières étapes du développement thymique [
8] (Figure 2A). Les ligands Jagged1/2 sont quant à eux exprimés à la fois dans la moelle osseuse et dans le thymus. Le rôle primordial des ligands de la famille Delta dans l’induction de la différenciation lymphoïde T a été confirmé par des expériences menées chez la souris nude naturellement dépourvue de thymus. La surexpression ectopique du ligand Delta1 ou Delta4 dans les CSH de ces souris, mais pas celle de Jagged1, conduit à un développement de lymphocytes T dans la moelle osseuse [
9].  | Figure 2.
Architecture thymique chez l’adulte et transduction du signal Delta/Notch. A. Le thymus est colonisé par un progéniteur pluripotent, exprimant le marqueur CD34+, au niveau de la jonction cortico-médullaire. L’interaction de ce progéniteur avec les cellules épithéliales corticales environnantes qui expriment le ligand Delta1 et/ou Delta4 induit l’engagement dans le lignage lymphoïde T (voir agrandissement en B). Ce progéniteur passe alors par plusieurs stades successifs de différenciation au sein du cortex, régulés par la signalisation Delta/Notch: cellules double-négatives CD4-CD8- (DN), immatures simple-positives CD4+ (ISP), doubles positives CD4+CD8+ (DP). Les lymphocytes T exprimant le TCRγδ sont également engendrés au sein du cortex et dérivent des cellules DN. Au cours de l’étape DP, les précurseurs thymiques exprimant le TCRαβ à leur surface reconnaissent l’un des deux complexes majeurs d’histocompatibilité CMH, et se différencient en précurseurs simple-positifs CD4+ (SP4) ou CD8+ (SP8) qui vont achever leur maturation dans la région médullaire. B. À la suite de l’interaction avec l’un de ses ligands Delta, le récepteur Notch subit deux clivages protéolytiques qui libèrent le domaine intracellulaire du récepteur Notch-IC dans le cytoplasme. Notch-IC migre alors dans le noyau où il participe à un complexe activateur de la transcription avec les facteurs CSL et Mastermind (MAML), qui active les gènes cibles tels que HES1 ou encore la chaîne α du pré-TCR, pTa. S’ensuit une cascade d’événements transcriptionnels, entre autres l’activation du gène Gata3 favorisant l’engagement dans le lignage lymphoïde T et la répression du gène Pax5, inhibant ainsi l’engagement dans le lignage lymphoïde B. |
Ainsi, la surexpression de l’un des ligands Delta permet à elle seule d’induire un engagement dans la voie lymphoïde T. Les mécanismes par lesquels ces deux ligands particuliers Delta1/4 entraînent cet effet ne sont pas encore bien compris. Une particularité de Delta1 réside dans l’existence d’un motif de reconnaissance des domaines PDZ, qui lui permet de réguler la motilité cellulaire [
10]. Les propriétés intrinsèques des ligands Delta pourraient ainsi favoriser les connexions entre les cellules stromales et participer à la constitution d’une niche thymique privilégiée permettant l’induction de la différenciation T. |
Différenciation lymphoïde T in vitro
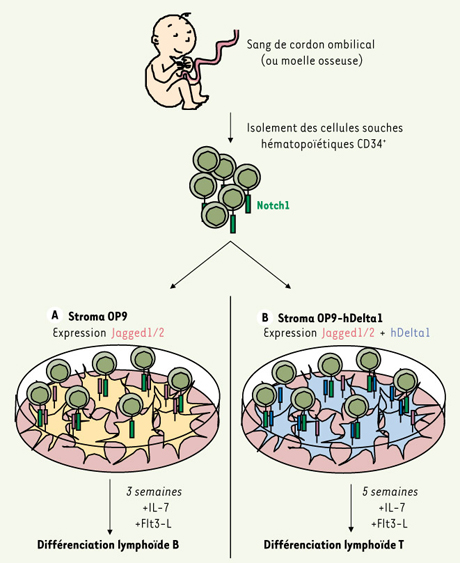
La mise en évidence du rôle essentiel des ligands Delta dans le développement lymphoïde T a eu une application majeure : le développement d’un système de différenciation lymphocytaire T in vitro constituant une alternative très intéressante au système de culture organotypique de thymus fœtal jusqu’alors utilisé, difficile à manipuler et peu efficace. L’équipe de J.C. Zúñiga-Pflücker a ainsi démontré que la surexpression de Delta1 dans la lignée stromale murine de moelle osseuse OP9 induit deux effets notables : la lignée OP9-mDelta1 perd sa capacité de permettre la lymphopoïèse B, et acquiert celle d’induire le développement de lymphocytes T immatures double-positifs CD4+CD8+ ainsi que de lymphocytes T matures simple-positif CD8+ SP[
11] (Figure 3). 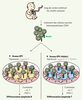 | Figure 3.
Modèles de différenciation lymphoïde humaine in vitro. Les cellules souches hématopoïétiques (CSH) humaines portant le marqueur de surface CD34+ et dont une partie exprime le récepteur Notch1, sont isolées à partir de sang de cordon ombilical ou de la moelle osseuse adulte. Les CSH sont alors cultivées pendant plusieurs semaines en présence de cytokines (IL-7 et ligand de Flt3 [Flt3-L]) et d’un support de cellules stromales qui miment soit le microenvironnement médullaire de la moelle osseuse (OP9), soit le microenvironnement thymique (OP9-hDelta1). A. Le stroma OP9 est une lignée dérivée de la moelle osseuse de souris M-CSF−/−
(macrophage-colony-stimulating factor, M-CSF) et qui exprime de manière endogène les ligands Jagged1 et Jagged2. Ce stroma induit au bout de trois semaines une différenciation lymphoïde B des CSH et reproduit ainsi la différenciation observée dans la moelle osseuse. B. Le stroma OP9-hDelta1 est dérivé de la lignée OP9 décrite précédemment en y surexprimant le ligand Delta1 humain de manière ectopique. L’expression du ligand Delta1 induit une inhibition complète du développement B et conduit après environ 5 semaines à une différenciation lymphoïde T. Ce stroma permet de reproduire in vitro les étapes précoces de la différenciation thymique jusqu’au stade DP et lymphocytes T γδ. NB : Des résultats analogues sont obtenus à partir de CSH murines mises en culture avec la lignée OP9 ou OP9-mDelta1. |
Chez l’homme, les étapes précoces du développement T sont mal connues, du fait de l’absence de modèles d’études efficaces. Une avancée cruciale a donc été franchie dans l’étude de la lymphopoïèse humaine grâce à l’adaptation du système de culture OP9-Delta1 à la différenciation T à partir de progéniteurs humains [
12,
13] (Figure 3). Notre équipe a développé ce système biologique en construisant une lignée OP9 exprimant le ligand Delta1 humain (OP9-hDelta1). Nous avons ainsi pu suivre les étapes de la lymphopoïèse en partant de différentes populations cellulaires isolées du sang de cordon ou de moelle osseuse humaine. Après quatre semaines de coculture avec la lignée OP9-hDelta1, les CSH se différencient de manière reproductible en lymphocytes T CD4+CD8+ DP et en lymphocytes T TCRγδ+. Une semaine supplémentaire est nécessaire pour observer l’apparition de quelques lymphocytes T matures exprimant le récepteur T à l’antigène TCRαβ+. Le biais de développement vers la lignée T TCRγδ+ au détriment de la lignée T TCRαβ+, observé de manière constante dans ce système de culture, pourrait s’expliquer par l’absence de CMH (complexe majeur d’histocompatibilité) humains dans ce système, ou par l’implication de Notch à d’autres stades de différenciation T dans la régulation des réarrangements des gènes codant la chaîne β du TCR, le contrôle des décisions αβ versus γδ ou encore CD4 versus CD8 [
14]. Au-delà de cette observation, l’intérêt majeur de ce système de différenciation in vitro est de permettre des analyses fines des premières étapes de différenciation T, l’identification des progéniteurs hématopoïétiques investis d’un potentiel T au sein d’une population hétérogène, l’identification de l’impact de diverses cytokines et facteurs de croissance sur la différenciation T. Il a été ainsi démontré que le ligand Delta1 purifié permettait à lui seul l’engagement des CSH dans la voie de différenciation T, avec un effet dose important [
15], mais que l’obtention de cellules T matures nécessitait la présence d’un stroma (OP9 dans ce système). Afin de modéliser de manière plus fidèle le microenvironnement thymique, des systèmes dérivés devront être explorés afin de définir la combinaison idéale de cytokines, ainsi que les molécules impliquées dans les étapes de sélection positive et négative, telles que les composants du CMH ou AIRE1 qu’il faudrait ajouter pour compléter les étapes terminales de la différenciation. Ainsi, si nos avancées dans la définition des acteurs des niches hématopoïétiques tels que les ligands Delta nous ont d’ores et déjà permis d’engendrer des lymphocytes T humain in vitro, ce n’est qu’une première étape ouvrant de nombreuses perspectives dans l’étude des pathologies du système immunitaire et leur correction par thérapie génique ou cellulaire. La première de ces perspectives pourrait concerner le problème majeur de la reconstitution immunitaire après greffe de cellules souches hématopoïétiques partiellement incompatibles, dont la résolution repose sur l’identification de progéniteurs lymphoïdes capables de rapidement se différencier en lymphocytes T. |
Footnotes |
1. Brou C, Logeat F. Endocytose et voie de signalisation Notch. Med Sci (Paris) 2006; 22 : 685–8. 2. Kastner P, Chan S. La voie Notch au centre du mécanisme de leucémogenèse dans un modèle murin de leucémies T. Med Sci (Paris) 2006; 22 :708–10. 3. Robine S, Fre S, Huyghe M, et al. Notch, un gène clé de l’équilibre entre prolifération et différenciation des cellules épithéliales de l’intestin. Med Sci (Paris) 2005; 21 : 780–2. 4. Schweisguth F. Notch signaling activity. Curr Biol 2004; 14 : R129–38. 5. Radtke F, Wilson A, Stark G, et al. Deficient T cell fate specification in mice with an induced inactivation of Notch1. Immunity 1999; 10 : 547–58. 6. Pui JC, Allman D, Xu L, et al. Notch1 expression in early lymphopoiesis influences B versus T lineage determination. Immunity 1999; 11 : 299–308. 7. Hoflinger S, Kesavan K, Fuxa M, et al. Analysis of notch1 function by in vitro T cell differentiation of pax5 mutant lymphoid progenitors. J Immunol 2004; 173 : 3935–44. 8. Schmitt TM, Ciofani M, Petrie HT, et al. Maintenance of T cell specification and differentiation requires recurrent notch receptor-ligand interactions. J Exp Med 2004; 200 : 469–79. 9. De La Coste A, Six E, Fazilleau N, et al.
In vivo and in absence of a thymus, the enforced expression of the Notch ligands delta-1 or delta-4 promotes T cell development with specific unique effects. J Immunol 2005; 174 : 2730–7. 10. Six EM, Ndiaye D, Sauer G, et al. The notch ligand Delta1 recruits Dlg1 at cell-cell contacts and regulates cell migration. J Biol Chem 2004; 279 : 55818–26. 11. Schmitt TM, Zuniga-Pflucker JC. Induction of T cell development from hematopoietic progenitor cells by delta-like-1 in vitro. Immunity 2002; 17 : 749–56. 12. La Motte-Mohs RN, Herer E, Zuniga-Pflucker JC. Induction of T-cell development from human cord blood hematopoietic stem cells by Delta-like 1 in vitro. Blood 2005; 105 : 1431–9. 13. De Smedt M, Hoebeke I, Plum J. Human bone marrow CD34+ progenitor cells mature to T cells on OP9-DL1 stromal cell line without thymus microenvironment. Blood Cells Mol Dis 2004; 33 : 227–32. 14. Maillard I, Fang T, Pear WS. Regulation of lymphoid development, differentiation, and function by the Notch pathway. Annu Rev Immunol 2005; 23 : 945–74. 15. Delaney C, Varnum-Finney B, Aoyama K, et al. Dose-dependent effects of the Notch ligand Delta1 on ex vivo differentiation and in vivo marrow repopulating ability of cord blood cells. Blood 2005; 106 : 2693–9. |