La majorité des tissus adultes continuent à se renouveler tout au long de la vie. Ce processus de renouvellement constant, appelé homéostasie tissulaire, requiert au sein de ces tissus la présence de cellules souches (CS). Les CS adultes sont également nécessaires à la réparation des tissus endommagés suite à divers traumatismes. Les CS épithéliales du follicule pileux (CSF) sont un excellent modèle pour l’étude des CS adultes. Tout au long de la vie, le follicule pileux alterne des cycles de régénération (anagène), de dégénérescence (catagène) et de repos (télogène). Les CSF résident dans un microenvironnement spécialisé appelé bulge et présentent, comme d’autres cellules souches épithéliales, la caractéristique de proliférer plus rarement que les cellules plus différenciées qu’elles engendrent. À chaque cycle de régénération du follicule pileux, les CS du bulge sont activées et engendrent par division cellulaire des progéniteurs qui vont s’amplifier transitoirement et se différencier dans les différents types cellulaires du follicule pileux [ 1].
Notre groupe a développé de nouvelles méthodes qui permettent d’isoler aisément et spécifiquement les CSF [ 2– 4]. Nous avons démontré que les CS du follicule pileux pouvaient être subdivisées en deux sous-populations, selon qu’elles adhèrent ou non à la membrane basale. Dans leur environnement naturel, ces deux sous-populations cellulaires sont quiescentes, mais elles peuvent s’auto-renouveler in vivo et in vitro. Nous avons montré que les CSF étaient multipotentes, c’est-à-dire que les descendants d’une seule CS étaient capables de se différencier en tous les sous-types cellulaires qui composent l’épithélium cutané [ 3].
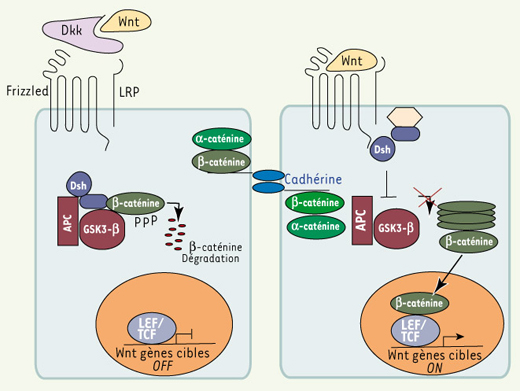
La voie de signalisation intracellulaire Wnt/β-caténine est très conservée depuis le nématode jusqu’à l’homme et contrôle un très grand nombre de décisions cellulaires au cours du développement embryonnaire et durant la vie adulte (voir The Wnt homepage : http://www.stanford.edu/~rnusse/wntwindow.html). Le dérèglement de cette voie de signalisation est impliqué dans le développement de nombreux cancers chez l’homme. La β-caténine se lie à des protéines d’adhérence nommées cadhérines au niveau des jonctions cellulaires, mais elle a aussi la capacité de se lier à des facteurs de transcription de la famille LEF/TCF et de stimuler leur activité transcriptionnelle. Normalement, la β-caténine est localisée majoritairement au niveau des jonctions cellulaires et l’excès de β-caténine produite est constamment dégradé. L’activation de la cascade de signalisation Wnt/β-caténine se produit lorsqu’un ligand de la famille Wnt (ou wingless chez la drosophile), une glycoprotéine sécrétée, se lie à son récepteur (Frizzled). L’association ligand récepteur stimule une cascade d’événements moléculaires qui conduira à la stabilisation et l’accumulation de β-caténine, lui permettant de se lier aux facteurs de transcription de la famille LEF/TCF et de stimuler la transcription de leurs gènes cibles (Figure 1). Dans la peau, la cascade de signalisation Wnt/β-caténine joue un rôle fondamental lors la morphogenèse folliculaire, la maintenance et l’activation des CS adultes, la différenciation cellulaire et le développement de cancers cutanés. Le rôle incontournable de la voie Wnt/β-caténine lors du développement embryonnaire du follicule pileux a été montré par l’absence de formation de follicule pileux chez les souris dont le gène de la β-caténine a été invalidé dans la peau, ou lors de l’expression constitutive d’un inhibiteur soluble des protéines Wnt [ 5, 6] (Figure 2A).
| Figure 1.
Voie de signalisation Wnt/β-caténine. En l’absence de signal Wnt, l’excès de β-caténine cytoplasmique est dégradé par le protéasome. En présence de ligand de la famille Wnt, le complexe récepteur-corécepteur (Frizzled-LRP), recrute à la membrane plasmique certains composants du complexe macromoléculaire qui normalement stimule la dégradation de β-caténine. L’ excès de β-caténine cytoplasmique peut maintenant être transporté vers le noyau et s’ associer aux facteurs de transcription de la famille LEF/TCF et permettre l’ activation transcriptionelle de leurs gènes cibles. LEF : lymphoid enhancer factor-1 (LEF-1) ; TCF : T cell factor. Dsh : dishevelled ; Dkk : Dickkopf (wnt inhibiteur) ; APC : adenomatous polyposis coli.
|
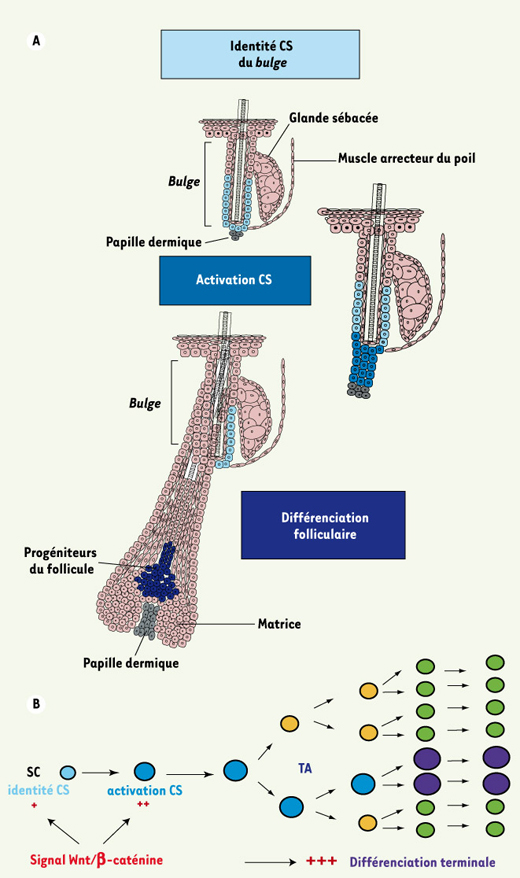
| Figure 2.
Rôles de la voie Wnt/β-caténine dans la régulation des cellules souches épidermiques. A. Les études génétiques par gain et perte de fonction chez la souris ont permis de montrer le rôle crucial de la voie de signalisation Wnt/β-caténine durant la morphogenèse et l’ homéostasie de l’ épiderme adulte. Durant le cycle folliculaire, la voie Wnt/β-caténine est nécessaire au maintien de l’ identité cellulaire des CSF, rappelant son rôle fondamental durant le développement folliculaire embryonnaire. Lors de la transition entre la phase de repos et la phase de croissance folliculaire, la voie Wnt/β-caténine permet l’ activation et la prolifération des CSF normalement quiescentes, ce qui stimule la régénération d’un nouveau poil. La voie Wnt est finalement activée lors de la différenciation terminale des précurseurs des cellules du poil. B. L’intensité du signal Wnt/β-caténine et le type cellulaire recevant le signal, détectés par l’ expression tissulaire de la forme nucléaire de β-caténine, vont déterminer l’ effet de la voie Wnt sur les CSF. Un faible signal est nécessaire pour maintenir l’ identité des CSF, un signal plus important va permettre l’ activation des CSF et un signal encore plus intense accompagne la différenciation terminale des cellules du poil. |
Le rôle de la voie Wnt/β-caténine dans la spécification des cellules épidermiques en cellules folliculaires persiste à l’âge adulte car les souris transgéniques qui expriment une forme constitutivement active de la β-caténine dans l’épiderme présentent une formation de novo de follicule pileux qui peut dégénérer en tumeur folliculaire [ 7]. Chez l’homme, la majorité des tumeurs folliculaires de type pilomatricome1 présentent aussi des mutations activatrices de la β-caténine [ 8].
L’analyse transcriptionnelle des CS du bulge suggère que ces cellules résident dans un microenvironnement dans lequel la voie Wnt serait inhibée [2–4]. En effet, les CSF expriment préférentiellement plusieurs inhibiteurs solubles des Wnt (sFRP1, Dkk3, Wif) et expriment très peu de Wnt (Wnt3a). Cependant ces CS expriment de nombreux récepteurs pour les Wnts (Fz2, 3 et 7) leur permettant de percevoir la présence de Wnt, ainsi que certains facteurs de transcription (Tcf3/Tcf4) qui leur permettent de relayer le signal Wnt perçu.
Plusieurs études récentes ont montré que la voie Wnt/β-caténine est également impliquée dans la régénération folliculaire chez l’adulte. L’expression d’une forme active de β-caténine lors de la phase de repos du follicule pileux entraîne une accélération de la phase de régénération du poil [ 9– 11] (Figure 2A). Malgré leur activation précoce lors de l’expression continue d’une forme active de β-caténine, les CSF retournent à un état quiescent lorsque le nouveau poil a atteint une certaine taille, suggérant que d’autres facteurs en plus de ceux de la voie Wnt/β-caténine sont requis pour l’activation des CS [11]. Un des candidats potentiel est Noggin, un inhibiteur soluble de la voie BMP (bone morphogenetic protein), sécrété par le mésenchyme sous-jacent et qui augmente l’expression de Lef1 [ 12]. Malgré la présence continue de β-caténine activée, la taille de la niche des CSF n’augmente pas dans le temps, ce qui suggère que si β-caténine stimule le renouvellement des CSF, cette augmentation de prolifération doit être accompagnée d’un départ des CS hors de leur niche [11].
Afin de déterminer le mécanisme moléculaire par lequel la stabilisation de β-caténine induit l’activation des CSF, nous avons déterminé le profil transcriptionnel des CSF dans les phases de repos et active du cycle folliculaire et en présence ou en l’absence de β-caténine activée [11]. L’expression de gènes qui contrôle la prolifération cellulaire et le remodelage de la matrice extracellulaire est augmentée à la fois lors de la croissance folliculaire et en présence de β-caténine activée, suggérant que ces gènes pourraient être activés directement par la voie Wnt/β-caténine lors de la transition entre repos et activation. L’analyse par bio-informatique des séquences régulatrices de ces gènes révèle que certains d’entre eux présentent des sites de liaison conservés pour les facteurs de transcription de la famille LEF/TCF. L’analyse par immunoprécipitation de chromatine a permis de montrer que ces séquences régulatrices pouvaient être occupées in vivo par un complexe contenant β-caténine, ce qui suggère fortement que ces gènes pourraient être directement contrôlés par l’activation de la voie Wnt/β-caténine dans la peau. Certains de ces gènes (cycline D1, Biglycan, TIMP3), lorqu’ils sont surexprimés, augmentent la prolifération des CS in vitro [11].
En conclusion, la voie de signalisation Wnt/β-caténine intervient à plusieurs niveaux dans la régulation des CSF (Figure 2b). (1) La voie Wnt/β-caténine est indispensable à l’acquisition de l’identité folliculaire au cours du développement ; (2) l’activation de la voie Wnt/β-caténine stimule l’activation des CSF, leur prolifération, et la régénération folliculaire ; (3) la stabilisation de β-caténine est impliquée dans la différenciation terminale des cellules du follicule pileux ; (4) la stimulation continue de cette voie de signalisation conduit à long terme au développement de tumeurs cutanées.