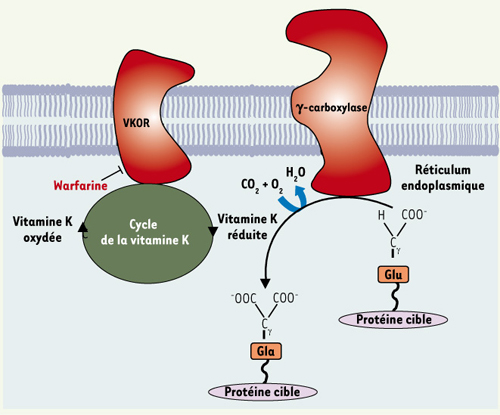
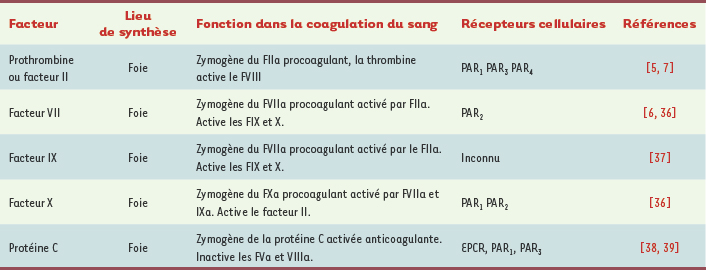
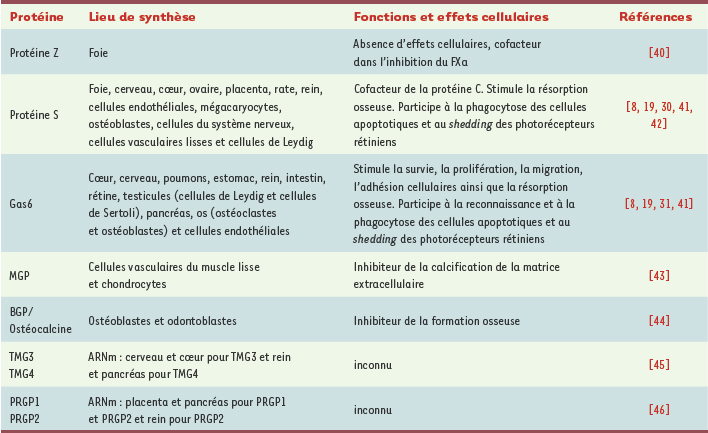
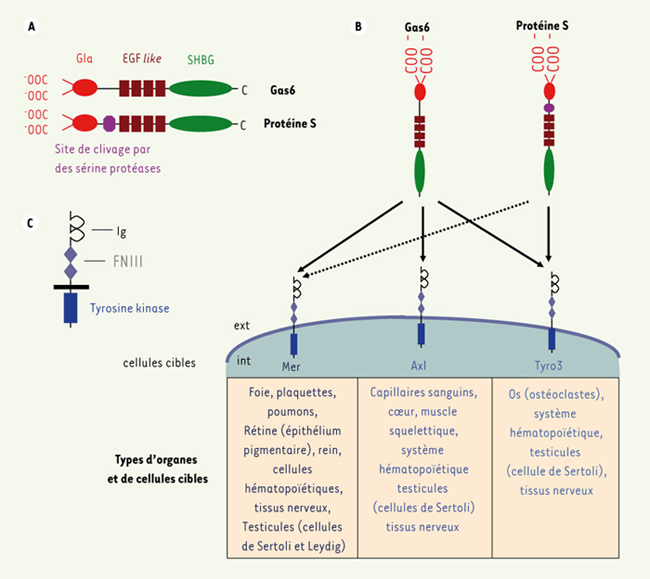
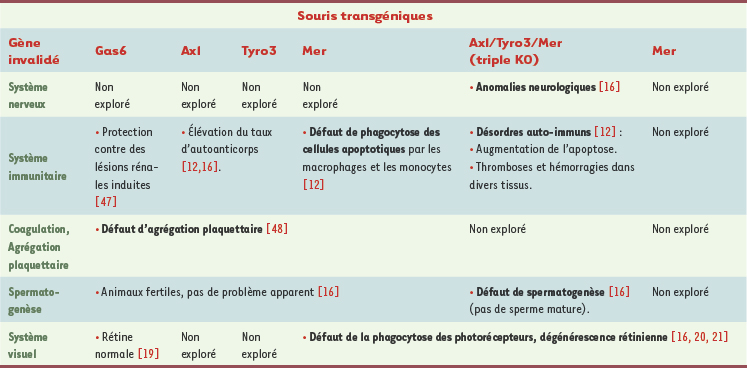
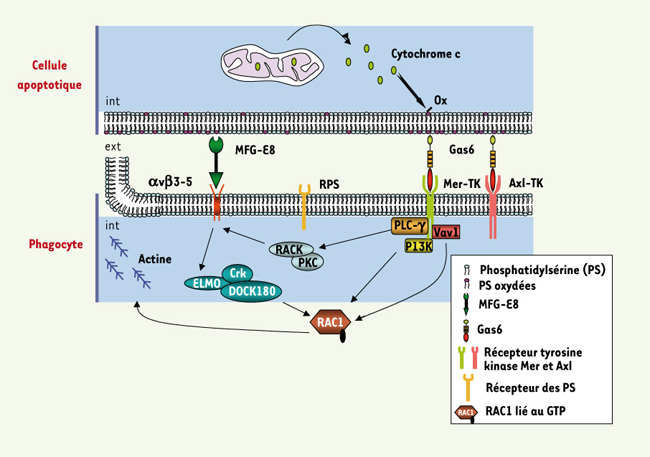
1.
Mann KG, Nesheim ME, Church WR, et al. Surface-dependent reactions of the vitamin K-dependent enzyme complexes. Blood 1990; 76 : 1–16.
2.
Wallin R, Hutson SM. Warfarin and the vitamin K-dependent gamma-carboxylation system. Trends Mol Med 2004; 10 : 299–302.
3.
Furie B, Bouchard BA, Furie BC. Vitamin K-dependent biosynthesis of gamma-carboxyglutamic acid. Blood 1999; 93 : 1798–808.
4.
Scully M. Warfarin therapy. The Biochemist 2002; 24 : 15–7.
5.
Preissner KT, Nawroth PP, Kanse SM. Vascular protease receptors : integrating haemostasis and endothelial cell functions. J Pathol 2000; 190 : 360–72.
6.
Carmeliet P. Biomedicine. Clotting factors build blood vessels. Science 2001; 293 : 1602–4.
7.
Leger AJ, Covic L, Kuliopulos A. Protease-activated receptors in cardiovascular diseases. Circulation 2006; 114 : 1070–7.
8.
Manfioletti G, Brancolini C, Avanzi G, Schneider C. The protein encoded by a growth arrest-specific gene (gas6) is a new member of the vitamin K-dependent proteins related to protein S, a negative coregulator in the blood coagulation cascade. Mol Cell Biol 1993; 13 : 4976–85.
9.
He X, Shen L, Bjartell A, Dahlback B. The gene encoding vitamin K-dependent anticoagulant protein S is expressed in multiple rabbit organs as demonstrated by northern blotting, in situ hybridization, and immunohistochemistry. J Histochem Cytochem 1995; 43 : 85–96.
10.
Prasad D, Rothlin CV, Burrola P, et al. TAM receptor function in the retinal pigment epithelium. Mol Cell Neurosci 2006; 33 : 96–108.
11.
Hafizi S, Dahlback B. Signalling and functional diversity within the Axl subfamily of receptor tyrosine kinases. Cytokine Growth Factor Rev 2006; 17 : 295–304.
12.
Lu Q, Lemke G. Homeostatic regulation of the immune system by receptor tyrosine kinases of the Tyro 3 family. Science 2001; 293 : 306–11.
13.
Demarchi F, Verardo R, Varnum B, et al. Gas6 anti-apoptotic signaling requires NF-kappa B activation. J Biol Chem 2001; 276 : 31738–44.
14.
Sharif MN, Sosic D, Rothlin CV, et al. Twist mediates suppression of inflammation by type I IFNs and Axl. J Exp Med 2006; 203 : 1891–901.
15.
Scott RS, McMahon EJ, Pop SM, et al. Phagocytosis and clearance of apoptotic cells is mediated by MER. Nature 2001; 411 : 207–11.
16.
Lu Q, Gore M, Zhang Q, et al. Tyro-3 family receptors are essential regulators of mammalian spermatogenesis. Nature 1999; 398 : 723–8.
17.
Prieto AL, Weber JL, Lai C. Expression of the receptor protein-tyrosine kinases Tyro-3, Axl, and mer in the developing rat central nervous system. J Comp Neurol 2000; 425 : 295–314.
18.
Romero EE, Velazquez-Estades LJ, Deo R et al. Cloning of rat vitamin K-dependent gamma-glutamyl carboxylase and developmentally regulated gene expression in postimplantation embryos. Exp Cell Res 1998; 243 : 334–46.
19.
Hall MO, Obin MS, Heeb MJ, et al. Both protein S and Gas6 stimulate outer segment phagocytosis by cultured rat retinal pigment epithelial cells. Exp Eye Res 2005; 81 : 581–91.
20.
D’Cruz PM, Yasumura D, Weir J, et al. Mutation of the receptor tyrosine kinase gene Mertk in the retinal dystrophic RCS rat. Hum Mol Genet 2000; 9 : 645–51.
21.
Duncan JL, LaVail MM, Yasumura D, et al. An RCS-like retinal dystrophy phenotype in mer knockout mice. Invest Ophthalmol Vis Sci 2003; 44 : 826–38.
22.
Katagiri M, Hakeda Y, Chikazu D, et al. Mechanism of stimulation of osteoclastic bone resorption through Gas6/Tyro 3, a receptor tyrosine kinase signaling, in mouse osteoclasts. J Biol Chem 2001; 276 : 7376–82.
23.
Pierre-Jacques H, Glueck CJ, Mont MA, et al. Familial heterozygous protein-S deficiency in a patient who had multifocal osteonecrosis. A case report. J Bone Joint Surg Am 1997; 79 : 1079–84.
24.
Angelillo-Scherrer A, Burnier L, Flores N, et al. Role of Gas6 receptors in platelet signaling during thrombus stabilization and implications for antithrombotic therapy. J Clin Invest 2005; 115 : 237–46.
25.
Jiang J, Kini V, Belikova N, et al. Cytochrome c release is required for phosphatidylserine peroxidation during Fas-triggered apoptosis in lung epithelial A549 cells. Lipids 2004; 39 : 1133–42.
26.
Fadok VA, Bratton DL, Rose DM, et al. A receptor for phosphatidylserine-specific clearance of apoptotic cells. Nature 2000; 405 : 85–90.
27.
Cohen PL, Caricchio R, Abraham V, et al. Delayed apoptotic cell clearance and lupus-like autoimmunity in mice lacking the c-mer membrane tyrosine kinase. J Exp Med 2002; 196 : 135–40.
28.
Nakano T, Ishimoto Y, Kishino J, et al. Cell adhesion to phosphatidylserine mediated by a product of growth arrest-specific gene 6. J Biol Chem 1997; 272 : 29411–4.
29.
Neubauer A, Fiebeler A, Graham DK, et al. Expression of axl, a transforming receptor tyrosine kinase, in normal and malignant hematopoiesis. Blood 1994; 84 : 1931–41.
30.
Anderson HA, Maylock CA, Williams JA, et al. Serum-derived protein S binds to phosphatidylserine and stimulates the phagocytosis of apoptotic cells. Nat Immunol 2003; 4 : 87–91.
31.
Wu Y, Tibrewal N, Birge RB. Phosphatidylserine recognition by phagocytes : a view to a kill. Trends Cell Biol 2006; 16 : 189–97.
32.
Brugnera E, Haney L, Grimsley C, et al. Unconventional Rac-GEF activity is mediated through the Dock180-ELMO complex. Nat Cell Biol 2002; 4 : 574–82.
33.
Todt JC, Hu B, Curtis JL. The receptor tyrosine kinase MerTK activates phospholipase C gamma2 during recognition of apoptotic thymocytes by murine macrophages. J Leukoc Biol 2004; 75 : 705–13.
34.
Stitt TN, Conn G, Gore M, et al. The anticoagulation factor protein S and its relative, Gas6, are ligands for the Tyro 3/Axl family of receptor tyrosine kinases. Cell 1995; 80 : 661–70.
35.
McKay D, Marron C, Brown R. Testicular infarction secondary to protein S deficiency : a case report. BMC Urol 2006; 6 : 17.
36.
Feistritzer C, Lenta R, Riewald M. Protease-activated receptors-1 and -2 can mediate endothelial barrier protection : role in factor Xa signaling. J Thromb Haemost 2005; 3 : 2798–805.
37.
Yang X, Walsh PN. An ordered sequential mechanism for factor IX and factor IXa binding to platelet receptors in the assembly of the factor X-activating complex. Biochem J 2005; 390 : 157–67.
38.
Guo H, Liu D, Gelbard H, et al. Activated protein C prevents neuronal apoptosis via protease activated receptors 1 and 3. Neuron 2004; 41 : 563–72.
39.
Domotor E, Benzakour O, Griffin JH, et al. Activated protein C alters cytosolic calcium flux in human brain endothelium via binding to endothelial protein C receptor and activation of protease activated receptor-1. Blood 2003; 101 : 4797–801.
40.
Broze GJ Jr. Protein Z-dependent regulation of coagulation. Thromb Haemost 2001; 86 : 8–13.
41.
Hafizi S, Dahlback B. Gas6 and protein S. Vitamin K-dependent ligands for the Axl receptor tyrosine kinase subfamily. FEBS J 2006; 273 : 5231–44.
42.
Maillard C, Berruyer M, Serre CM, et al. Protein-S, a vitamin K-dependent protein, is a bone matrix component synthesized and secreted by osteoblasts. Endocrinology 1992; 130 : 1599–604.
43.
Murshed M, Schinke T, McKee MD, Karsenty G. Extracellular matrix mineralization is regulated locally; different roles of two gla-containing proteins. J Cell Biol 2004; 165 : 625–30.
44.
Ducy P, Desbois C, Boyce B, et al. Increased bone formation in osteocalcin-deficient mice. Nature 1996; 382 : 448–52.
45.
Kulman JD, Harris JE, Xie L, Davie EW. Identification of two novel transmembrane gamma-carboxyglutamic acid proteins expressed broadly in fetal and adult tissues. Proc Natl Acad Sci USA 2001; 98 : 1370–5.
46.
Kulman JD, Harris JE, Haldeman BA, Davie EW. Primary structure and tissue distribution of two novel proline-rich gamma-carboxyglutamic acid proteins. Proc Natl Acad Sci USA 1997; 94 : 9058–62.
47.
Yanagita M, Ishimoto Y, Arai H, et al. Essential role of Gas6 for glomerular injury in nephrotoxic nephritis. J Clin Invest 2002; 110 : 239–46.
48.
Angelillo-Scherrer A, de Frutos P, Aparicio C, et al. Deficiency or inhibition of Gas6 causes platelet dysfunction and protects mice against thrombosis. Nat Med 2001; 7 : 215–21.