| |
| Med Sci (Paris). 2007 October; 23(10): 840–844. Published online 2007 October 15. doi: 10.1051/medsci/20072310840.SIRT1/PGC-1 Un axe neuroprotecteur ? Soumya Rasouri,1 Marie Lagouge,1 and Johan Auwerx1,2* 1Institut de Génétique et de Biologie Moléculaire et Cellulaire, CNRS/Inserm/ULP, 1, rue Laurent Fries, 67404 Illkirch, France 2Institut Clinique de la Souris, 67404 Illkirch, France |
Dans nos populations occidentalisées vieillissantes, les maladies neurodégénératives touchent environ 2 % des individus. Il existe un très grand nombre de pathologies neurodégénératives différentes qui partagent cependant comme caractéristique commune la perte de fonction progressive des cellules neuronales aboutissant à la mort cellulaire. De façon intéressante, dysfonctionnements mitochondriaux et maladies neurodégénératives sont souvent corrélés. Nous soulignons ici cette corrélation, en mettant l’accent sur un axe de signalisation émergent, coordonné par les cofacteurs SIRT1 et PGC-1 (peroxisome proliferator-activated receptor gamma co activator 1), potentiellement impliqué dans la protection contre ces dysfonctionnements mitochondriaux et les pathologies neurodégénératives associées, et qui nous semble ouvrir des perspectives thérapeutiques non négligeables. |
Dysfonctionnements mitochondriaux et maladies neurodégénératives La sclérose latérale amyotrophique (SLA) est une maladie neurodégénérative qui touche les neurones du système moteur volontaire, et aboutit au décès du patient entre un et cinq ans après l’émergence de la maladie. L’étiologie de la SLA n’est pas encore totalement définie, la maladie faisant probablement intervenir divers processus pathogéniques, mais elle se manifeste par une paralysie progressive des muscles due à la mort cellulaire des neurones moteurs. Une des formes familiales de SAL est due à une mutation du gène codant la superoxyde dismutase 1 (SOD1) [
1], une enzyme de détoxification empêchant les dommages cellulaires causés par les radicaux libres (ROS, reactive oxygen species). Les symptômes et la progression de la pathologie chez les patients atteints d’une mutation du gène SOD1 sont similaires à ceux des patients atteints de la forme sporadique, ce qui suggère l’existence de points communs entre les mécanismes de ces deux formes de la SAL. SOD1 présente une localisation cytosolique mais également mitochondriale [
2] et, de façon intéressante, les patients atteints de la forme sporadique présentent des anomalies morphologiques au niveau des mitochondries des axones proximaux et de la moelle épinière [
3]. Un déficit d’activité des complexes I et IV de la chaîne respiratoire mitochondriale a également été rapporté [
4]. Il n’est pas encore possible d’établir avec certitude si les anomalies mitochondriales sont la cause ou la conséquence de la dégénérescence des neurones moteurs, mais ces deux phénomènes sont toutefois étroitement corrélés. La maladie d’Alzheimer (MA) est un désordre neurodégénératif progressif du cortex et de l’hippocampe, aboutissant à une altération cognitive. La présence de dégénérescences neurofibrillaires intracellulaires ainsi que de plaques β-amyloïdes (Aβ) extracellulaires dans ces régions liées à l’apprentissage et à la mémoire, sont caractéristiques de la MA [
5]. Des mutations de la protéine précurseur de l’amyloïde et des gènes de la préseniline 1 et 2 sont responsables de la forme familiale [5]. Les causes spécifiques de la forme sporadique ne sont pas encore connues, mais celle-ci a été corrélée au vieillissement et à des anomalies des mitochondries. Dans les deux formes de la pathologie, il y a accumulation de peptides Aβ. Préalablement à leur agrégation extracellulaire, les peptides Aβ interagissent physiquement avec la mitochondrie, affectant son fonctionnement et entraînant une production accrue de ROS [
6]. La maladie de Parkinson (MP), pathologie neurodégénérative elle aussi, est caractérisée au niveau clinique par la bradykinésie, le tremblement et la rigidité, et au niveau cellulaire par une perte des neurones dopaminergiques de la substance grise, et par la présence fréquente d’inclusions intraneuronales, les « corps de Lewy », principalement composés d’α-synucléine fibrillaire [
7]. Tout comme pour la SAL et la MA, la forme familiale de la MP ne concerne qu’une petite proportion des patients (10 %). La majorité d’entre eux est atteinte d’une forme sporadique et, si les causes génétiques sont relativement bien identifiées, les raisons de l’apparition de la forme sporadique sont au contraire encore obscures. L’implication des dysfonctionnements mitochondriaux dans la MP a été établie depuis plus d’une vingtaine d’années lorsque l’on a découvert que l’administration de 1-méthyl-4-phényl-1,2,3,4-tétrahydropyridine provoquait l’émergence du parkinsonisme chez les animaux de laboratoire mais également chez l’humain, par l’intermédiaire de son métabolite actif l’ion MPP+ qui inhibe le complexe I de la chaîne de transport d’électrons mitochondriale [
8]. Une déficience en activité du complexe I, et des dommages oxydatifs, comme des dommages causés à l’ADN et une peroxydation des lipides, ont été observés dans les neurones des patients. Le complexe I étant l’une des principales sources de production des radicaux libres, l’hypothèse est que l’altération de ses fonctions pourrait, au-delà de la diminution de la production d’ATP, donner lieu à un stress oxydatif accru, expliquant l’apparition de la pathologie. Dans les cas familiaux de parkinsonisme, des mutations au sein de cinq gènes, l’α-synucléine, la parkine, LRRK2, DJ-1 et PINK-1, ont été reconnues comme étant à l’origine de la maladie. Dans leur majorité, les produits de ces gènes tendent à affecter, plus ou moins directement, le fonctionnement mitochondrial, ne serait-ce que par leur localisation subcellulaire [7,
9]. La concordance des phénotypes familiaux et sporadiques de la MP suggère l’existence d’un mécanisme commun sous-jacent qui reste encore à préciser. La chorée, ou maladie de Huntington (MH), est une maladie autosomique dominante caractérisée par des lésions du striatum entraînant des altérations comportementales et cognitives progressives, ainsi que des mouvements choréiques involontaires. Cette pathologie est causée par la répétition du codon CAG dans le gène de la huntingtine. Cette répétition crée une accumulation de résidus glutamine dans la protéine correspondante. Cette protéine mutée exerce des fonctions toxiques via divers mécanismes dont un défaut de régulation transcriptionnelle. En effet, la huntingtine mutée peut se lier à des facteurs de transcription clés tels que CREBP (cAMP responsive element binding protein) et inhiber leurs fonctions transactivatrices. Une réduction de l’activité de plusieurs composants mitochondriaux, dont les complexes II, III et IV de la chaîne de transport d’électrons, est observée dans les neurones striataux chez les patients à un stade avancé de la maladie [
10]. La huntingtine mutée induirait également une réduction de la consommation d’oxygène (O2) et de la production d’ATP dans des neurones striataux en culture [
11]. Cela est sans doute à rapprocher du fait que l’expression de la molécule PGC-1a, impliquée dans la biogenèse et les fonctions mitochondriales, est réduite chez les patients atteints par la MH [
12]. La corrélation de ces observations permet de considérer que la mitochondrie est impliquée dans le développement de la MH. À travers cette rapide description de l’étiologie de la SAL, de la MH, de la MA et de la MP, force est de constater que les pathologies neurodégénératives sont, au moins pour une partie d’entre elles, étroitement associées à des dysfonctionnements mitochondriaux. Ces dysfonctionnements peuvent intervenir à différents niveaux dans la genèse de la pathologie et probablement s’amplifient mutuellement, rendant très difficile la détermination d’un facteur causal. Cependant, il est possible de les classer selon deux axes principaux : d’une part, la génération anormale de ROS et, d’autre part, le déficit de fourniture énergétique à la cellule, fonction pourtant primordiale de la mitochondrie. |
Fonctions mitochondriales et production de ROS La mitochondrie est un organite complexe dont les constituants sont codés à la fois par les génomes nucléaire et mitochondrial. La mitochondrie possède son propre ADN (ADNmt) ainsi que la machinerie enzymatique nécessaire à l’expression de ce dernier. L’ADNmt code treize sous-unités intervenant dans la formation des complexes I, III, IV et V de la chaîne respiratoire, les autres composants mitochondriaux sont codés par le génome nucléaire. La fonction principale de la mitochondrie est de générer de l’énergie sous forme d’ATP pour le fonctionnement cellulaire. Cette production d’ATP, effectuée par l’ATP synthétase, est couplée au système transporteur d’électrons (complexes I à IV) de la membrane interne mitochondriale. On parle de phosphorylation oxydative. L’oxydation contrôlée du NADH ou du FADH entraîne un passage des électrons dans le système transporteur d’électrons associé à la génération d’un potentiel d’énergie sous forme d’un gradient de protons à travers la membrane mitochondriale interne. Ce potentiel d’énergie est utilisé par l’ATP synthétase pour phosphoryler l’ADP et engendrer de l’ATP. Ce métabolisme mitochondrial a pour conséquence directe la production des ROS. Les ROS se forment lorsque des singulets d’électrons s’échappent de la chaîne de transport d’électrons mitochondriale et réagissent avec l’O2 moléculaire, produisant des superoxydes [
13]. Cette production de radicaux est particulièrement importante au niveau des complexes I et III [
14]. Les ROS sont néfastes pour le fonctionnement cellulaire puisqu’ils constituent un réservoir de pouvoir oxydant. Ils entraînent notamment la formation de 8-oxo-2’-désoxyguanosine qui endommage l’ADN lorsqu’il s’y incorpore. La cellule met en place deux stratégies pour lutter contre l’accumulation de ces ROS. Les enzymes détoxifiantes, SOD1, précédemment décrite, et SOD2, localisée dans la mitochondrie, catalysent la dismutation des superoxydes en oxygène moléculaire et en peroxyde d’hydrogène (H2O2). H2O2, également toxique, est ensuite transformé en eau par la catalase ou la glutathion transférase. D’autres protéines limitant la production de ROS sont les protéines découplantes [
15]. Le découplage entre la chaîne de transport d’électrons et la synthèse d’ATP permet de diminuer la production de ROS en réduisant le potentiel électro-chimique de part et d’autre de la membrane mitochondriale interne, mais réduit également la production d’ATP. La régulation de l’expression des éléments qui préviennent la formation ou les nuisances des ROS se doit donc d’être très fine pour éviter tout dommage cellulaire. |
Axe SIRT1/PGC-1, resvératrol et métabolisme des ROS PGC-1α (PPARγ
coregulator-1α) est un régulateur transcriptionnel particulièrement impliqué dans la régulation de la production/détoxification des ROS. En effet, il y a un consensus pour considérer que PGC-1α est le régulateur central de la biogenèse et des fonctions mitochondriales [
16,
17]. De par son rôle dans l’augmentation du nombre de mitochondries, PGC-1α pourrait, en principe, être associé à une intensification de la production de ROS. Or, une publication récente montre que l’expression des enzymes détoxifiantes s’accroît parallèlement à celle de PGC-1α [
18]. PGC-1α est induit par les ROS et, en retour, contrôle le système de défense contre ces mêmes radicaux. Le vieillissement constitue le facteur de risque principal pour les maladies neurodégénératives et les mitochondries participent au vieillissement cellulaire via la production de ROS et l’accumulation de mutations principalement au sein de l’ADNmt [9]. Il est intéressant de noter, au-delà de la diminution précédemment mentionnée de l’expression de PGC-1α chez les patients atteints de la MH, que les souris invalidées pour le gène PGC-1α présentent des lésions neurodégénératives et des anomalies comportementales [
19]. Des fibroblastes, issus de ces mêmes animaux, luttent mal contre les ROS et sont plus sensibles au stress oxydatif [18]. On voit donc très clairement se dessiner l’impact que pourrait avoir PGC-1α dans la lutte contre les pathologies neurodégénératives. L’activité de PGC-1α peut bien sûr être corrélée à son niveau d’expression. Mais les modifications post-traductionnelles occupent également une place prépondérante dans la régulation de cette activité. Il a été montré que la désacétylation de PGC-1α augmente son activité transactivatrice au niveau de gènes hépatiques impliqués dans la néoglucogenèse [
20] et, plus récemment, au niveau de gènes impliqués dans le fonctionnement mitochondrial du tissu adipeux brun et du muscle squelettique [
21]. Ces travaux rapportent que la désacétylation de PGC-1α s’effectue par l’intermédiaire de SIRT1, un des sept orthologues chez les mammifères de la protéine Sir2 (silent information regulator 2) de S.
cerevisiae, membre fondateur de la famille des sirtuines [
22]. SIRT1 est une désacétylase dépendante du NAD+ qui exerce son activité enzymatique sur les histones mais également sur des régulateurs transcriptionnels, modulant par ce biais leur activité. Elle est ainsi impliquée dans de nombreux processus cellulaires. En particulier, SIRT1 est capable de moduler la longévité chez différents organismes. Le vieillissement étant un des facteurs déterminants dans l’apparition des maladies neurodégénératives, il est intéressant de constater que SIRT1, capable d’entraîner un allongement de la durée de vie, semble protéger du développement de pathologies neurodégénératives. Il a été démontré que l’augmentation de la synthèse de NAD+ et l’activation consécutive de SIRT1 protègent de la dégénérescence axonale [
23]. De même, la modulation de l’expression et/ou de l’activité de SIRT1 entraîne une diminution de l’accumulation de protéines Aβ dans des cultures primaires de neurones embryonnaires murins [
24]. Certes SIRT1 n’a pas PGC-1 pour seule cible. Il a notamment été démontré que les facteurs de transcription de la famille Forkhead de classe O (FoxO) sont capables de répondre à la présence d’un stress oxydatif lorsqu’ils sont activés par une désacétylation attribuée à SIRT1 [
25]. Ils induisent alors le ralentissement des processus apoptotiques et favorisent la détoxification cellulaire par l’activation des gènes codant la SOD2 et la catalase, mais ils n’ont en revanche jamais été identifiés, au contraire de PGC-1, comme intervenant dans l’énergétique cellulaire. Enfin, le resvératrol (RSV), un polyphénol présent dans le raisin noir et ses produits dérivés, est connu pour ses propriétés anti-oxydantes, anti-cancéreuses et anti-inflammatoires. De plus, il accroît l’affinité de SIRT1 pour les substrats acétylés [
26], possiblement en entraînant un changement conformationnel de SIRT1. Le cerveau de rat possède des récepteurs pour des polyphénols tels que le RSV [
27]. Cela indique que le RSV peut passer la barrière hémato-encéphalique et plusieurs études suggèrent qu’il pourrait avoir un effet protecteur vis-à-vis des processus neurodégénératifs. En effet, indépendemment de la démonstration d’un quelconque lien avec SIRT1, le RSV protège les neurones des dommages cellulaires provoqués par un stress oxydatif [
28]. Les effets du RSV ont été étudiés dans deux modèles de la MH [
29]. Le premier modèle consiste en la surexpression de la version pathogène de la huntingtine dans les neurones de C. elegans, et le second est constitué par la mise en culture de neurones dérivés de souris transgéniques surexprimant la huntingtine mutée. Dans ces deux modèles, le RSV supprime les effets délétères de la huntingtine mutée. Enfin, concernant la MA, il a été montré que le RSV empêche l’accumulation intracellulaire de peptides Aβ en favorisant leur dégradation par le protéasome [
30]. |
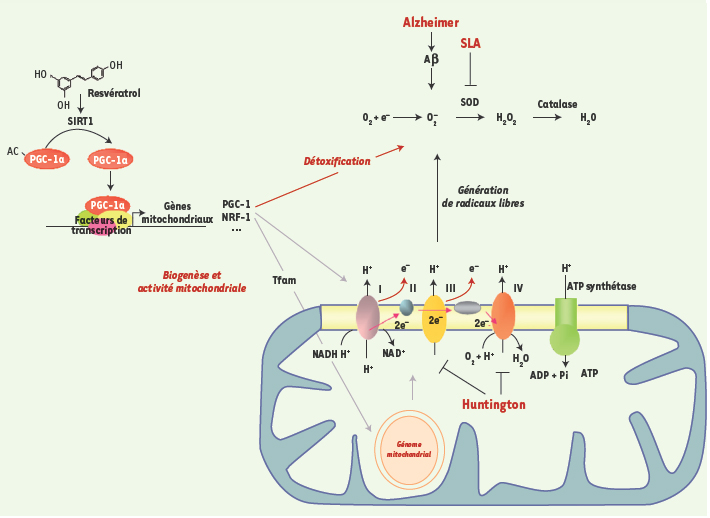
On constate donc que l’axe SIRT1/PGC-1 activé par le RSV (Figure 1) constitue une voie de signalisation à part entière dans certains contextes cellulaires, et que chacun des acteurs de cette voie favorise séparément un ralentissement des processus neurodégénératifs. Cette action anti-neurodégénérative est très vraisemblablement due au fait que le facteur central de cette signalisation, PGC-1, promeut l’activité mitochondriale alors que les pathologies neurodégénératives sont liées à des dysfonctionnements mitochondriaux. Nous suggérons donc que l’activation de l’axe SIRT1/PGC-1, axe qui n’a pas encore été étudié au niveau cérébral, pourrait être une des clés de voûte des mécanismes de neuroprotection et donner naissance à de nouvelles perspectives thérapeutiques.  | Figure 1.
Schématisation de l’action du resvératrol sur le fonctionnement mitochondrial par l’intermédiaire de la voie SIRT1/PGC-1α. La désacetylation de PGC1-α par la désacétylase SIRT1 est stimulée par le resvératrol. L’activité transactivatrice de PGC1-α sur ses gènes cibles est ainsi augmentée promouvant à la fois la biogenèse et l’activité mitochondriale mais également la détoxification cellulaire. |
|
1. Rosen DR. Mutations in Zn/Cu superoxyde dismutase gene are associated with familial amyotrophic lateral sclerosis. Nature 1993; 362 : 59–62. 2. Mattiazzi M, D’Aurelio M, Gajewski CD, et al. Mutated human SOD1 causes dysfunction of oxidative phosphorylation in mitochondria of transgenic mice. J Biol Chem 2002; 277 : 29626–33. 3. Sasaki S, Itawa M. Impairment of fast axonal transport in the proximal axons of anterior horn neurons in amyotrophic lateral sclerosis. Neurology 1996; 47 : 535–40. 4. Wiedemann FR, Manfredi G, Mawrin C, et al. Mitochondrial DNA and respiratory chain function in spinal cords of ALS patients. J Neurochem 2002; 80 : 616–25. 5. Tanzi RE, Bertam L. Twenty years of the Alzheimer’s disease amyloid hypothesis: a genetic perspective. Cell 2005; 120 : 545–55. 6. Manczak M, Anekonda TS, Henson E, et al. Mitochondria are a direct site of A beta accumulation in Alzheimer’s disease neurons: implications for free radical generation and oxidative damage in disease progression. Hum Mol Genet 2006; 15 : 1437–49. 7. Abou-Sleiman PM, Muqit MMK, Wood NW. Expanding insight of mitochondrial dysfunction in Parkinson’s disease. Nat Rev Neurosci 2006; 7 : 207–19. 8. Langston JW, Ballard P, Tetrud JW, Irwin I. Chronic parkinsonism in humans due to a product of meperidine-analog synthesis. Science 1983; 219 : 979–80. 9. Lin MT, Beal MF. Mitochondrial dysfunction and oxidative stress in neurodegenerative diseases. Nature 2006; 443 : 787–95. 10. Browne SE, Beal MF. The energetics of Huntington’s disease. Neurochem Res 2004; 29 : 531–46. 11. Milakovic T, Johnson GV. Mitochondrial respiration and ATP production are significantly impaired in striatal cells expressing mutant huntingtin. J Biol Chem 2005; 280 : 30773–82. 12. McGill JK, Beal MF. PGC1-α a new therapeutic target in Huntington disease. Cell 2006; 127 : 465–8. 13. Balaban RS, Nemoto S, Finkel T. Mitochondria, oxidants, and aging. Cell 2005; 120 : 483–95. 14. Chen Q, Vazquez EJ, Moghaddas S, et al. Production of reactive oxygen species by mitochondria: central role of complex III. J Biol Chem 2003; 278 : 36027–31. 15. Echtay KS, Roussel D, St-Pierre J, et al. Superoxide activates mitochondrial uncoupling proteins. Nature 2002; 415 : 96–9. 16. Kelly DP, Scarpulla RC. Transcriptional regulatory circuits controlling mitochondrial biogenesis and function. Genes Dev 2004; 18 : 357–68. 17. Wu Z, Puigserver P, Andersson U, et al. Mechanisms controlling mitochondrial biogenesis and respiration through the thermogenic coactivator PGC-1. Cell 1999; 98 : 115–24. 18. St-Pierre J, Drori S, Uldry M, et al. Suppression of reactive oxygen species and neurodegeneration by the PGC-1 transcriptional coactivators. Cell 2006; 127 : 397–408. 19. Lin J, Wu PH, Tarr PT, et al. Defects in adaptive energy metabolism with CNS-linked hyperactivity in PGC-1alpha null mice. Cell 2004; 119 : 121–35. 20. Rodgers JT, Lerin C, Haas W, et al. Nutrient control of glucose homeostasis through a complex of PGC-1alpha and SIRT1. Nature 2005; 434 : 113–8. 21. Lagouge M, Argmann C, Gerhart-Hines Z, et al. Resveratrol improves mitochondrial function and protects against metabolic disease by activating SIRT1 and PGC-1alpha. Cell 2006; 127 : 1–14. 22. Frye RA. Phylogenetic classification of prokaryotic and eukaryotic Sir-2 like proteins. Biochem Biophys Res Commun 2000; 273 : 793–8. 23. Araki T, Sasaki Y, Milbrandt J. Increased nuclear NAD biosynthesis and SIRT1 activation prevent axonal degeneration. Science 2004; 305 : 1010–3. 24. Qin W, Yang T, Ho L, et al. Neuronal SIRT1 activation as a novel mechanism underlying the prevention of Alzheimer disease amyloid neuropathology by calorie restriction. J Biol Chem 2006; 281 : 21745–54. 25. Brunet A, Sweeney LB, Sturgill JF, et al. Stress-dependent regulation of FOXO transcription factors by the SIRT1 deacetylase. Science 2004; 303 : 2011–5. 26. Howitz KT, Bitterman KJ, Cohen HY, et al. Small molecule activators of sirtuins extend Saccharomyces cerevisiae lifespan. Nature 2003; 425 : 191–6. 27. Han YS, Bastianetto S, Dumont Y, Quirion R. Specific plasma membrane binding sites for polyphenols, including resveratrol, in the rat brain. J Pharmacol Exp Ther 2006; 318 : 238–45. 28. Wang Q, Yu S, Simonyi A, et al. Resveratrol protects against neurotoxicity induced by kainic acid. Neurochemical Research 2004; 29 : 2105–12. 29. Parker JA, Arango M, Abderrahmane S, et al. Resveratrol rescues mutant polyglutamine cytotoxicity in nematode and mammalian neurons. Nat Genet 2005; 37 : 349–50. 30. Marambaud P, Zhao H, Davies P. Resveratrol promotes clearance of Alzheimer’s disease amyloid-beta peptides. J Biol Chem 2005; 280 : 37377–82. |