| |
| Med Sci (Paris). 2007 October; 23(10): 885–894. Published online 2007 October 15. doi: 10.1051/medsci/20072310885.Plasticité anatomique et fonctionnelle des cellules β du pancréas endocrine et diabète de type 2 Erol Cerasi1* and Alain Ktorza2* 1Service d’Endocrinologie et Métabolisme, Département de Médecine Interne, Centre Médical Hadassa, Université Hébraïque de Jérusalem, 91120 Jérusalem, Israël 2Division de Recherches sur les Maladies Métaboliques, Institut de Recherches Servier (IdRS), 11, rue des Moulineaux, 92150 Suresnes, France |
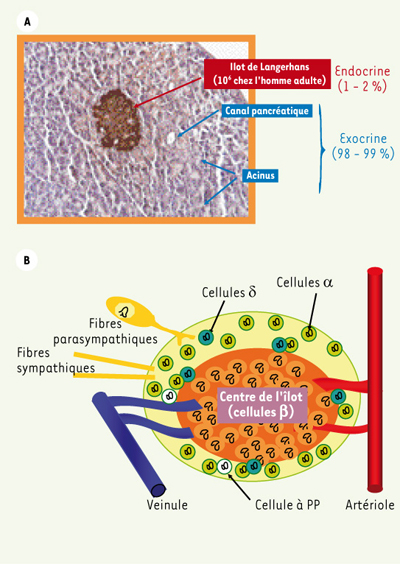
Le diabète sucré est une maladie caractérisée par une élévation anormale de la glycémie (hyperglycémie) à jeun et/ou post-prandiale. Cette anomalie est le résultat de la détérioration du contrôle du métabolisme glucidique dans lequel l’insuline, produite et libérée par les cellules β du pancréas endocrine (Figure 1), joue un rôle central (c’est la seule hormone hypoglycémiante). On distingue, schématiquement, deux grands types de diabètes. Le diabète de type 1 (10 % des diabétiques) où les cellules β sont détruites par un processus auto-immun, et le diabète de type 2 (DT2), de loin le plus fréquent (90 % des diabétiques), dont la physiopathologie est plus complexe. Trois-quart des sujets DT2 sont obèses. 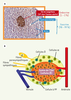 | Figure 1.
A. Coupe transversale montrant un îlot de Langerhans au milieu du compartiment exocrine. B. Organisation d’un îlot de Langerhans. Le pancréas endocrine représente environ 2 % du pancréas total chez les mammifères. Les cellules endocrines sont regroupées en amas compacts et sphériques, les îlots de Langerhans. Les cellules endocrines sont richement irriguées et innervées. Il existe 4 types cellulaires principaux au sein des îlots. Les cellules β, sécrétrices d’insuline, représentent la majorité des cellules de l’îlot (environ 80 %). Les cellules α, sécrétrices de glucagon, hormone hyperglycémiante, représentent 15 à 20 % de la masse insulaire. Les cellules δ, sécrétrices de somatostatine, hormone inhibitrice de la sécrétion d’insuline et de glucagon, représentent 2 % à 5 % de l’îlot. Les cellules PP sécrétrices du polypeptide pancréatique (PP), dont le rôle physiologique n’est pas encore bien élucidé, ne représentent que 1 % de la masse des cellules endocrines. |
La Fédération Internationale du Diabète estime qu’en 2007 il existe, tous types de diabètes confondus, 500 millions de personnes atteintes par la maladie dans le monde, et il est prévu que ce chiffre atteigne les 800 millions en 2025 (http://www.eatlas.idf.org/media). Cette progression spectaculaire est le fait avant tout de la véritable « épidémie non infectieuse » (selon les termes de l’OMS) de diabète type 2 qui affecte non seulement les pays industrialisés, mais aussi et en progressant beaucoup plus rapidement, les pays en voie de développement. Autre fait nouveau et très préoccupant, le DT2, maladie considérée classiquement comme une maladie de la maturité, apparaît chez des sujets de plus en plus jeunes, voire chez des enfants. Notre compréhension actuelle de la physiopathologie du DT2 inclut la diminution de l’efficacité biologique de l’insuline vis-à-vis de ses tissus cibles (insulinorésistance) et la diminution de la capacité de la cellule β à sécréter l’hormone. Ce consensus n’a pas toujours prévalu et la réalité de l’atteinte pancréatique a été longtemps mise en doute. Aujourd’hui encore, l’importance respective de la résistance à l’insuline et de l’altération de sa sécrétion n’est pas clairement définie. Enfin, ni les mécanismes, ni la physiopathologie du dysfonctionnement des cellules β ne sont clairement élucidés. C’est sur ce dernier point que porte cet article. |
Part de l’insulinorésistance et du déficit d’insuline dans le DT2 L’idée que le DT2, par opposition au diabète insulinodépendant, est une maladie de la sensibilité à l’insuline endogène circule depuis les années 1930 [
1]. Cette notion a été renforcée par Berson et Yallow quand les premiers dosages radioimmunologiques de l’insuline plasmatique ont été publiés en 1960 [
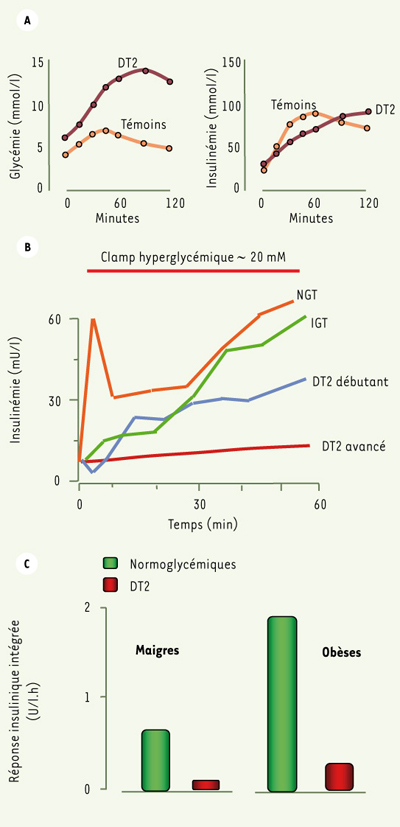
2]. En effet, à la suite d’une surcharge orale de glucose, l’insulinémie du patient DT2 peut atteindre des taux aussi élevés que ceux du témoin non diabétique. Cependant, la glycémie du diabétique durant la surcharge est beaucoup plus élevée que chez le témoin et correspond donc à une stimulation bien plus forte du pancréas (Figure 2A). En utilisant des méthodes qui prennent en compte le degré de stimulation, on peut facilement démontrer que la réactivité du pancréas diabétique est bien plus faible que celle du sujet non diabétique [
3,
4]. L’insulinosécrétion chez le DT2 est caractérisée par l’effondrement de la réponse initiale (« pic précoce ») au glucose, et par la réduction de la réponse maximale aux stimulations, réduction qui peut aller jusqu’à 80 % dans le DT2 « avancé » (Figure 2B). La démonstration la plus convaincante de la part importante prise par le déficit d’insuline dans la physiopathologie du DT2, est fournie par l’efficacité de l’insulinothérapie, lorsqu’elle est pratiquée de façon quasi-physiologique par pompe à insuline sous-cutanée [
5,
6].  | Figure 2.
Sécrétion d’insuline et diabète de type 2. A. Réponse insulinosécrértice à une surcharge orale de glucose (OGTT) chez des sujets témoins (maigres, n = 226) et chez des patients DT2 au début du diabète (n = 25) (adapté de [
51]). B. La réponse insulinosécrértice à un clamp hyperglycémique (bolus et perfusion intraveineux de glucose, 0 à 60 min) chez des sujets sains (NGT), des sujets avec intolérance au glucose (IGT), des diabétiques de type 2 (DT2) au début de la maladie, et des DT2 après quelques années de diabète. C. Insulinémie intégrée durant 60 min de clamp hyperglycémique (~ 20 mmol/l) chez des sujets maigres (à gauche) et obèses (à droite). Colonnes vertes : sujets non-diabétiques ; colonnes rouges : patients DT2 (illustration fondée sur les données de [ 4,
52]). |
|
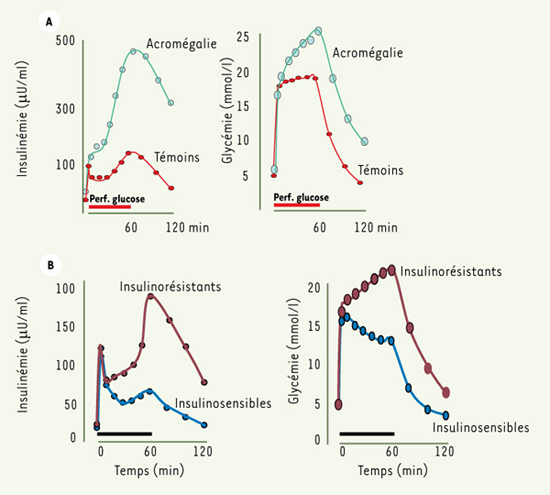
Capacité d’adaptation fonctionnelle de la cellule β La cellule β démontre une grande plasticité fonctionnelle, aussi bien à des stimulus aigus, que chroniques. Par exemple, le pancréas isolé perfusé du rat soumis à des stimulus d’intensités variables offre une gamme de pics précoces d’insuline variant de 1 à 50. L’adaptation à long terme de la cellule β est aussi largement documentée. Ainsi, l’athlète professionnel, dont la sensibilité à l’insuline est très élevée, peut maintenir une glycémie normale en sécrétant 2 à 3 fois moins d’insuline que l’individu moyen [
7]. À l’opposé, l’adaptation à l’insulinorésistance et/ou à la suralimentation, qui est encore plus cruciale car elle conditionne le maintien de l’homéostasie glucidique, n’est pas moins évidente. Le sujet obèse non diabétique est capable de secréter 2 à 5 fois plus d’insuline en réponse au glucose qu’un sujet maigre non diabétique, et de 5 à 10 fois plus qu’un sujet obèse DT2 (Figures 2C et 3). On peut voir là une des raisons majeures pour lesquelles près de 75 % des sujets obèses ne deviennent pas diabétiques. D’autres états pathologiques tels que l’acromégalie ou la maladie de Cushing sont caractérisés par une insulinorésistance très importante. Bien que le diabète (ou l’intolérance au glucose) accompagne fréquemment ces pathologies, un nombre important de malades maintiennent une tolérance glucidique normale en augmentant fortement l’insulinosécrétion [
8].  | Figure 3.
Adaptation partielle de l’insulinosécrétion à l’insulinorésistance chez l’homme non diabétique. A. Hyper-réactivité sécrétoire durant une perfusion de glucose (0,5 g/kg en bolus, suivi de 20 mg/kg/min durant 60 min, barre horizontale) chez des patients acromégales insulinorésistants à tolérance glucidique normale. Remarquez les glycémies élevées (panneau de droite) malgré l’hyperinsulinémie majeure (adapté de [ 8, 51]). B. Hyperglycémie relative chez le sujet sain maigre avec sensibilité à l’insuline réduite (tests comme dans Figure 2A) (adapté de [
37]). |
La grossesse fournit un autre exemple spectaculaire d’adaptation, cette fois physiologique pure, de la cellule β à l’insulinorésistance. Le troisième trimestre de la grossesse est marqué par une réduction importante de l’efficacité biologique de l’insuline, qui conduit à l’amplification de l’insulinosécrétion par un facteur de 2 à 4, la situation retournant à l’état normal rapidement après l’accouchement [
9,
10]. Ces exemples illustrent bien le fait que la cellule β bénéficie d’une capacité remarquable d’adaptation aux besoins en insuline de l’organisme, aussi bien dans des conditions physiologiques particulières que dans des situations pathologiques peu favorables. |
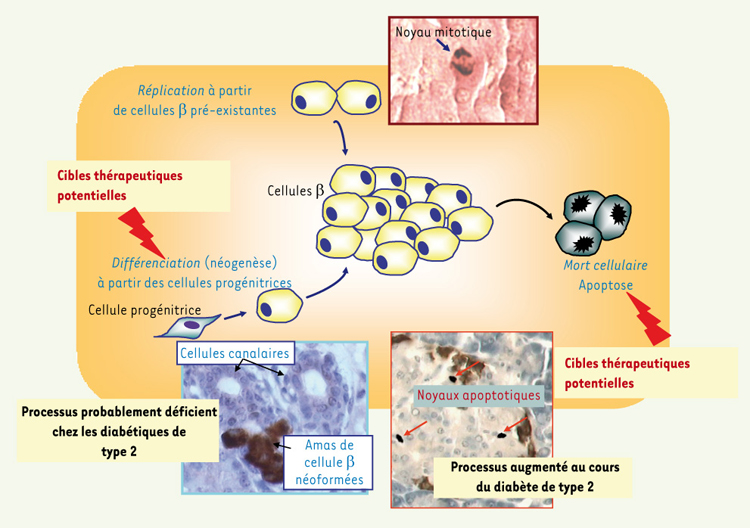
Capacité d’adaptation anatomique de la cellule β Mécanismes de contrôle de la masse des cellules β La masse (terme qui recouvre à la fois le nombre et le volume des cellules) des cellules β est en équilibre dynamique régi par 4 processus. La réplication des cellules différenciées pré-existantes, la différenciation de cellules précurseurs en cellules β (néogenèse), l’hypertrophie des cellules β et la mort cellulaire programmée ou apoptose [
11] (Figure 4). 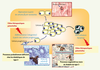 | Figure 4.
Mécanismes régulateurs de la masse des cellules b. |
-
Les mécanismes qui augmentent la masse des cellules β :
-
La prolifération des cellules β préexistantes est réduite chez l’adulte (3 % contre 10 % chez le fœtus).
-
La néogenèse est le processus par lequel de nouvelles cellules sont formées à partir de cellules précurseurs.
-
Des cellules progénitrices situées dans les canalicules pancréatiques, qui après s’être différenciées en cellules β, vont former des bourgeons canalaires dont la migration dans la pancréas exocrine sera à l’origine de nouveaux îlots de Langerhans.
-
L’hypertrophie des cellules β peut participer à l’expansion de la masse β, notamment au cours de la gestation.
-
Le mécanisme qui tend à faire diminuer la masse des cellules β :
-
L’apoptose est à un niveau très bas chez l’adulte, dans les conditions physiologiques normales. Elle peut être amplifiée lorsque l’environnement métabolique de la cellule se dégrade (hyperglycémie et/ou hyperlipidémie chronique).
Adaptation anatomique de la cellule β dans des situations physiologiques et pathologiques d’insulinorésistance L’hyperactivité pancréatique au cours de la gestation, que nous avons mentionnée plus haut, résulte en grande partie de modifications anatomiques et cellulaires consistant en une stimulation de la coopération des cellules β entre elles par une augmentation forte des gap junctions et surtout par une augmentation de leur masse consécutive à l’hypertrophie et à l’hyperplasie [
12]. Chez le sujet obèse, l’augmentation de la masse des cellules β contribue largement à l’hypersécrétion de l’hormone. C’est un point évidemment très difficile à vérifier chez l’homme, mais des études réalisées post-mortem chez des sujets obèses diabétiques ou non diabétiques ont montré une nette augmentation de la masse des cellules β, respectivement par rapport aux sujets non obèses diabétiques et aux sujets non obèses non diabétiques [
13,
14]. Dans tous les modèles animaux d’obésité non diabétique, la masse des cellules est 3 à 4 fois plus élevée que celle des animaux non obèses, essentiellement du fait d’une activité néogénique très forte. |
Défaut d’adaptation fonctionnelle de la cellule β à l’insulinorésistance dans le diabète de type 2 Les anomalies de l’insulinosécrétion apparaissent très tôt (Figure 2B), dès le stade de l’intolérance au glucose (IGT : glycémie à jeun normale, mais glycémie anormalement élevée au cours d’une épreuve d’hyperglycémie provoquée). Nous avons même décrit la présence d’une réponse insulinique au glucose extrêmement faible chez des sujets sains non-obèses à tolérance glucidique parfaitement normale, cette normalité étant maintenue grâce à une augmentation de la sensibilité hépatique à l’insuline. Nous avons présumé que ces sujets, « faibles insulinorépondeurs », se trouvent dans un état « prédiabétique » [
15,
16]. Un suivi de plus de 25 ans de sujets non-obèses nous a permis de démontrer que l’altération ultérieure de la tolérance glucidique peut être prédite par la « qualité initiale » de l’insulinosécretion [
17]. Des résultats analogues ont été obtenus chez l’obèse insulinorésistant [
18]. Ainsi, une faible capacité de réponse insulinique au glucose prédisposerait au DT2. Au plan cellulaire, l’étude d’îlots post-mortem de DT2 suggère que la sécrétion déficiente est une caractéristique de la cellule β diabétique puisqu’elle persiste après culture in vitro [
19]. Cependant, nous ne possédons aucune information sur la biologie de la cellule β diabétique in situ, où de multiples facteurs (irrigation sanguine, innervation, contact intime avec les cellules avoisinantes…) ont un impact majeur sur sa fonction. Nous avons étudié l’évolution d’un diabète assez semblable au DT2 humain chez la gerbille Psammomys obesus. Dans son habitat naturel (régions semi-désertiques de l’Afrique du Nord et du Moyen-Orient), ce rongeur est normoglycémique malgré une insulinorésistance marquée. Dès que l’apport calorique augmente, l’animal développe une hyperglycémie prononcée, une hyperinsulinémie relative avec des taux de proinsuline élevés, et un effondrement du contenu pancréatique en insuline, dès l’apparition de l’hyperglycémie [
20]. Non traité, le diabète s’aggrave graduellement et l’animal meurt dans un coma acido-cétosique. Nous avons décelé plusieurs modifications dans les îlots du Psammomys tel que le manque du facteur de transcription PDX-1, la faible adaptation de l’oxydation du glucose à l’hyperglycémie, l’utilisation réduite de substrats mitochondriaux insulinosécréteurs… [
21]. Cependant, ces modifications n’empêchent pas l’animal de rester parfaitement normoglycémique dans son milieu naturel où l’apport calorique est très faible et l’activité physique soutenue. L’ensemble de ces données suggère que la réponse insulinosécrétrice au glucose ne peut être prédictive de la qualité de l’équilibre glycémique qu’en la mettant en parallèle avec l’apport calorique et la dépense énergétique concomitantes. |
Adaptation anatomique de la cellule β à l’insulinorésistance dans le DT2 : la masse des cellules β est-elle réduite ? Des données récentes [14] ou plus anciennes [13], obtenues post-mortem sur pancréas de patients DT2, montrent que la masse β-cellulaire est réduite d’environ 30 à 60 % chez le diabétique comparé à son témoin non diabétique. Cependant, la notion d’une réduction de la masse insulaire, même si elle prévaut majoritairement, n’est pas acceptée sans réserve par tous [
22], car les aléas d’une étude post-mortem, surtout en ce qui concerne le pancréas, sont nombreux. Dans tous les modèles animaux spontanés de DT2, il existe une réduction de la masse β [
23]. Chez le Psammomys, on observe une réduction de cette masse au début du diabète, qui est accompagnée d’un turnover accéléré des cellules β, l’augmentation des taux d’apoptose prenant le pas sur celle de la prolifération cellulaire [20]. De façon inattendue, au bout de quelque temps, nous avons constaté le retour de la masse β-cellulaire au niveau de départ. Cependant, ce phénomène n’était accompagné ni d’une amélioration de l’état diabétique, ni d’une augmentation des stocks pancréatiques d’insuline. De même, dans un modèle de DT2 induit chez le rat par l’injection d’une faible dose de streptozotocine, la perfusion de glucose pendant 48 heures, conduit au triplement de la masse cellulaire β sans aucun gain fonctionnel [
24]. Ces deux exemples soulignent, s’il était besoin, la nécessité de prendre en compte à la fois la réduction anatomique de la masse β-cellulaire et sa réduction fonctionnelle. Le paramètre à considérer est donc celui de la masse fonctionnelle des cellules β. Causes possibles de la diminution de la masse fonctionnelle des cellules β dans le DT2 S’il est probable, d’après les exemples que nous avons développés plus haut, que la masse fonctionnelle des cellules β puisse être réduite d’emblée dans une catégorie de patients DT2, de nombreuses données indiquent que l’altération de l’environnement métabolique peut largement contribuer à la détérioration progressive de cette masse fonctionnelle. L’hyperglycémie chronique, un profil lipidique anormal incluant la dyslipidémie, et l’excès d’acides gras et de triglycérides circulants sont la caractéristique des sujets DT2 obèses. L’exposition prolongée à des concentrations élevées de glucose est reconnue comme un facteur toxique pour de nombreux tissus et organes, cellule β comprise. C’est le concept de la « glucotoxicité ». La culture à long-terme d’îlots humains avec de fortes concentrations de glucose augmente considérablement le taux d’apoptose en liaison avec l’induction de la protéine pro-apoptotique Fas et l’activation des caspases 3 et 8 [
25,
26]. Une alimentation hyperglucidique du rat GK (modèle de diabète spontané de DT2 non obèse) pendant 6 semaines diminue la masse des cellules β de 50 % par rapport aux rats GK recevant un régime normal, essentiellement par une stimulation de l’apoptose des cellules β [
27]. L’exposition chronique de la cellule β à une concentration anormalement élevée d’acides gras conduit à des altérations morphologiques et fonctionnelles (« lipotoxicité ») [
28], surtout si hyperlipidémie et hyperglycémie sont associées (« gluco-lipotoxicité »). Chez le rat (fa/fa) Zucker diabetic fatty (ZDF), rat spontanément obèse et diabétique, la masse des cellules β décroît progressivement avec l’âge, en parallèle avec une altération de la sécrétion d’insuline et une augmentation du taux d’apoptose ; finalement un diabète sévère s’installe [
29]. L’agent stimulant de l’apoptose semble être l’énorme augmentation du contenu intrainsulaire en triglycérides, qui dans cette lignée est 20 fois supérieur à la normale. Des substances lipolytiques, qui réduisent fortement le contenu insulaire en triglycérides, protègent les cellules β des rats ZDF de l’apoptose [
30,
31]. Parmi les hypothèses avancées pour expliquer les mécanismes « gluco-lipotoxiques », celles qui s’appuient sur l’analogie entre la détérioration de cette cellule et les complications angiopathiques du diabète représentent une tentative d’explication très attrayante, qui fait du stress oxydant, de la glycation de protéines et l’accumulation de produits tardifs de glycation (advanced glycosylation end products, AGE) les intermédiaires privilégiés de l’effet toxique du glucose. Le stress oxydant peut être défini comme le résultat de la rupture de l’équilibre entre la production d’espèces moléculaires hautement réactives, principalement l’oxygène (ROS, Reactive Oxygen Species) et l’azote (RNS, Reactive Nitrogen Species) et les mécanismes de défense anti-oxydantes. Les ROS et les RNS provoquent notamment les altérations de l’ADN, des protéines et des lipides et l’activation de certaines cytokines de stress [
32]. Par ailleurs, la cellule β est l’une des cellules de l’organisme les moins équipées en défenses anti-oxydantes [
33]. De nombreuses voies peuvent conduire à la formation de ROS à partir du glucose en excès. On citera l’auto-oxydation du glycéraldéhyde 3-phosphate, favorisant la formation d’AGE et l’activation de la protéine kinase C (PKC) notamment et la voie du méthylglyoxal, produit très toxique, impliqué dans la synthèse des AGE. Il est remarquable que des stratégies fondées sur l’utilisation de molécules anti-oxydantes (superoxyde dismutase) protègent la cellule β de l’apoptose et de l’altération de l’ADN [32]. Il faut rajouter, en ce qui concerne plus spécifiquement la lipotoxicité, que l’excès de triglycérides insulaires exercerait un effet toxique qui passerait par la surproduction de céramides, agents apoptotiques reconnus, dont la teneur élevée en acide gras de l’îlot alimenterait la surproduction [31]. Les céramides augmenteraient l’expression de la NO synthase et donc la production de NO, autre facteur favorisant l’apoptose. Cependant, la piste du NO semble moins pertinente notamment quand la source de lipides est le palmitate [33,
34]. En revanche, la génération de ROS est bien démontrée et elle peut être limitée par des agents anti-oxydants. Enfin, un effet direct des acides gras sur l’expression des gènes codant pour des facteurs de contrôle de l’apoptose (réduction de l’expression de Bcl2 et stimulation de celle de Bax) n’est pas à écarter [
35]. Un autre explication possible, non incompatible avec la précédente, est celle du « stress du réticulum endoplasmique (RE) ». Le « stress du RE » est une notion récente selon laquelle l’accumulation de protéines de conformations anormales dans la lumière du RE entraînerait une activation de gènes cibles et une profonde inhibition de la traduction avec pour conséquence une augmentation des capacités de repliement et de dégradation et donc un frein à l’arrivée de nouvelles protéines dans le RE. Lorsque cette réponse adaptative est insuffisante une réponse apoptotique est déclenchée. De manière plus générale, les cellules β semblent être particulièrement sensibles aux perturbations de la fonction du RE. Ainsi, les souris invalidées pour le gène codant pour PERK (protéine du RE activée par le stress) présentent un diabète et une hypoplasie du pancréas due à une destruction progressive des cellules β. Les îlots de Langerhans isolés à partir de ces souris ont une altération de la biosynthèse de l’insuline. Il est donc possible que dans des situations d’hypersécrétion d’insuline liées à l’insulinorésistance le stress du RE soit impliqué dans la perte des cellules β et à l’altération de leur fonction [
36]. |
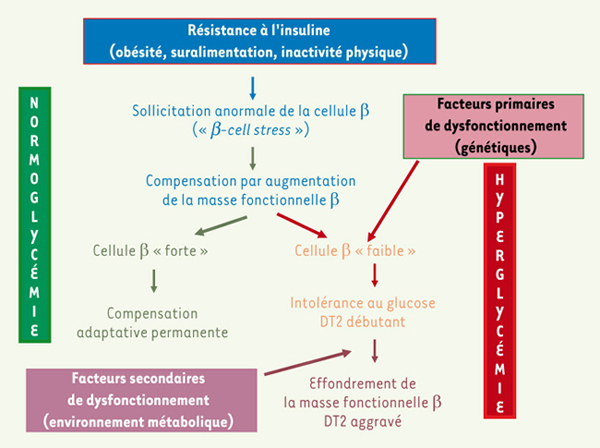
Le développement du DT2 est-il la conséquence d’une plasticité anatomo-fonctionnelle β-cellulaire imparfaite ? L’utilisation de tests très sensibles et contraignants de mesure de la fonction pancréatique, montrent que l’adaptation fine de la cellule β à l’insulinorésistance nécessite un fonctionnement optimal de cette cellule, bien supérieur à ce qui peut paraître suffisant pour le maintien d’une normoglycémie au quotidien [37]. Il en découle qu’une cellule β normale avec un potentiel de plasticité fonctionnelle (et anatomique ?) limité, que nous appellerons « cellule β faible », serait parfaitement à même de maintenir une homéostasie glucidique normale tant que la demande fonctionnelle (degrés d’insulinorésistance et de surcharge calorique) ne dépasse pas certaines limites. Au-delà, l’insuline produite ne suffirait plus à maintenir une glycémie post-prandiale normale ; la modeste hyperglycémie (en conjonction avec la hausse des acides gras libres liée à l’obésité) qui résulte pourrait augmenter le déficit β-cellulaire par tous les mécanismes décrits ci-dessus. Le « cercle vicieux » de la dégradation mutuelle de l’hyperglycémie et de la fonction β pourrait alors s’enclencher. Cette « limite » à ne pas dépasser serait bien plus haute chez le sujet dont la plasticité β-cellulaire se trouve vers le haut de la gamme normale (« cellule β forte »). Cette explication possible est schématisée dans la Figure 5.  | Figure 5.
Représentation schématique des relations entre insulinorésistance, plasticité anatomo-fonctionnelle de la cellule bet diabète de type 2 (voir texte). |
Il a été démontré par « balayage du génome entier » que plusieurs gènes d’importance pour la fonction β-cellulaire apparaissent liés au DT2 chez l’homme [
38–
41]. Parmi ceux-ci, le gène du TCF7L2 paraît particulièrement important. TCF7L2 est un facteur de transcription impliqué dans le développement du pancréas endocrine et la différenciation de la cellule β. Or, chez des sujets sains portant les variantes polymorphiques du gène qui augmentent (de façon faible mais significative) le risque de DT2, la réponse insulinique à une surcharge au glucose est plus faible [
42]. S’agirait-il des sujets à « cellules β faibles » ? Des études futures pourraient nous l’indiquer. |
La rupture de l’équilibre glycémique et sa détérioration progressive au cours du diabète de type 2 résulte d’un défaut d’adaptation de la cellule β à l’accroissement de la demande insulinique liée à l’insulinorésistance. Si les limites techniques actuelles ne permettent pas encore de déterminer de manière précise le capital initial en cellules β et son évolution au cours du DT2, il est indéniable que l’équipement en cellules β fonctionnelles (masse fonctionnelle) est inférieur à celui des sujets non diabétiques et se dégrade au cours de l’évolution de la maladie. Les traitements futurs du DT2 doivent intégrer cette notion. À cet égard, on notera que certaines molécules anti-diabétiques insulino-sensibilisatrices comme les thiazolidinediones pourraient protéger la masse β de son amenuisement progressif dans certains modèles animaux de DT2 [
43–
45]. Ces résultats demandent, cependant, confirmation. Les données concernant les incrétines, en particulier le Glucagon-Like-Peptide 1 (GLP-1), sont beaucoup plus claires et abondantes. Le GLP-1 est une hormone intestinale dérivée du proglucagon qui exerce un effet insulinotrope, non seulement en stimulant la sécrétion d’insuline de manière dépendante du glucose, mais aussi en participant au contrôle de l’homéostasie de la masse des cellules β avec un effet trophique à présent très largement documenté [
46,
47]. Cet effet s’exerce à la fois via la stimulation de la prolifération, l’augmentation de la néogenèse de cellules β et de l’inhibition du processus d’apopotose. Ce dernier effet est relayé à la fois par l’augmentation de l’expression de facteurs de survie de la cellule β comme Akt/PKB ou la p44MAPK et la diminution de celle de protéines pro-apoptotiques comme les caspases [
48]. Fait notable, on retrouve ces caractéristiques sur des îlots humains en culture, notamment l’effet anti-apoptotique et la promotion de la néogenèse [
49]. La propriété du GLP-1, démontrée à présent de manière indiscutable, de jouer sur la plasticité anatomique et fonctionnelle de la cellule β ouvre des perspectives extrêmement intéressantes d’amélioration à long terme de l’équilibre glycémique déjà mis à profit pour la synthèse de nouvelles molécules anti-diabétiques [
50]. Masse fonctionnelle b et traitements d’avenir : La « Quête du Graal »
Il existe bien à présent un consensus sur la nécessité de renforcer la fonction insulaire chez le patient DT2 à tous les stades de la maladie, mais le problème de la masse anatomique des cellules β reste entier. La solution passe, en partie, par le développement de méthodes d’imagerie non invasive du pancréas endocrine, chez l’homme qui permettraient, notamment de répondre à une série de questions, fondamentales aussi bien pour la compréhension du DT2 que son traitement de façon optimale :
-
Est-ce que la masse β est réellement réduite chez le patient DT2 (pour les auteurs de cette revue le débat n’est pas totalement clos) ? Sous toutes modalités de traitement et de degré de régulation métabolique ?
-
La détérioration graduelle de l’insulinosécrétion, qui a été démontrée, quelle que soit la nature du traitement, dans plusieurs grandes études prospectives, correspond-elle à la baisse parallèle de la masse anatomique des cellules β ?
-
Quel est le degré de correspondance entre la masse anatomique des cellules β et la capacité fonctionnelle chez l’homme ?
-
Question-clé : une masse β réduite dès la naissance prédispose-elle au développement du DT2 ?
La réponse à ces questions est un préalable à l’analyse plus fine notamment des mécanismes impliqués dans l’apoptose des cellules β dans la perspective du développement de molécules qui cibleraient ce(s) mécanisme(s) et permettraient de créer des médicaments anti-apoptotiques spécifiques des cellules β. De même, on pourrait tenter de réduire le « stress du RE » et/ou le stress oxydant tout en permettant à la cellule β d’augmenter sa sécrétion d’insuline de manière adaptée au niveau de l’insulinorésistance. Notre connaissance actuelle de la physiopathologie du DT2 nous incite à penser qu’un traitement futur n’aura d’effet maximal sur le métabolisme et le développement des complications vasculaires du diabète que s’il est mis en place tôt dans l’évolution de la maladie. D’où l’importance du développement de méthodes de diagnostic précoce. fondées sur une combinaison de marqueurs génétiques, biochimiques et physiologiques capables de décrire avec précision la masse fonctionnelle des cellules β ainsi que leur seuil de vulnérabilité aux stress variés qui accompagnent l’insulinorésistance. Cela permettrait non seulement de détecter les sujets à haut risque de développer le DT2, mais aussi d’établir un traitement adapté à des sous-populations de diabétiques bien caractérisées, en s’appuyant sur le facteur étiopathogénique dominant du patient. |
1. Himsworth HP. Diabetes mellitus : its differentiation into insulin sensitive and insulin insensitive types. Lancet 1936; I : 1117–22. 2. Yalow RS, Berson SA. Plasma insulin concentrations in nondiabetic and early diabetic subjects. Determinations by a new sensitive immuno-assay technic. Diabetes 1960; 9 : 254–60. 3. Efendic S, Luft R, Wajngot A. Aspects of the pathogenesis of type 2 diabetes. Endocrinol Rev 1984; 5 : 395–410. 4. Nesher R, Della Casa L, Litvin, et al. Insulin deficiency and insulin resistance in type 2 (non-insulin-dependent) diabetes : quantitative contributions of pancreatic and peripheral responses to glucose homeostasis. Eur J Clin Invest 1987; 17 : 266–74. 5. Ilkova H, Glaser B, Tunçkale A, et al. Induction of long-term glycemic control in newly diagnosed type 2 diabetic patients by transient intensive insulin treatment. Diabetes Care 1997; 20 : 1353–6. 6. Kruszynka YT, Home PD, Hanning I, Alberti KGMM. Basal and 24-h C-peptide and insulin secretion rate in normal man. Diabetologia 1987; 30 : 16–21. 7. Ahrén B, Thorsson O. Increased insulin sensitivity is associated with reduced insulin and glucagon secretion and increased insulin clearance in man. J Clin Endocrinol Metab 2003; 88 : 1264–70. 8. Luft R, Cerasi E, Hamberger CA. Studies on the pathogenesis of diabetes in acromegaly. Acta Endocr (Kbh) 1967; 56 : 593–607. 9. Parsons JA, Brelje TC, Sorenson RL. Adaptation of islets of Langerhans to pregnancy : increased islet cell proliferation and insulin secretion correlates with the onset of placental lactogen secretion. Endocrinology 1992; 130 : 1459–66. 10. Edström K, Cerasi E, Luft R. Insulin response to glucose infusion during pregnancy. A prospective study of high and low insulin responders with normal carbohydrate tolerance. Acta Endocr (Kbh) 1974; 75 : 87–104. 11. Bouwens L, Rooman I. Regulation of Pancreatic β-cell mass. Physiol Rev 2005; 85 : 1255–70. 12. Sorenson R, Brelje T. Adaptation of islets of Langerhans to pregnancy : β cell growth, enhanced insulin secretion and the role of lactogenic hormones. Horm Metab Res 1997; 29 : 301–7. 13. Klöppel G, Löhr M, Habich K, et al. Islet pathology and pathogenesis of type 1 and type 2 diabetes mellitus revisited. Surv Synth Path Res 1985; 4 : 110–25. 14. Butler AE, Janson J, Bonner-Weir S, et al. β-cell deficit and increased β-cell apoptosis in humans with type 2 diabetes. Diabetes 2003; 52 : 102–10. 15. Cerasi E, Luft R. Plasma insulin response to sustained hyperglycaemia induced by glucose infusion in human subjects. Lancet 1963; 282 : 1359–61. 16. Cerasi E, Luft R. What is inherited — what is added. Hypothesis for the pathogenesis of diabetes mellitus. Diabetes 1967; 16 : 615–27. 17. Alvarsson M, Wajngot A, Cerasi E, Efendic S. K-value and low insulin secretion in a non-obese white population predicted glucose tolerance after 25 years. Diabetologia 2005; 48 : 2262–8. 18. Pratley RE, Weyer C. The role of impaired early insulin secretion in the pathogenesis of type II diabetes mellitus. Diabetologia 2001; 44 : 929–45. 19. Deng S, Vatamaniuk M, Huang M, et al. Structural and functional abnormalities in the islets isolated from type 2 diabetic subjects. Diabetes 2004; 53 : 624–32. 20. Kaiser N, Yuli M, Üçkaya C, et al. Dynamic changes in beta-cell mass and pancreatic insulin during the evolution of nutrition-dependent diabetes in Psammomys obesus. Impact of glycemic control. Diabetes 2005; 54 : 138–45. 21. Kaiser N, Nesher R, Donath MY, et al.
Psammomys Obesus, a model for environment-gene interactions in type 2 diabetes. Diabetes 2005; 54 (suppl 2) : S137–44. 22. Rahier J, Guiot Y, Sempoux C. Diabète de type 2 et déficit des cellules B. In : Selam JL, ed. Journées annuelles de diabétologie de l’Hôtel-Dieu. Paris : Flammarion Médecine-Sciences, 2004 : 15–20. 23. Bernard-Kargar C, Ktorza A. Endocrine pancreas plasticity under physiological and pathological conditions. Diabetes 2001; 50 (suppl 1) : S30–5. 24. Bernard C, Thibault C, Berthault, et al. Pancreatic β-cell regeneration after 48h glucose infusion in mildly diabetic rats is not correlated with functional improvement. Diabetes 1998; 47 : 1058–65. 25. Frederici M, Hribal M, Perego L, et al. High glucose causes apoptosis in cultured human pancreatic islets of Langerhans : a potential role for regulation of specific Bcl family genes toward an apoptotic cell death program. Diabetes 2001; 50 : 1290–301. 26. Maedler K, Sergeev P, Ris F, et al. Glucose-induced beta cell production of IL-1beta contributes to glucotoxicity in human pancreatic islets. J Clin Invest 2002; 110 : 851–60. 27. Koyama M, Wada R, Sakuraba H, et al. Accelerated loss of islet β-cells in sucrose-fed Goto-Kakizaki rats, a genetic model of non-insulin-dependent diabetes mellitus. Am J Pathol 1998; 153 : 537–45. 28. McGarry J, Dobbins R. Fatty acids, lipotoxicity and insulin secretion. Diabetologia 1999; 42 : 128–38. 29. Lee Y, Hirose H, Ohneda M, et al. Beta-cell lipotoxicity in the pathogenesis of non-insulin-dependent diabetes mellitus of obese rats : impairment in adipocyte-beta-cell relationships. Proc Natl Acad Sci USA 1994; 91 : 10878–82. 30. Shimabukuro M, Zhou YT, Levi M, Unger RH. Fatty acid-induced β-cell apoptosis : a link between obesity and diabetes. Proc Natl Acad Sci USA 1998; 95 : 2498–502. 31. Shimabukuro M, Higa M, Zhou Y, et al. Lipoapoptosis in β-cells of obese prediabetic fa/fa rats. J Biol Chem 1998; 273 : 32487–90. 32. Robertson RP. Chronic oxidative stress as a central mechanism for glucose toxicity in pancreatic islet β-cells in diabetes. J Biol Chem 2004; 279 : 42351–4. 33. Evans JL, Goldfine ID, Maddux BA, Grodsky GM. Are oxidative stress-activated signalling pathways mediators of insulin resistance and beta cell dysfunction ? Diabetes 2003; 52 : 1–8. 34. Lupi R, Dotta F, Marselli L, et al. Prolonged exposure to free fatty acids has cytostatic and pro-apoptotic effects on human pancreatic islets : evidence that β-cell death is caspase mediated, partially dependent on ceramide pathway, and Bcl-2 regulated. Diabetes 2002; 51 : 1437–42. 35. Piro S, Anello M, Di Pietro C, et al. Chronic exposure to free fatty acids or high glucose induces apoptosis in rat pancreatic islets : possible role of oxidative stress. Metabolism 2002; 51 : 1340–7. 36. Laybutt DR, Preston AM, Akerfeldt MC, et al. Endoplasmic reticulum stress contributes to beta-cell apoptosis in type 2 diabetes. Diabetologia 2007; 50 : 752–63. 37. Cerasi E. Differential actions of glucose on insulin release : reevaluation of a mathematical model. In : Cobelli C, Bergman RN, eds. Carbohydrate metabolism. Chichester : John Wiley and Sons, 1981 : 3–22. 38. Scott LJ, Mohlke KL, Bonnycastel LL, et al. A genome-wide association study of type 2 diabetes in Finns detects multiple susceptibility variants. Science 2007; 316 : 1341–5. 39. Saxena R, Voigt BF, Lyssenko V, et al. Genome-wide association analysis identifies loci for type 2 diabetes and triglyceride levels. Science 2007; 316 : 1331–6. 40. Zeggini E, Weedon MN, Lindgren CM, et al. Replication of genome-wide association signals in UK samples reveals risk loci for type 2 diabetes. Science 2007; 316 : 1336–41. 41. Cauchi S, El Achhab Y, Choquet H, et al. TCF7L2 is reproducibly associated with type 2 diabetes in various ethnic groups : a global meta-analysis. J Mol Med 2007; 85 : 777–82. 42. Saxena R, Gianniny L, Burtt NP, et al. Common single nucleotide polymorphisms in TCF7L2 are reproducibly associated with type 2 diabetes and reduce the insulin response to glucose in nondiabetic individuals. Diabetes 2006; 55 : 2890–95. 43. Campbell IW, Mariz S. β-cell preservation with thiazolidinediones. Diabetes Res Clin Practice 2007; 76 : 163–76. 44. Zeender E, Maedler K, Bosco D, et al. Pioglitazone and sodium salicylate protect human beta-cells against apoptosis and impaired function induced by glucose and interleukin-1beta. J Clin Endocrinol Metab 2004; 89 : 5059–66. 45. Dubois M, Pattou F, Kerr-Conte J, et al. Expression of peroxisome proliferator-activated receptor γ (PPARγ) in normal human pancreatic islet cells. Diabetologia 2000; 43 : 1165–9. 46. Wong VSC, Brubaker PL. From cradle to grave : pancreatic β-cell mass and glucagons-like peptide-1. Minerva Endocrinol 2006; 31 : 107–24. 47. Edvell A, Lindstrom P. Initiation of increased pancreatic islet growth in young normoglycemic mice (umea +/?). Endocrinology 1999; 140 : 778–83. 48. Farilla L, Hui H, Bertolotto C, et al. Glucagon-like peptide-1 promotes islet cell growth and inhibits apoptosis in Zucker diabetic rats. Endocrinology 2002; 143 : 4397–408. 49. Movassat J, Beattie GM, Lopez AD, Hayek A. Exendin 4 up-regulates expression of pdx 1 and hastens differentiation and maturation of human fetal pancreatic cells. J Clin Endocrinol Metab 2002; 87 : 4775–81. 50. Combettes M, Ilic C, Broux O, et al. S40010, a potent Dpp-iv inhibitor, improves long-term glycemic control in db/db mice and increases pancreatic β-cell mass and neogenesis. Diabetes 2007; 56 (suppl 1) : A158. 51. Efendic S, Cerasi E, Elander I, et al. Studies on low insulin responders. Acta Endocrinol 1979; 90 (suppl 224) : 5–32. 52. Cerasi E, Luft R, Efendic S. Decreased sensitivity of the pancreatic beta-cells to glucose in prediabetic and diabetic subjects. A glucose dose-response study. Diabetes 1972; 21 : 224–34. |