| |
| Med Sci (Paris). 2007 November; 23(11): 1014–1020. Published online 2007 November 15. doi: 10.1051/medsci/200723111014.Avancées dans la dissection fonctionnelle du transport intestinal des lipides Emile Levy,1* Marc-André Lavoie,2 Edgard Delvin,1 Ernest Seidman,3 Marie Lambert,1 Daniel Sinnett,1 Alain T. Sané,1 François Leblond,1 Schohraya Spahis,1 and Claude C. Roy1 1Centre de recherche, CHU-Sainte-Justine, 3175, chemin de la Côte Sainte- Catherine, Montréal, Québec, H3T 1C5 Canada. Département de nutrition, Université de Montréal, Montréal (Québec), Canada 2Institut de cardiologie de Montréal, Université de Montréal, Montréal (Québec), Canada 3Institut de recherche, Université McGill, Campus MGH, C10.148.6, Montréal (Québec), Canada |
Les lipides, dont la consommation, très majoritairement sous la forme de triacylglycérols (TG), est de 100 g/jour, sont nécessaires au fonctionnement adéquat de l’organisme [
1]. Ils forment les constituants primordiaux de l’ensemble des membranes plasmiques et intracellulaires. Outre cette propriété structurale, ils représentent les nutriments les plus riches en énergie. Leur β-oxydation dégage ~ 9 kcal par gramme, soit le double de l’énergie fournie par une quantité équivalente d’hydrates de carbone ou de protéines [
2]. Leur rôle ne s’arrête pas là puisqu’ils servent de véhicules pour les vitamines liposolubles, interviennent dans la signalisation intracellulaire et participent à la formation des hormones et des eicosanoïdes [
3]. Par ailleurs, les acides gras (AG) essentiels ω-6 et ω-3 peuvent moduler de nombreuses voies métaboliques et leur déficience affecte non seulement la fonction, mais aussi la croissance et le développement de l’organisme. Au vu des rôles importants mentionnés plus haut, on comprend les raisons pour lesquelles l’organisme s’est doté de mécanismes des plus sophistiqués afin d’acheminer les nutriments lipidiques aux différents tissus, défi non négligeable compte tenu de leur caractère hydrophobe. L’objectif de cet article est de faire le point sur les mécanismes d’absorption intestinale des lipides tout en intégrant dans un corpus de concepts la masse des connaissances nouvellement acquises. En rassemblant les acquis les plus importants des dernières années auxquels notre équipe a d’ailleurs contribué, nous souhaitons illustrer la place que mérite l’intestin grêle, soit celle d’un organe exerçant des fonctions régulatrices et complexes pour moduler l’absorption et le métabolisme des lipides du régime alimentaire. |
Les aliments ingérés ne peuvent traverser la paroi intestinale et se rendre dans la circulation sanguine sans subir une hydrolyse enzymatique complète ou partielle. Dans le cas des lipides, la digestion est amorcée dans l’estomac où la lipase gastrique coupe les liens esters d’une proportion non négligeable de TG [
4–
6] qui constituent plus de 90 % des graisses alimentaires. Les TG restants sont hydrolysés en AG et 2-monoacylglycérols (2-MG) dans l’intestin grêle proximal par le complexe lipase-colipase pancréatique [
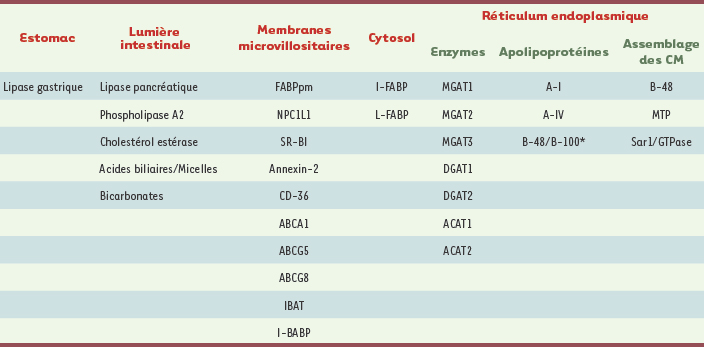
7]. Les autres classes, à savoir les phospholipides (PL) et les esters de cholestérol (EC), sont respectivement dégradées par la phospholipase A2 et la cholestérol (CHOL) estérase, toutes deux sécrétées par le pancréas exocrine. On comprend la difficulté de contact entre ces enzymes lipolytiques hydrosolubles et les substrats lipidiques hydrophobes. Dans ces conditions, seuls les lipides à la surface des gros agrégats peuvent être accessibles aux enzymes lipolytiques, d’où l’importance du brassage mécanique péristaltique déployé par l’estomac et l’intestin et de l’effet émulsifiant des acides biliaires (AB). Grâce à leur effet détergent, essentiellement dû à la nature polaire et hydrosoluble d’une portion de la molécule et du caractère non polaire et liposoluble d’une autre portion, les acides biliaires dispersent et transforment les gros amas lipidiques en fines gouttelettes ou microémulsions (contenant TG, PL et EC) plus accessibles aux enzymes digestives. Une fois que les AB atteignent la concentration critique de 1 à 2 mM, les produits de la digestion peuvent se regrouper en micelles chargées négativement et bien solubles renfermant les 2-MG, le CHOL libre, les lyso-PL et les AG à chaîne longue (AGCL).  | Tableau I.
Facteurs clés dans la digestion et l’absorption des lipides. Sont mentionnés à la fois les facteurs luminaux et intracellulaires qui déterminent l’absorption intestinale des lipides. Seules les enzymes considérées importantes dans l’estérification des lipides sont évoquées. * L’apo B-100 n’est retrouvée dans l’intestin qu’à la période périnatale et dans la lignée cellulaire Caco-2. |
Les AG produits dans l’estomac induisent la libération de l’hormone cholécystokinine (CCK) de la paroi intestinale, déclenchant ainsi le largage concomitant des enzymes pancréatiques et des AB formés dans le foie et entreposés dans la vésicule biliaire [
8]. Nos études ont pu mettre en évidence l’importance de la lipase gastrique dans la digestion des graisses dès la période néonatale et lors de l’insuffisance pancréatique caractérisant la fibrose kystique du pancréas (mucoviscidose) [
9,
10]. Cette maladie génétique autosomique récessive, la plus fréquente dans les populations caucasiennes, détruit le pancréas exocrine qui sécrète normalement enzymes et bicarbonate et entraîne une forte stéatorrhée. Dans ces conditions, l’activité de la lipase gastrique s’élève, ce qui atténue quelque peu la maldigestion des lipides. En revanche, d’autres travaux de notre équipe ont certes souligné les anomalies de la sécrétion biliaire et les dérangements de transport des lipides dans la muqueuse [
11], mais de plus que la déficience en AG essentiels [
12,
13] qui s’installe chez la plupart des patients, peut contribuer à la malabsorption. Expérimentalement, la carence en AG essentiels perturbe de façon marquée le débit et la formation des AB, ainsi que la composition de la bile [
14]. L’installation de ce cycle vicieux devra être évitée par un apport substantiel d’AG essentiels et éventuellement de TG structurés [7]. Après l’hydrolyse des lipides et la micellisation des produits de la digestion, ceux-ci se détachent des micelles et commencent à diffuser à travers la bordure en brosse. Cependant, le microenvironnement immédiat de la muqueuse constitue une pseudo barrière pour les phénomènes de diffusion et de transport étant donné sa composition bien spécifique [
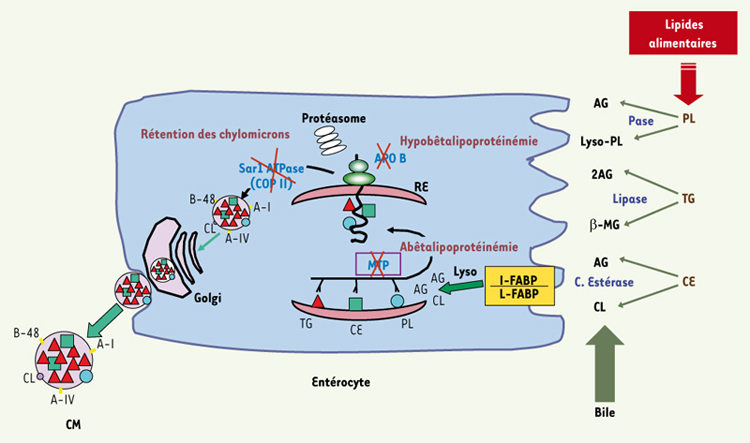
15]. En fait, les groupements acides du glycocalix des microvillosités abaisse le pH dans cette couche aqueuse dite «non remuée» ; la protonation des AG est donc nécessaire pour qu’ils atteignent la membrane des microvillosités. Les AB, dont une minorité sont absorbés de façon passive par le jéjunum, continuent alors leur chemin jusqu’à l’iléon où ils sont absorbés grâce au transporteur membranaire IBAT (ileal sodium-dependent bile acid transporter) et à une protéine cytosolique I-BABP (ileal bile acid binding protein) avant d’être transportés dans la veine porte jusqu’au foie. Il est important de noter qu’outre la déficience de lipolyse et/ou de la solubilisation par les AB, la malabsorption des graisses peut être due à une motilité intestinale perturbée (exemple : vagotomie ou gastrectomie), une altération du pH duodénal (Zollinger-Ellison), une cholestase (obstruction biliaire ou hépatopathie) ou une interruption de la circulation entéro-hépatique (résection iléale, déconjugaison des sels biliaires attribuable au syndrome de prolifération bactérienne).  | Figure 1.
Représentation schématique de la phase d’absorption des lipides. À la suite de la phase digestive où les triacylglycérols (TG) sont hydrolysés par la lipase pancréatique, les esters de cholestérol par la cholestérol estérase et les phospholipides (PL) par la phospholipase (Pase), les produits lipolytiques sont émulsifiés par la bile et absorbés par l’entérocyte. Les transporteurs intracellulaires (FABP) se chargent alors de véhiculer les acides gras (AG), 2-monoacylglycérols (2-MG), lysophospholipides (lyso PL) et cholestérol libre (CL) jusqu’au réticulum endoplasmique (RE) où ils subissent une ré-estérification. Le transfert des TG, des PL et du CE à l’apolipoprotéine (apo) B-48 est assuré par microsomal triglyceride transfer protein (MTP), ce qui protège l’apo B-48 de la dégradation par le protéasome. D’autres apolipoprotéines sont annexées à la macromolécule lipoprotéinique qui est transférée à l’appareil du Golgi grâce au complexe COP II contenant Sar1 GTPase. Des défauts de l’apo B-48, MTP et Sar1 GTPase engendrent respectivement les pathologies : hypobêtalipoprotéinemie, abêtalipoprotéinemie et la maladie de rétention de chylomicron (CM) qui ne permettent pas la poursuite de l’itinéraire jusqu’à la membrane basolatérale pour libérer les CM. |
|
Si on a longtemps considéré la diffusion passive comme la voie d’entrée principale des produits lipolytiques dans les cellules absorbantes étant donné leur caractère lipophile, le concept a été remis en question devant la mise en évidence de transporteurs protéiques spécifiques sur la membrane microvillositaire. Capture et excrétion des lipides par des protéines membranaires On a identifié la protéine liant les AG, la FABPpm ( Fatty Acid Binding Protein) [
16], qui manifeste une forte affinité pour les AGCL, ainsi que le NPC1L1 ( Niemann Pick C1 like 1) [
17], le récepteur «é boueur» SR-BI (scavenger receptor de type BI) [
18], l’annexine-2 [
19] et la protéine CD36 (cluster of differentiation 36) [
20] pour le CHOL. Le rôle de chacune de ces protéines n’a pas encore été bien précisé et on ignore également leur capacité à interagir entre elles. Nos dernières études viennent à peine de révéler que l’invalidation de NPC1L1 affecte l’expression de SR-BI, ainsi que l’entrée et l’homéostasie du CHOL intracellulaire [
21]. Cette observation est particulièrement importante car d’autres protéines prenant place sur la membrane apicale de l’entérocyte participent à l’efflux du CHOL intracellulaire vers la lumière intestinale. C’est le cas de l’ABCA1 (ATP-Binding-Cassette transporter A1) [
22] et de l’ABCG5/G8 [
23] qui sont, respectivement, mobilisés dans l’excrétion du CHOL et des stérols végétaux. Ces transporteurs potentiels pourraient bien, à l’instar de SR-BI, être modulés par des facteurs nutritionnels, hormonaux et pharmacologiques [
24] et, tout comme l’ABCA1, l’ABCG5 et l’ABCG8, être sous le contrôle des facteurs transcriptionnels partenaires de la famille des récepteurs RXR-LXR. Dans ce contexte, il est raisonnable de penser qu’un déséquilibre entre les «capteurs» et les « excréteurs » déterminera l’ampleur de l’absorption du CHOL. Il est à noter qu’à part la fonction de capture de CHOL, le CD36 peut également participer au transport des acides gras. Néanmoins, des études sont nécessaires pour confirmer ce rôle. Facilitation du trafic des AG par les protéines cytosoliques de liaison Une fois les AG ancrés sur la membrane plasmique grâce à la contribution de la FABPpm, ils sont transférés à des protéines cytosoliques de liaison des AG, soit les isoformes I-FABP (intestinale) et L-FABP (hépatique) toutes deux synthétisées par l’entérocyte. Nos observations suggèrent une fonction différente pour les deux : la L-FABP serait probablement chargée de faire converger les AGCL vers le réticulum endoplasmique (RE) pour la formation et la sécrétion des chylomicrons (CM) puisque peu de ces particules sont libérées par les cellules Caco-2 connues pour leur déficience en L-FABP [
25,
26]. De son côté, la I-FABP ne semble pas prêter son concours à cette voie et semblerait guider les AGCL vers d’autres compartiments intracellulaires. Comme l’a démontré notre récente étude, les enfants et adolescents exhibant un polymorphisme de I-FABP (se traduisant par une substitution de l’alanine par la thréonine à la position 54) présentent de plus grands risques d’être atteints de maladie cardiovasculaire [
27]. En culture, des explants intestinaux indiquent également une capacité supérieure de la variante Ala54Thr du I-FABP à synthétiser les lipides et à produire les CM [
28], ce qui avantagerait la consommation des AG par les organes périphériques aux dépens des glucides, faisant ainsi grimper les niveaux de glycémie et, par là, la résistance à l’insuline. Estérification des lipides comme première étape de l’assemblage des CM Une fois les produits lipolytiques dans le RE, ils sont tout d’abord ré-estérifiés avant d’être compactés dans les complexes lipoprotéiniques. La resynthèse passe tout d’abord par une acylation des AG sous forme d’acyl-coenzyme par une acyl-CoA synthétase dans le RE. Les acyl-CoA sont transférées au 2-MG puis forment des TG et par l’action successive des enzymes MGAT (monoacylglycerol acyltransferase) et DGAT (diacylglycerol transferase). À part cette voie appelée monoglyceride pathway mise en jeu en phase post-prandiale [
29], les TG peuvent également être formés par la voie phosphatidic acid, à partir du glycérol-3-phosphate, sous l’action de deux acylations successives par la glycérol phosphate acyltransférase (GPAT), suivies d’une déphosphorylation par la phosphatidate phosphohydrolase et d’une troisième acylation par la DGAT, commune aux deux voies. Ce sentier devient prépondérant en l’absence de MG dans les périodes inter-prandiales. Quant au CHOL, il est majoritairement ré-estérifié sous l’action de l’ACAT (acyl-CoA cholesterol acyltransferase). Finalement, les lyso-PL, issus de l’hydrolyse par la phospholipase A2, sont ré-acylés par des lyso-PL acyltransférases ou par la voie acide-phosphatidique-phosphorylcholine pour reformer des PL. Codées par des gènes appartenant à des familles différentes, deux enzymes DGAT sont présentes dans l’entérocyte. DGAT1 et DGAT2 peuvent expliquer la formation des gouttelettes triglycéridiques, ainsi que leur partition entre le cytosol et le RE. La DGAT1 prendrait en charge les diacylglycérols passant d’une face à l’autre de la bicouche lipidique du RE selon un mécanisme de flip flop rapide [
30], conduisant ainsi à la formation de TG cytosoliques, alors que la DGAT2 serait en charge de la formation de TG dans la lumière du RE. ACAT1 et ACAT2, les deux formes de l’enzyme ACAT participent à l’estérification du CHOL dans l’intestin [
31]. Les souris dont le gène ACAT2 est invalidé et que l’on maintient sous un régime riche en graisses et en CHOL ne développent pas une hypercholestérolémie. L’inhibition de l’ACAT2, localisée aussi dans le foie, entraîne une diminution de l’absorption intestinale du CHOL et s’accompagne d’un effet hypocholestérolémiant. Plusieurs compagnies tentent de mettre au point des molécules qui bloqueraient l’action de ACAT2 et ainsi limiteraient l’absorption du CHOL, ce qui renforcerait le traitement de l’hypercholestérolémie et de la cholélithiase. Formation des CM Les TG, EC et PL ainsi synthétisés sont combinés à l’apolipoprotéine (apo) B-48 sous l’action de la MTP (microsomal transfer protein) pour former les CM. Notons qu’une glycosylation des apolipoprotéines démarre dans le RE et va se poursuivre dans l’appareil de Golgi. Les CM vont transiter grâce au Sar1b GTPase vers l’appareil de Golgi où ils vont s’accumuler sous forme de grains de sécrétion [
32]. Ces derniers vont être exocytés de la partie basale de la cellule épithéliale dans l’espace intercellulaire, acheminés vers la lame basale puis vers le tissu conjonctif sous-épithélial où ils gagnent le chylifère central de la villosité intestinale. Conformément à nos études, des aberrations génétiques (délétions ou mutations) dans l’apo B, le MTP et le Sar1b GTPase [
33–
37] vont entraîner des défauts d’enrobage et d’assemblage, ainsi que du trafic inter-organites, résultant en l’hypobétalipoprotéinémie, l’abétalipoprotéinémie et la rétention des CM. La malabsorption des lipides peut également se produire par une détérioration de la captation due à la diminution de la surface d’absorption et à une dysfonction de la muqueuse (comme c’est le cas dans la maladie coeliaque et la maladie de Whipple), les troubles du système lymphatique (comme dans la lymphangiectasie intestinale, la fibrose rétropéritonéale ou le lymphome) et la diminution de la surface intestinale (comme dans le syndrome de l’intestin court). Protéasome, apo B et surproduction des CM Comme nous l’avons mentionné plus haut, l’apo B-48 est essentielle à la formation et à la sécrétion des CM. Cependant, sa synthèse non régulée peut être nuisible. La voie protéolytique du protéasome représente la stratégie de vigilance majeure empruntée par la cellule pour limiter la production de l’apo B. Nos recherches nous ont amenés à constater que l’intestin peut contribuer à augmenter simultanément la synthèse de l’apo B-48 et les lipoprotéines riches en TG lors de la résistance à l’insuline et du diabète de type 2. Ce phénomène, contribuant à la dyslipidémie diabétique, peut être expliqué par une diminution de la dégradation de l’apoB, assurée par le dysfonctionnement du système ubiquitine-protéasome [
38]. |
Ce survol succinct lève le voile sur la complexité des phases de digestion et d’absorption des lipides et met en évidence le rôle de l’intestin, non seulement dans les syndromes de malabsorption, mais aussi au sein des désordres hyperlipidémiques. Il y aura lieu de centrer les futures recherches sur ces deux champs d’exploration dans le but d’identifier d’autres acteurs clés qui pourraient constituer des cibles thérapeutiques. Ce domaine d’investigation est devenu tout à fait enthousiasmant et prometteur à l’ère des approches protéomiques et génomiques. Ces approches permettront d’améliorer notre compréhension des rapports de cause à effet qui existent entre le régime alimentaire et certaines maladies chroniques qui frappent notre société telles que l’obésité, le diabète de type 2, l’athérosclérose, etc. La nutrition a tardé à explorer les zones frontières où se côtoient la biologie et la médecine moléculaire. Le rattrapage effectué a conduit à l’émergence de la nutrigénomique, cette nouvelle discipline qui couvre l’interaction entre les nutriments et l’expression des gènes; elle caractérise les produits des gènes, leur fonction physiologique, ainsi que leurs interactions. |
1. Mu H, Porsgaard T. The metabolism of structured triacylglycerols. Prog Lipid Res 2005; 44 : 430–48. 2. Mu H, Hoy CE. The digestion of dietary triacylglycerols. Prog Lipid Res 2004; 43 : 105–33. 3. Fernandis AZ, Wenk MR. Membrane lipids as signaling molecules. Curr Opin Lipidol 2007; 18 : 121–8. 4. Ménard D, Monfils S, Tremblay E. Ontogeny of human gastric lipase and pepsin activities. Gastroenterology 1995; 108 : 1650–6. 5. Levy E, Goldstein R, Freier S, et al. Gastric lipase in the newborn rat. Pediatr Res 1982; 16 : 69–74. 6. Roy CC, Roulet M, Lefebvre D, et al. The role of gastric lipolysis on fat absorption and bile acid metabolism in the rat. Lipids 1979; 14 : 811–5. 7. Borgstrom B. On the interactions between pancreatic lipase and colipase and the substrate, and the importance of bile salts. J Lipid Res 1975; 16 : 411–7. 8. Hildebrand P, Beglinger C, Gyr K, et al. Effects of a cholecystokinin receptor antagonist on intestinal phase of pancreatic and biliary responses in man. J Clin Invest 1990; 85 : 640–6. 9. Roy CC, Weber AM, Lepage G, et al. Digestive and absorptive phase anomalies associated with the exocrine pancreatic insufficiency of cystic fibrosis. J Pediatr Gastroenterol Nutr 1988; 7 (suppl 1) : S1–7. 10. Peretti N, Marcil V, Drouin E, et al. Mechanisms of lipid malabsorption in Cystic Fibrosis: the impact of essential fatty acids deficiency. Nutr Metab (Lond) 2005; 2 (1) : 11. 11. Abrams CK, Hamosh M, Lee TC, et al. Gastric lipase: localization in the human stomach. Gastroenterology 1988; 95 : 1460–4. 12. Lepage G, Levy E, Ronco N, et al. Direct transesterification of plasma fatty acids for the diagnosis of essential fatty acid deficiency in cystic fibrosis. J Lipid Res 1989; 30 : 1483–90. 13. Levy E, Lepage G, Bendayan M, et al. Relationship of decreased hepatic lipase activity and lipoprotein abnormalities to essential fatty acid deficiency in cystic fibrosis patients. J Lipid Res 1989; 30 : 1197–209. 14. Levy E, Garofalo C, Thibault L, et al. Intraluminal and intracellular phases of fat absorption are impaired in essential fatty acid deficiency. Am J Physiol 1992; 262 : G319–26. 15. Thomson AB, Schoeller C, Keelan M, et al. Lipid absorption: passing through the unstirred layers, brush-border membrane, and beyond. Can J Physiol Pharmacol 1993; 71 : 531–55. 16. Stremmel W. Uptake of fatty acids by jejunal mucosal cells is mediated by a fatty acid binding membrane protein. J Clin Invest 1988; 82 : 2001–10. 17. Altmann SW, Davis HR, Jr, Zhu LJ, et al. Niemann-Pick C1 Like 1 protein is critical for intestinal cholesterol absorption. Science 2004; 303 : 1201–4. 18. Levy E, Menard D, Suc I, et al. Ontogeny, immunolocalisation, distribution and function of SR-BI in the human intestine. J Cell Sci 2004; 117 : 327–37. 19. Smart EJ, De Rose RA, Farber SA. Annexin 2-caveolin 1 complex is a target of ezetimibe and regulates intestinal cholesterol transport. Proc Natl Acad Sci USA 2004; 101 : 3450–5. 20. Werder M, Han CH, Wehrli E, et al. Role of scavenger receptors SR-BI and CD36 in selective sterol uptake in the small intestine. Biochemistry 2001; 40 : 11643–50. 21. Sane AT, Sinnett D, Delvin E, et al. Localization and role of NPC1L1 in cholesterol absorption in human intestine. J Lipid Res 2006; 47 : 2112–20. 22. Repa JJ, Turley SD, Lobaccaro JA, et al. Regulation of absorption and ABC1-mediated efflux of cholesterol by RXR heterodimers. Science 2000; 289 : 1524–9. 23. Berge KE, Tian H, Graf GA, et al. Accumulation of dietary cholesterol in sitosterolemia caused by mutations in adjacent ABC transporters. Science 2000; 290 : 1771–5. 24. Peretti N, Delvin E, Sinnett D, et al. Asymmetrical regulation of scavenger receptor class B type I by apical and basolateral stimuli using Caco-2 cells. J Cell Biochem 2006; 100 : 421-33.. 25. Levy E, Mehran M, Seidman E. Caco-2 cells as a model for intestinal lipoprotein synthesis and secretion. FASEB J 1995; 9 : 626–35. 26. Montoudis A, Delvin E, Menard D, et al. Intestinal-fatty acid binding protein and lipid transport in human intestinal epithelial cells. Biochem Biophys Res Commun 2006; 339 : 248–54. 27. Stan S, Lambert M, Delvin E, et al. Intestinal fatty acid binding protein and microsomal triglyceride transfer protein polymorphisms in French-Canadian youth. J Lipid Res 2005; 46 : 320–7. 28. Levy E, Menard D, Delvin E, et al. The polymorphism at codon 54 of the FABP2 gene increases fat absorption in human intestinal explants. J Biol Chem 2001; 276 : 39679–84. 29. Trotter PJ, Storch J. Fatty acid esterification during differentiation of the human intestinal cell line Caco-2. J Biol Chem 1993; 268 : 10017–23. 30. Farese RV, Jr., Cases S, Smith SJ. Triglyceride synthesis: insights from the cloning of diacylglycerol acyltransferase. Curr Opin Lipidol 2000; 11 : 229–34. 31. Chang CC, Sakashita N, Ornvold K, et al. Immunological quantitation and localization of ACAT-1 and ACAT-2 in human liver and small intestine. J Biol Chem 2000; 275 : 28083–92. 32. Siddiqi SA, Gorelick FS, Mahan JT, et al. COPII proteins are required for Golgi fusion but not for endoplasmic reticulum budding of the pre-chylomicron transport vesicle. J Cell Sci 2003; 116 : 415–27. 33. Jones B, Jones EL, Bonney SA, et al. Mutations in a Sar1 GTPase of COPII vesicles are associated with lipid absorption disorders. Nat Genet 2003; 34 : 29–31. 34. Levy E, Marcel YL, Milne RW, et al. Absence of intestinal synthesis of apolipoprotein B-48 in two cases of abetalipoproteinemia. Gastroenterology 1987; 93 : 1119–26. 35. Roy CC, Levy E, Green PH, et al. Malabsorption, hypocholesterolemia, and fat-filled enterocytes with increased intestinal apoprotein B. Chylomicron retention disease. Gastroenterology 1987; 92 : 390–9. 36. Levy E, Roy CC, Thibault L, et al. Variable expression of familial heterozygous hypobetalipoproteinemia: transient malabsorption during infancy. J Lipid Res 1994; 35 : 2170–7. 37. Ricci B, Sharp D, O’Rourke E, et al. A 30-amino acid truncation of the microsomal triglyceride transfer protein large subunit disrupts its interaction with protein disulfide-isomerase and causes abetalipoproteinemia. J Biol Chem 1995; 270 : 14281–5. 38. Zoltowska M, Ziv E, Delvin E, et al. Cellular aspects of intestinal lipoprotein assembly in Psammomys obesus: a model of insulin resistance and type 2 diabetes. Diabetes 2003; 52 : 2539–45. |