| |
| Med Sci (Paris). 2007 November; 23(11): 1029–1031. Published online 2007 November 15. doi: 10.1051/medsci/200723111029.Un peu moins de répit pour les cancers du foie ? Jean Rosenbaum,* Ludovic Ménard, Valérie Haurie, and Danièle Taras Inserm U889, Université Victor Segalen-Bordeaux 2, 146, rue Léo Saignat, 33076 Bordeaux Cedex, France MeSH keywords: Carcinome hépatocellulaire, Protéines de transport, Tumeurs du côlon, Humains, Tumeurs du foie, Mélanome, Protéines tumorales |
Malgré d’importants progrès récents, les mécanismes moléculaires de la carcinogenèse hépatique restent très imparfaitement connus. Plus encore, les perspectives thérapeutiques sont extrêmement minces. C’est pour cette raison que notre équipe a décidé de rechercher de nouveaux acteurs de la carcinogenèse hépatique, et de nouvelles cibles thérapeutiques potentielles, à l’aide d’une étude comparative du protéome de quatre carcinomes hépatocellulaires (CHC) et du foie péri-tumoral correspondant [
1]. Ce travail a permis de mettre en évidence de nombreuses protéines dont l’expression est dérégulée dans les CHC, et parmi elles, la reptine (encore appelée RUVBL2, TIP48 ou TIP49b). Jusqu’alors, la reptine avait été étudiée essentiellement dans des organismes modèles où elle avait été détectée dans des complexes de haut poids moléculaire impliqués dans le remodelage de la chromatine, la régulation transcriptionnelle, ou la réparation de l’ADN, comme INO80 [
2] ou TIP60 [
3]. La reptine a une importante homologie avec la pontine ; ces deux protéines sont proches de l’hélicase bactérienne RuvB et appartiennent à la famille des AAA+ ATPases. Elles interagissent l’une avec l’autre en formant des dodécamères contenant un hexamère de chaque protéine [
4]. Notre attention avait été attirée par l’interaction de ces protéines avec deux oncogènes importants pour le CHC, la β-caténine [
5] et c-myc [
6]. La plupart des travaux montraient que la reptine se comportait comme un antagoniste de l’activité transcriptionnelle du complexe β-caténine/TCF-LEF alors que la pontine avait une activité agoniste ; cependant, récemment d’autres travaux ont révélé que la reptine était nécessaire à l’effet répresseur de la β−caténine sur l’expression du gène anti-métastatique KAI-1/CD82 [
7]. |
Rôle de la reptine dans les carcinomes hépatocellulaires Dans notre travail [
8], nous avons d’abord examiné en détail l’expression de la reptine dans les CHC provenant de la collection de CHC réalisée à Bordeaux dans le cadre du Centre de Ressources Biologiques sur le CHC (http://chc.isped.u-bordeaux2.fr/). L’étude faite sur 96 cas de CHC par RT-PCR en temps réel, en collaboration avec l’équipe de Jessica Zucman-Rossi (INSERM U674), a confirmé la surexpression de la reptine dans la majorité des tumeurs. En utilisant les annotations de ces tumeurs, nous avons pu démontrer qu’un taux élevé de reptine était un facteur indépendant de mauvais pronostic. Les taux de reptine n’étaient en revanche pas influencés par la présence d’une mutation activatrice de la β-caténine et n’étaient pas non plus corrélés au taux d’expression de c-myc. Afin d’analyser le rôle de la reptine dans la carcinogenèse hépatique, nous avons modulé son expression dans des cellules de CHC en culture. L’expression de la reptine a été diminuée de façon très efficace par transfection transitoire de petits ARN interférents. Cette diminution entraîne un arrêt de croissance des cellules avec un double blocage du cycle cellulaire en G1 et en G2/M. Celui-ci est suivi d’une mort apoptotique, associée à l’activation conformationnelle des protéines pro-apoptotiques Bax et Bak et de la caspase 3. La déplétion de la reptine s’accompagne aussi d’une augmentation de l’expression au niveau transcriptionnel de nombreuses protéines pro-apoptotiques (Bad, Bak, Bid, BclXs). Ces résultats suggéraient que la reptine était nécessaire à la croissance et à la survie des cellules de CHC. Nous avons alors conduit les expériences réciproques en surexprimant la reptine dans ces cellules à l’aide d’un vecteur lentiviral codant la reptine avec une étiquette Flag. Malgré l’obtention par cette méthode d’un taux élevé d’ARNm de la reptine, il n’a pas été possible de surexprimer très efficacement la protéine : cette discordance, qui démontre l’existence d’un contrôle post-transcriptionnel, fait l’objet actuellement de travaux dans le laboratoire. En dépit de la surexpression limitée, les cellules exprimant la Flag-reptine démontrent des avantages nets par rapport aux cellules témoins. Elles ont ainsi une capacité de croissance accrue en agar mou et sont plus résistantes que les témoins à l’apoptose induite par le céramide. Enfin, injectées sous la peau de souris immunodéprimées, elles forment des tumeurs plus rapidement progressives. Ainsi toutes les données concordent pour indiquer que la surexpression de la reptine dans les CHC pourrait jouer un rôle important dans la progression tumorale, notamment en protégeant les cellules tumorales de l’apoptose. Le mécanisme intime de cet effet, et notamment le lien éventuel avec la β-caténine et c-myc, reste à préciser. |
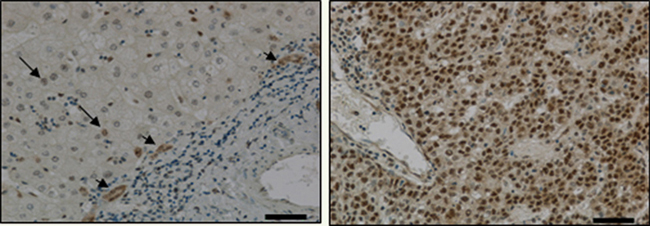
Relocalisation de la reptine dans le cytoplasme des cellules tumorales De façon inattendue, nous avons aussi mis en évidence par immunohistochimie une relocalisation partielle de la reptine dans le cytoplasme des cellules tumorales, alors qu’elle était exclusivement nucléaire dans les hépatocytes normaux (Figure 1). Ces résultats suggèrent que la reptine pourrait jouer un rôle spécifique dans le cytoplasme des cellules tumorales. Une hypothèse est qu’elle pourrait y séquestrer un facteur pro-apoptotique avec lequel elle interagit, comme Hint-1 [
9] ou ATF-2 [
10]. Notre équipe tente d’élucider le mécanisme du trafic nucléo-cytoplasmique de la reptine ainsi que ses fonctions cytoplasmiques.  | Figure 1.
Mise en évidence de la surexpression de la reptine dans un CHC par immunohistochimie. La partie gauche représente une partie non tumorale du foie qui présente un faible marquage dans le noyau de certains hépatocytes (flèches) et un marquage intense dans les cellules épithéliales biliaires (têtes de flèches) en périphérie d’une bande fibreuse. La tumeur (à droite) présente un marquage intense de toutes les cellules tumorales dans le noyau et dans le cytoplasme. La barre indique 50 µm. |
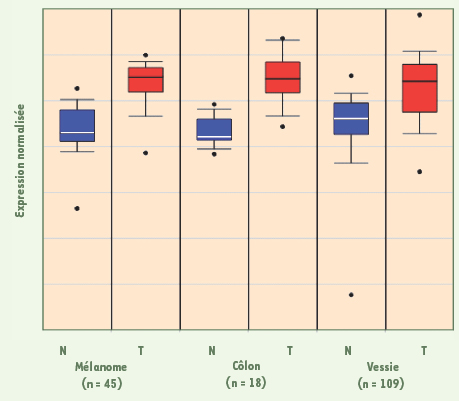
C’est à notre connaissance la première fois qu’une analyse protéomique comparative de CHC a mis en évidence une protéine dont l’importance physiopathologique potentielle a pu être secondairement démontrée par des expériences de génomique fonctionnelle. La surexpression de la reptine dans un cancer n’avait pas été rapportée directement avant ce travail. Néanmoins, l’analyse de données de transcriptome publiées (http://www.oncomine.org) permet de retrouver aussi une surexpression dans 3 autres types de cancers (Figure 2). Globalement, la reptine pourrait être une cible dans le traitement des CHC et peut-être d’autres tumeurs, en particulier dans la mesure où elle porte une activité enzymatique (ATPase) contre laquelle on pourrait trouver des inhibiteurs. Nous utilisons actuellement différents modèles animaux afin d’apporter la preuve du concept que la reptine est effectivement une cible attractive.  | Figure 2.
Expression de l’ARNm de la reptine dans divers types de cancers. Le graphe représente les niveaux d’expression normalisés de l’ARNm de la reptine mesurés par la technologie Affymetrix dans des tissus normaux (N) et dans les tumeurs du même tissu (T). Le haut et le bas de chaque boîte représentent les 75 e et 25 e percentiles, respectivement. Les moustaches représentent les écarts maximaux et la ligne horizontale dans la boîte représente la valeur médiane de la distribution. Les données ont été obtenues sur le site Oncomine ( http://www.oncomine.org) et proviennent des études suivantes : pour le mélanome [
11] ; pour le cancer du côlon [
12] ; pour le cancer de la vessie [
13]. |
|
1. Blanc JF, Lalanne C, Plomion C, et al. Proteomic analysis of differentially expressed proteins in hepatocellular carcinoma developed in patients with chronic viral hepatitis C. Proteomics 2005; 5 : 3778–89. 2. Shen X, Mizuguchi G, Hamiche A, et al. A chromatin remodelling complex involved in transcription and DNA processing. Nature 2000; 406 : 541–4. 3. Ikura T, Ogryzko VV, Grigoriev M, et al. Involvement of the TIP60 histone acetylase complex in DNA repair and apoptosis. Cell 2000; 102 : 463–73. 4. Puri T, Wendler P, Sigala B, et al. Dodecameric structure and ATPase activity of the human TIP48/TIP49 complex. J Mol Biol 2007; 366 : 179–92. 5. Bauer A, Chauvet S, Huber O, et al. Pontin52 and reptin52 function as antagonistic regulators of beta-catenin signalling activity. EMBO J 2000; 19 : 6121–30. 6. Wood MA, McMahon SB, Cole MD. An ATPase/helicase complex is an essential cofactor for oncogenic transformation by c-Myc. Mol Cell 2000; 5 : 321–30. 7. Kim JH, Kim B, Cai L, et al. Transcriptional regulation of a metastasis suppressor gene by Tip60 and beta-catenin complexes. Nature 2005; 434 : 921–6. 8. Rousseau B, Ménard L, Haurie H, et al. Overexpression and role of the ATPase and putative DNA helicase RuvB-like 2 in human hepatocellular carcinoma. Hepatology 2007; 46 : 1108–18. 9. Weiske J, Huber O. The histidine triad protein Hint1 interacts with Pontin and Reptin and inhibits TCF-beta-catenin-mediated transcription. J Cell Sci 2005; 118 : 3117–29. 10. Cho SG, Bhoumik A, Broday L, et al. TIP49b, a regulator of activating transcription factor 2 response to stress and DNA damage. Mol Cell Biol 2001; 21 : 8398–413. 11. Talantov I, Mazumder A, Yu JX, et al, Novel genes associated with malignant melanoma but not benign melanocytic lesions. Clin Cancer Res 2005; 11 : 7234–42. 12. Graudens R, Boulanger V, Mollard C, et al, Deciphering cellular states of innate tumor drug responses. Genome Biol 2006; 7 : R19. 13. Sanchez-Carbayo C, Socci ND, Lozano J, et al. Defining molecular profiles of poor outcome in patients with invasive bladder cancer using oligonucleotide microarrays. J Clin Oncol 2006; 24 : 778–89. |