Les mitochondries, organelles essentielles à la production d’énergie, possèdent leur propre matériel génétique : l’ADN mitochondrial (ADNmt). Chez les vertébrés et la plupart des invertébrés, l’ADNmt code pour treize sous-unités protéiques entrant dans la composition des complexes enzymatiques du système de transport des électrons et de l’ATP synthase. Les autres composantes de ce système sont codées par le génome nucléaire (ADNnu). Chaque produit des gènes de l’ADNmt interagit donc avec des protéines codées par l’ADNnu pour assurer la respiration mitochondriale. Dans le règne animal, l’ADNmt est transmis exclusivement de façon maternelle (strict maternal inheritance, SMI) [ 1]. Toutes les copies d’ADNmt dans chacune des cellules d’un organisme possèdent une séquence nucléotidique identique, une situation nommée homoplasmie. La transmission maternelle et l’homoplasmie permettent d’éviter toute compétition inter-mitochondriale (en empêchant la coexistence de différents ADNmt dans les cellules ou l’hétéroplasmie) et assurent le maintien d’une interaction fonctionnelle entre les protéines codées par l’ADNnu et l’ADNmt. La SMI prévient ainsi toute modification du dialogue entre les mitochondries et le noyau, ce qui risquerait de provoquer l’apparition de phénotypes indésirables (tel qu’un déficit de production d’énergie sous forme d’ATP) [2, 3]. Exceptionnellement, un seul système mitochondrial « défie » les lois de transmission des mitochondries chez les animaux, soit celui observé chez les moules marines et les moules d’eau douce [ 4]. Les espèces possédant ce système atypique, désigné sous le nom de double transmission uniparentale (doubly uniparental inheritance, DUI), sont caractérisées par la présence de deux ADNmt distincts qui sont hérités de façon maternelle (ADNmt F) ou paternelle (ADNmt M). Typiquement, les femelles sont homoplasmiques et contiennent uniquement l’ADNmt F tandis que les mâles sont hétéroplasmiques. Chez ces derniers, l’ADNmt F domine dans les tissus somatiques alors que la gonade contient presque exclusivement l’ADNmt M. Les divergences observées entre les ADNmt F et M chez les moules peuvent atteindre plus de 20 % à 30 % [ 5]. Ces valeurs sont stupéfiantes puisqu’il suffit qu’un ADNmt muté diverge de moins de 0,0001 % (1 mutation ponctuelle) de l’ADNmt natif pour que se développent des pathologies chez l’être humain. Cette situation particulière confronte notre conception classique du système universel de l’héritabilité maternelle de l’ADNmt chez les animaux. Une différence fondamentale entre les systèmes SMI et DUI est que ce dernier est le seul mode de transmission de l’ADNmt animal qui permet à un génome mitochondrial d’origine paternelle de s’adapter à des fonctions mâles. Autrement dit, chez les moules, la sélection peut agir directement sur l’ADNmt paternel puisqu’il ne représente plus un cul-de-sac évolutif.
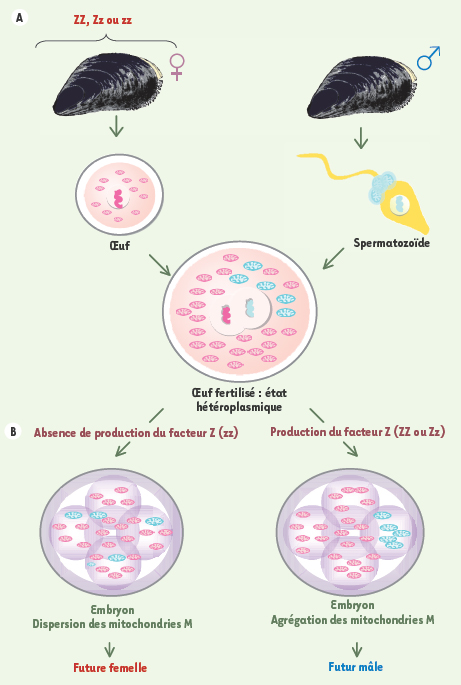
Chez les mammifères, la diminution importante du nombre de copies d’ADNmt au cours de la spermatogenèse, l’absence de réplication de l’ADNmt au sein de l’ovocyte et l’élimination spécifique des mitochondries paternelles dans l’ovocyte sont autant de mécanismes avancés pour rendre compte de l’absence de transmission de l’ADNmt paternel [ 6]. Le mécanisme de reconnaissance et de destruction des mitochondries paternelles est médié par le système ubiquitine ; l’ubiquitinylation étant un processus de « marquage » des protéines condamnées à être détruites. Des études récentes ont suggéré qu’un système similaire, mais légèrement modifié, opérerait chez les moules [ 7, 8]. Un facteur génétique d’origine nucléaire présent dans l’œuf serait responsable de la rétention des mitochondries paternelles chez les futures mâles en entravant le système ubiquitine. Plus spécifiquement, chez les embryons destinés à devenir des femelles, les mitochondries paternelles se dispersent aléatoirement dans les cellules et/ou sont détruites par un processus semblable à l’ubiquitinylation, tandis que chez les embryons destinés à devenir des mâles, les mitochondries du sperme sont préférentiellement canalisées vers les cellules primordiales qui formeront la gonade, rendant ainsi l’ADNmt paternel la composante prédominante chez la lignée germinale mâle (Figure 1).
| Figure 1.
Modèle expliquant la double transmission uniparentale chez les moules. Les mitochondries des gamètes mâles et femelles (A) forment la population mitochondriale dans l’œuf fertilisé (B) le modèle prédit que le génotype de l’œuf est responsable du comportement des mitochondries : les oeufs possédant l’allèle dominant Z vont produire le facteur Z. Ce facteur bloque un système d’élimination des mitochondries paternelles similaire à l’ubiquitine et permet la rétention et l’agrégation des mitochondries paternelles dans la future gonade mâle. Les œufs récessifs zz ne produisent pas de facteur Z et les mitochondries paternelles sont dispersées ou éliminées dans les embryons destinés à devenir des femelles (modifiée d’après [4]). |
Deux hypothèses, qui ne sont pas mutuellement exclusives, ont été proposées pour expliquer l’origine et le maintien du système de la double transmission uniparentale de l’ADNmt chez certains bivalves au cours de l’histoire évolutive [ 9, 10] : (1) la lignée mitochondriale paternelle est maintenue car elle permet une adaptation de l’ADNmt mâle pour des fonctions spécifiques aux spermatozoïdes (e.g. motilité, longévité) et (2), le maintien de l’ADNmt paternel est nécessaire car celui-ci détient un rôle prépondérant pour la détermination du sexe mâle chez les moules. Afin de vérifier la première hypothèse, nous avons étudié une irrégularité du système DUI qui survient chez la moule bleue Mytilus. En effet, certains individus mâles de cette espèce possèdent un ADNmt F recombinant (qui possède une origine de réplication mâle mais une séquence codante maternelle) dans leur gonade qui se transmet de père en fils par les spermatozoïdes comme un ADNmt M standard. En comparant la vitesse de nage et l’activité des enzymes mitochondriales des spermatozoïdes contenant un ADNmt M versus ceux contenant un ADNmt F recombinant, nous avons démontré que les spermes associés à l’ADNmt hypothétiquement adapté pour les fonctions spermatiques (l’ADNmt M standard) possédaient une motilité et des activités enzymatiques mitochondriales diminuées (travaux non publiés). Même si ces résultats ne réfutent pas l’hypothèse d’une adaptation de l’ADNmt M pour des fonctions mâles autres que la motilité du sperme, ils nous renvoient à l’hypothèse d’un rôle de l’ADNmt M pour la détermination du sexe chez les moules mâles. En effet, il est possible qu’une fois les mitochondries paternelles ségrégées dans les cellules primordiales chez les embryons destinés à devenir des mâles, l’ADNmt M jouerait un rôle dans la différentiation des cellules germinales et dans le développement de la gonade mâle.
L’existence des mitochondries est connue depuis les années 1850, mais c’est seulement récemment que nous avons commencé à comprendre leur extraordinaire complexité et le rôle crucial qu’elles occupent dans plusieurs processus vitaux. En nous offrant la possibilité d’étudier deux variants mitochondriaux fortement divergents qui coexistent et s’adaptent simultanément à un génome nucléaire, le système DUI pourrait nous permettre d’acquérir de nouvelles connaissances sur les interactions et la co-adaptation des génomes nucléaire et mitochondriaux. En outre, ce système pourrait permettre de démystifier les mécanismes de transmission de l’ADNmt ainsi que d’explorer son rôle potentiel dans la détermination du sexe.