| |
| Med Sci (Paris). 2007 December; 23(12): 1082–1084. Published online 2007 December 15. doi: 10.1051/medsci/200723121082.Baisse des capacités régénératives du foie avec l’âge Quelques pistes moléculaires… Hélène Gilgenkrantz* and Jacques-Emmanuel Guidotti Inserm U567, CNRSUMR 81-04, Institut Cochin, 24, rue du Faubourg Saint-Jacques, 75014 Paris, France MeSH keywords: Vieillissement, Protéine alpha liant les séquences stimulatrices de type CCAAT, Humains, Foie, Régénération hépatique, Modèles biologiques |
Le temps ne fait rien à l’affaire…
Avec le temps, va tout s’en va… : ainsi en est-il de la régénération hépatique ! Bien sûr, la baisse des capacités régénératives avec l’âge n’est pas propre au foie. La sénescence induit également une moindre capacité réparatrice de la peau ou du muscle et une diminution de la qualité ou de la quantité de certaines cellules souches. Pourtant, peu d’explications moléculaires ont été avancées jusqu’à présent pour expliquer la perte des capacités prolifératives avec l’âge. Le raccourcissement des télomères et la composition du complexe qui y est associé interviennent dans la limitation de la capacité réplicative de certaines cellules, notamment lorsque celles-ci se divisent en permanence [
1]. Deux pistes avaient été suggérées pour le foie qui, finalement, pourraient n’en former qu’une ! Après avoir retiré chirurgicalement les deux tiers du foie d’une souris jeune, 95 % des hépatocytes restants sortent de leur quiescence de façon quasi-synchrone décrivant un pic de synthèse d’ADN étroit. Cette prolifération contrôlée du foie est le fruit de l’activation d’une cascade de gènes savamment orchestrée codant notamment des cytokines, des facteurs de transcription, des facteurs de croissance et finalement des protéines du cycle cellulaire [
2]. Par conséquent, aucune population cellulaire spécifique dite souche n’est requise au cours de ce processus. En revanche, chez la souris de plus de 12 mois, le pic de synthèse d’ADN est considérablement émoussé. De même, la progression en mitose est significativement diminuée et l’induction des protéines nécessaires à la prolifération est retardée. |
C/EBPα et diminution de l’activité régénérative du foie âgé L’équipe de G. Darlington (Houston, États-Unis), avait démontré, il y a environ 10 ans, que le foie de vieux rats contenait des niveaux anormalement élevés du facteur de transcription C/EBPα alors que ce dernier diminue de 4 fois chez l’animal jeune après hépatectomie [
3]. Or, les animaux dépourvus de C/EBPα ont une augmentation de leur prolifération hépatocytaire prénatale, suggérant un rôle négatif de C/EBPα sur la progression du cycle cellulaire. Après des années de recherches infructueuses pour tenter d’identifier les cibles transcriptionnelles de C/EBPα, il semble qu’en réalité ce facteur ralentisse le cycle cellulaire en inhibant directement dans le foie, les kinases cdk2 et cdk4 [
4,
5] et potentiellement en interagissant avec les facteurs E2F et Rb (Retinoblastoma). Timchenko et son équipe (Houston, Texas) ont alors mis en évidence, spécifiquement dans le foie de souris âgées (22 mois), un complexe protéique de haut poids moléculaire qui comprend, en dehors du facteur C/EBPa, les protéines E2F4, Rb et Brahma (Brm) [
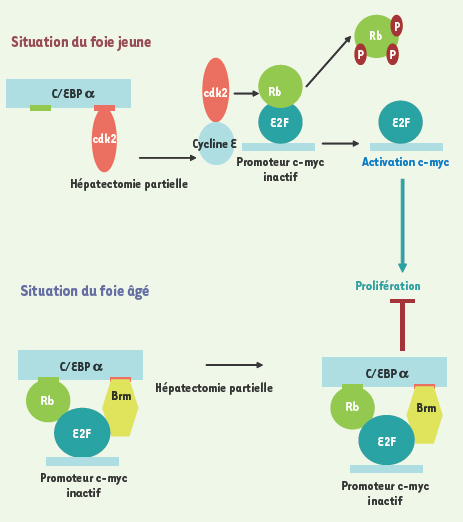
6]. Des expériences d’immuno-précipitation ont alors montré que l’interaction protéique était directe entre C/EBPα et Brm. En revanche, et contrairement au foie de souris jeune (8 mois), aucune association n’est retrouvée avec la protéine cdk2. L’augmentation du facteur Brm dans le foie des animaux âgés semble responsable de ce changement de nature des complexes avec l’âge [6]. Brm et cdk interagissant avec la même région du facteur C/EBPα, on peut émettre l’hypothèse d’une inhibition compétitive entre ces facteurs (Figure 1).
 | Figure 1.
Hypothèse de modèle pour la baisse de capacité proliférative du foie âgé. Dans un foie jeune, le stimulus prolifératif provoqué par l’hépatectomie partielle induit une induction des cyclines comme la cycline E qui libère cdk2 du complexe qu’elle forme avec C/EBPα. La phosphorylation de la protéine Rb par cdk2 permettra alors la levée d’inhibition des promoteurs dépendant du facteur E2F comme celui du gène c-myc. Dans le foie âgé au contraire, le promoteur de c-myc ou celui de FoxM1B est déjà occupé par un complexe protéique de haut poids moléculaire comprenant E2F4-Rb-Brm et C/EBPα qui ne peut être déplacé par le stimulus de prolifération induit par la chirurgie. |
|
Des expériences de parabiose, déjà relatées dans ces colonnes [
7], ont alors suggéré qu’existait dans le sérum d’animaux jeunes un facteur susceptible de déplacer le complexe Brm-Rb-E2F4. La circulation sanguine artificiellement croisée d’une souris jeune et d’une souris âgée permet en effet d’observer, dans le foie de l’animal âgé, la diminution du complexe C/EBPα-Brm [
8]. Néanmoins, il n’a pas été démontré dans ce travail que cette diminution s’accompagnait d’une restauration de la capacité proliférative des hépatocytes. De même, le principe actif de ce sérum de jouvence n’a pas alors été identifié. |
L’entrée en scène du facteur FoxM1B Le facteur de transcription FoxM1B (Forkhead box m1 B) appartient à une famille de protéines à domaine Forkhead. Il est exprimé dans les cellules en prolifération, son niveau d’expression augmentant dès l’entrée en phase S, persistant jusqu’à la fin de la mitose et s’éteignant lorsque les cellules sortent du cycle cellulaire. Son contrôle de l’expression de nombreuses protéines du cycle, actives au cours de la transition G1/S et de la mitose, en fait un acteur essentiel pour le programme mitotique et la stabilité chromosomique [
9]. Les animaux transgéniques surexprimant FoxM1B dans leur foie régénèrent plus rapidement. Fait plus remarquable encore, des animaux âgés de plus de 12 mois surexprimant ce facteur, même transitoirement, ont une capacité régénérative équivalente à celle d’animaux jeunes non transgéniques [
10,
11]. Or, l’hormone de croissance (GH) qui diminue chez les sujets âgés était connue pour restreindre la fonte musculaire, la diminution de la masse osseuse et de l’épaisseur de la peau lorsqu’elle est injectée chez l’homme âgé. Le secret de l’élixir de jouvence pourrait-il se trouver dans l’hormone de croissance ? L’équipe de R. Costa, qui fut à l’origine de l’essentiel des travaux menés sur le facteur FoxM1B, a alors démontré que la GH humaine augmentait significativement la régénération du foie d’animaux âgés en même temps que le niveau d’expression du facteur FoxM1B. En revanche, l’administration de GH chez la souris dépourvue de FoxM1B hépatique ne restaure pas la capacité proliférative des hépatocytes [
12]. Si ce résultat ne permet pas d’affirmer que la GH est le facteur sérique de jouvence pressenti, il suggère en tout cas qu’un foie de souris âgée peut recouvrer une activité régénérative dite « jeune » par injection de GH à des concentrations physiologiques. |
Un pont jeté entre deux rives… Un lien peut-il être établi entre ces deux voies ? C’est la question que s’est naturellement posé N. Timchenko [
13]. Des souris âgées de 24 mois ont été traitées pendant une semaine par l’hormone de croissance humaine. L’analyse de leur foie révèle que, contrairement aux animaux non traités, la protéine C/EBPα n’est plus détectée dans les fractions de haut poids moléculaire. A contrario, la protéine Brm n’est pas modifiée. Ainsi, le traitement par la GH semble déplacer C/EBPα de son association avec Brm. L’occupation du promoteur de FoxM1B a été analysée par immunoprécipitation de chromatine, révélant la présence du complexe C/EBPα-Brm sur la séquence du promoteur FoxM1B issu d’hépatocytes de foies âgés après hépatectomie et non sur celle de foies jeunes ou sur celui de souris traitées par l’hormone de croissance. En libérant C/EBPα, l’hormone de croissance lève donc l’inhibition de l’expression de facteurs essentiels à la progression du cycle cellulaire dont notamment FoxM1B. |
Une conclusion… télomérique ! Il est étonnant d’observer que la seule surexpression de FoxM1B suffise à restaurer la capacité proliférative d’hépatocytes qui semblaient l’avoir perdue avec le temps. Il n’en est peut-être pas de même chez l’homme. En effet, une des différences majeures entre l’homme et la souris est la longueur des télomères. Ainsi, faut-il attendre plusieurs générations chez la souris déficiente en télomérase pour observer un raccourcissement des télomères et une diminution des capacités régénératives [
14]. Tout laisse supposer que dans un foie humain vieillissant, des altérations télomériques déjà établies pourraient empêcher l’hormone de croissance ou la surexpression de FoxM1B de restaurer la capacité régénérative perdue. Retenons déjà une chose, point n’est besoin de vendre son âme au diable pour avoir accès à l’élixir de jouvence… à condition d’être une souris ! |
1. Gire V. La sénescence : une barrière télomérique à l’immortalité ou une réponse cellulaire aux stress physiologiques ? Med Sci (Paris) 2005; 21 : 491–7. 2. Taub R. Liver regeneration: from myth to mechanism. Nat Rev 2004, 5 : 836–47. 3. Timchenko NA, Wilde M, Kosai KI, et al. Regenerating livers of old rats contain hifh levels of C/EBPa that correlate with altered expression of cell cycle associated proteins. Nucleic Acids Res 1998; 26 : 3293–9. 4. Wang H, Iakova P, Wilde M, et al. C/EBPa arrests cell proliferation through direct inhibition of cdk2 and cdk4. Mol Cell 2001; 8 : 817–28. 5. Wang H, Goode T, Iakova P, et al. C/EBPa triggers proteasome-dependent degradation of cdk4 during growth arrest. EMBO J 2002; 21 : 903–41. 6. Iakova P, Awad SS, Timchenko NA. Aging reduces proliferative capacities of liver by switching pathways of C/EBPa growth arrest. Cell 2003; 113 : 495–506. 7. Gilgenkranrz H. À la recherche de nos capacités régénératives perdues. Med Sci (Paris) 2005; 21 : 480. 8. Conboy IM, Conboy MJ, Wagers AJ, et al. Rejuvenation of aged progenitor cells by exposure to a young systemic environment. Nature 2005; 433 : 760–4. 9. Laoukili J, Kooistra MRH, Bras A, et al. FoxM1B is required for execution of the mitotic programme and chromosome stability. Nat Cell Biol 2005; 7 : 126–36. 10. Wang X, Quali E, Hung NJ, et al. Increased levels of forkhead box M1B transcription factor in transgénic mouse hepatocytes prevent age-related proliferation defects in regenerating liver. Proc Natl Acad Sci USA 2001; 98 : 11468–73. 11. Wang X, Krupczak-Hollis K, Tan Y, et al. Increased hepatic forkhead box M1B (FoxM1B) levels in Old-aged mice stimulated liver regeneration through diminished p27kip1 protein levels and increased Cdc25B expression. J Biol Chem 2002; 277 : 44310–6. 12. Krupczak-Hollis K, Wang X, Dennewitz MB, R. Costa. Growth hormone stimulates proliferation of old-aged regenerating liver through forkhead Box m1B. Hepatology 2003; 38 : 1552–62. 13. Wang GL, Shi X, Salisbury E, et al. Growth hormone corrects proliferation and transcription of phosphoenolpyruvate carboxykinase in livers of old mice via elimination of CCAAT/enhancer-binding protein a-Brm complex. J Biol Chem 2007; 282 : 1468–78. 14. Kahn A. Télomères, maladies et vieillissement. Med sci (Paris) 2005; 21 : 451–2. |