La nature même du diagnostic psychiatrique, fondé sur la détection d’un ensemble de symptômes, favorise une hétérogénéité symptomatique parmi les groupes de patients. Une telle hétérogénéité se traduit par une variabilité interindividuelle notable des corrélats neuronaux mesurés lors d’une étude de neuro-imagerie. Les conséquences se manifestent à la fois par le masquage de certaines anomalies spécifiques à un sous-type de patients et par des résultats scientifiques variables voire contradictoires obtenus via différentes études. Par exemple, bien qu’une altération des interactions cortico-limbiques soit généralement observée chez les patients déprimés, il a également été proposé que des anomalies affectant les ganglions de la base ou encore les cortex prémoteur et préfrontal latéral soient propres au sous-type dépressif mélancolique. De plus, certains symptômes cliniques semblables sont observés dans plusieurs maladies psychiatriques : cette situation complique donc le repérage et la signification attribuée à des altérations cérébrales particulières à chacune des maladies. En complémentarité avec l’approche diagnostique usuelle, l’approche symptomatique en neuro-imagerie pourrait permettre de mieux caractériser les groupes de patients et d’identifier des anomalies cérébrales liées à une vulnérabilité à développer un trouble psychiatrique. L’étude des corrélats neuronaux de l’anhédonie (réduction de la capacité à ressentir du plaisir) représente un exemple intéressant de l’approche symptomatique. L’anhédonie peut être observée à la fois chez des personnes ne souffrant d’aucun trouble psychiatrique et chez certains patients dépressifs, psychotiques ou sujet à un abus de drogue ou d’alcool [ 1, 2, 11, 12]. La capacité à ressentir le plaisir est souvent estimée à l’aide de l’échelle révisée d’anhédonie physique de Chapman (PAS - L.J. Chapman, J.P. Chapman - test non publié, 1978) [1]. La PAS est un auto-questionnaire comprenant 61 affirmations telles que « On surestime beaucoup la beauté des couchers de soleil » ou « J’apprécie souvent une bonne et chaleureuse poignée de mains ». Le sujet doit répondre « vrai ou faux » à chacune des affirmations et le score d’anhédonie physique est ensuite comptabilisé. La PAS a été validée dans plusieurs pays (notamment la France, les États-Unis et l’Allemagne) et constitue l’une des échelles les plus utilisées pour l’étude du trait anhédonique.
Des études antérieures suggèrent qu’un trait anhédonique mesuré dans une population non-clinique pourrait provenir d’une altération neuropsychophysiologique susceptible de constituer un marqueur de vulnérabilité à la schizophrénie [ 3, 4] ou à la dépression majeure [ 5]. Nous avons donc utilisé l’imagerie par résonance magnétique (IRM) afin d’identifier les corrélats neuronaux de la capacité hédonique dans un groupe de 29 sujets ne souffrant d’aucun trouble psychiatrique [ 6]. La PAS a d’abord été remplie par chacun des participants. Ces derniers ont ensuite été soumis à un examen IRM pendant lequel ils ont observé une série d’images au contenu émotionnel. Les images étaient divisées en trois catégories : les images à valence neutre (objets communs, personnes attendant l’autobus), à valence négative (scènes de destruction, animaux dangereux) et à valence positive (beaux paysages, sport entre amis). L’activité cérébrale liée au traitement de l’information hédonique a été obtenue en comparant directement l’activité cérébrale mesurée pendant l’observation des images positives à celle mesurée pendant l’observation des images neutres. Les corrélats fonctionnels de la capacité hédonique ont ensuite été obtenus en établissant une correspondance entre l’activité cérébrale hédonique et le score individuel obtenu à la PAS. L’examen d’IRM comprenait également une séquence anatomique ayant permis d’obtenir une image 3D détaillée du cerveau. Nous avons donc pu repérer les corrélats structuraux de la capacité hédonique en faisant une analyse morphométrique par voxels (VBM). Grâce à cette analyse, nous avons pu circonscrire les régions dont le volume attestait d’un rapport significatif avec le niveau d’anhédonie. Nous avons obtenu deux résultats principaux (Figure 1) :
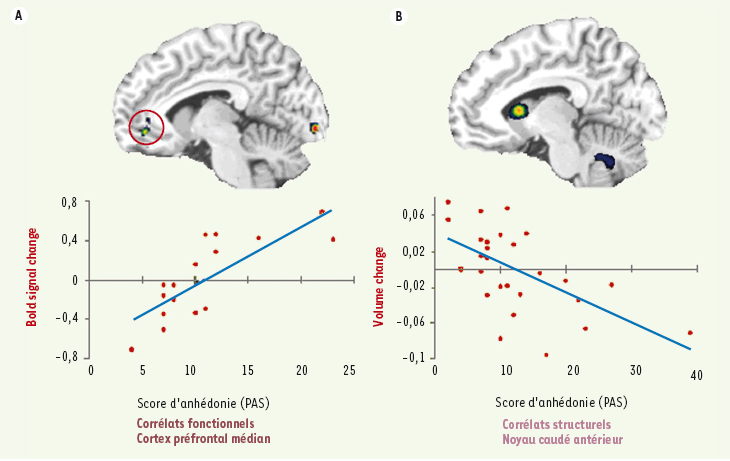
| Figure 1.
A. Corrélation positive entre l’activité cérébrale du cortex préfrontal médian (signal BOLD - l’axe y) et le score d’anhédonie (Échelle PAS - l’axe x) durant le traitement de l’information hédonique. B. Résumé du résultat principal de l’analyse morphométrique par voxels (optimized VBM) en montrant la corrélation négative entre le volume du noyau caudé antérieur et le score d’anhédonie. |
- au niveau fonctionnel, le score obtenu à la PAS trouvait un écho « positif » avec l’activité du cortex préfrontal médian (CPFM), et ce spécifiquement pendant le traitement hédonique. En d’autres mots, un trait anhédonique était associé à une activité accrue du CPFM ;
- au niveau structurel, le score obtenu à la PAS trouvait une correspondance « négative » avec le volume du noyau caudé antérieur (NCA) et du nucleus accumbens (NA). Ainsi, un trait anhédonique était associé à une réduction volumétrique de ces régions.
Notre résultat montrant qu’une capacité réduite à ressentir le plaisir est associée à une activité accrue du CPFM est à première vue surprenant, sachant que cette région est habituellement activée par les stimuli émotionnels [ 7]. Pourtant, nous avons reproduit un résultat récemment publié dans la revue Biological Psychiatry montrant que la sévérité de l’anhédonie chez des patients déprimés est positivement corrélée à l’activité du CPFM durant la présentation de stimuli positifs [ 8]. Il a été suggéré que cette activation accrue du CPFM en lien avec une capacité hédonique réduite pourrait être le reflet d’une plus grande attention portée aux stimuli positifs. En effet, il est possible que les sujets anhédoniques traitent l’information hédonique à un niveau plus cognitif dans le but d’essayer de ressentir davantage l’émotion positive. Cette hypothèse est d’ailleurs en accord avec le rôle important du CPFM dans les interactions cognition-émotion [7]. Bien que l’association fonctionnelle entre l’anhédonie et le CPFM soit encore peu comprise, il apparaît de plus en plus clair qu’une réduction de la capacité hédonique soit liée au niveau d’engagement du CPFM lors du traitement émotionnel.
Les résultats de notre analyse VBM suggèrent qu’un trait anhédonique est lié à un volume réduit du NCA et du NA. Des études de neuro-imagerie ont démontré que des récompenses financières ou la présentation de stimuli hédoniques augmentaient l’activité dans le NA et le NCA [ 9, 10]. Il est donc logique qu’une réduction volumétrique de ces régions puisse avoir un effet sur la capacité hédonique d’une personne. Toutefois, la cause d’une telle réduction volumétrique n’est pas claire et le lien fonctionnel entre le NA/NCA et l’anhédonie doit être mieux défini.
Le but de notre travail était de repérer des régions cérébrales dont l’activité ou le volume varient en fonction de la capacité hédonique. Plusieurs études longitudinales ont déjà montré qu’un trait anhédonique est associé à une plus grande vulnérabilité à subir un trouble psychiatrique [3–5]. Ainsi, les corrélats neuronaux de l’anhédonie pourraient permettre d’identifier les réseaux neuronaux liés à cette vulnérabilité. Il convient de souligner qu’au-delà des résultats préliminaires de notre étude, la notion même de marqueurs neuronaux d’une vulnérabilité aux troubles psychiatriques requiert la mise en place d’études longitudinales où la valeur prédictive de tels marqueurs pourra être mesurée. Des marqueurs neuronaux potentiels, couplés à des variations génétiques spécifiques (polymorphismes), pourraient ultimement permettre d’identifier des individus présentant un risque de développer des maladies psychiatriques. Des biomarqueurs spécifiquement associés à l’anhédonie pourraient également contribuer à raffiner les diagnostics psychiatriques en décelant un sous-type de dépression majeure ou de schizophrénie dès l’admission du patient. En ce sens, la prochaine étape de nos travaux sera consacrée à l’étude des corrélats neuronaux de l’anhédonie chez des patients souffrant de schizophrénie et de dépression majeure.