| |
| Med Sci (Paris). 2007 February; 23(2): 124–126. Published online 2007 February 15. doi: 10.1051/medsci/2007232124.Effets néfastes du rayonnement UVA solaire : de nouveaux indices dans l’ADN Thierry Douki,1* Marie-Thérèse Leccia,2 Jean-Claude Béani,2 Stéphane Mouret,1 Jean Cadet,1 and Alain Favier1 1Laboratoire Lésions des Acides Nucléiques, DRFMC/SCIB UMR-E 3 CEA-UJF, CEA-Grenoble, 38054 Grenoble Cedex 9, France 2Service de Dermatologie, Centre Hospitalier Universitaire de Grenoble, Domaine de la Merci, 38706 La Tronche Cedex, France MeSH keywords: Adolescent, Adulte, Marqueurs biologiques, Enfant, ADN, Altération de l'ADN, Humains, Tumeurs radio-induites, Pyrimidine dimère, Tumeurs cutanées, Lumière solaire, Produits antisolaires, Rayons ultraviolets |
Soleil et cancer de la peau Les cancers de la peau sont les plus fréquentes de toutes les pathologies cancéreuses chez l’homme. Leur incidence a considérablement augmenté ces dernières décennies en raison principalement des habitudes d’exposition de la population (expositions solaires importantes lors des loisirs, utilisation de lampes à bronzer). L’incidence des carcinomes cutanés, formes cliniques les plus fréquentes, est estimée en Europe à 40 cas annuels pour 100 000 habitants, ce chiffre étant sans doute sous-estimé car une grande partie de ces tumeurs ne sont ni analysées ni répertoriées par les registres du cancer. L’incidence des mélanomes, cancers cutanés les plus graves du fait du risque important d’évolution métastatique, est estimée en France à environ 10 cas pour 100 000 habitants. Il s’agit de l’un des cancers dont le taux d’incidence augmente le plus rapidement [
1], et qui fait partie des cancers prioritaires à surveiller pour l’Institut National de Veille Sanitaire. Les données cliniques, épidémiologiques et expérimentales attestent sans ambiguïté du rôle fondamental des radiations ultraviolettes UVB et UVA dans la cancérogenèse cutanée, auquel s’ajoutent les prédispositions génétiques des sujets [
2]. Le rôle du soleil dans le développement des cancers cutanés est toutefois plus complexe que ce que l’on a longtemps cru. En effet, alors que la survenue des kératoses actiniques, lésions précancéreuses, et des carcinomes épidermoïdes est étroitement liée aux doses cumulées au long de la vie, il semble que ce soit les expositions intenses, génératrices de coups de soleil, en particulier dans l’enfance, qui jouent un rôle crucial dans l’apparition des carcinomes basocellulaires et des mélanomes. L’élément essentiel pour éviter le développement de ces cancers reste la prévention fondée sur des mesures de dépistage précoce des lésions suspectes et surtout de photoprotection, primordiale pendant l’enfance et l’adolescence. |
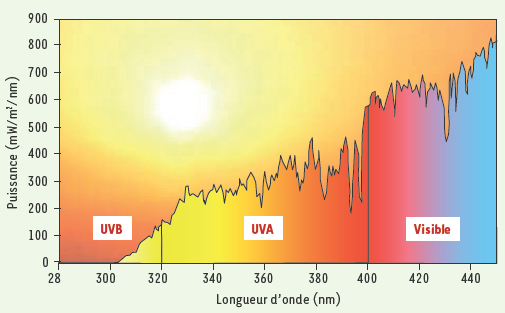
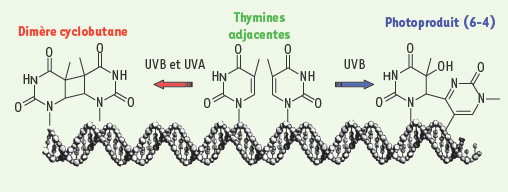
Le danger des UVB pour l’ADN D’un point de vue moléculaire, l’effet cancérigène du rayonnement UV solaire s’explique par sa capacité à endommager l’ADN des cellules cutanées. C’est la lumière UVB (290-320 nm), la plus énergétique (Figure 1), qui est la plus dommageable pour le génome. La raison de cette agressivité est connue depuis près d’un demi-siècle : les photons UVB sont directement absorbés par l’ADN dans lequel ils induisent des réactions photochimiques. Les principales cibles en sont les bases pyrimidiques thymine et cytosine qui, si elles sont situées en positions adjacentes dans la double hélice, réagissent deux à deux en créant de nouvelles liaisons covalentes. La structure chimique des bases est ainsi fortement altérée puisqu’elles se retrouvent sous forme de photoproduits, classés dans deux catégories : les dimères cyclobutane et les photoproduits (6-4) ces appellations faisant référence à la nature des liaisons formées pour créer le dommage (Figure 2) [
3]. Ces modifications de l’ADN perturbent fortement le fonctionnement de la cellule et peuvent induire sa mort ou, plus grave, des mutations qui peuvent déclencher les processus impliqués dans l’apparition de tumeurs [
4].  | Figure 1.
Spectre de la lumière solaire à la surface terrestre. La portion située entre 280 et 320 nm correspond au rayonnement UVB et celle entre 320 et 400 nm à l’UVA. Seuls les UVB sont significativement absorbés par l’ADN des cellules. |
 | Figure 2.
Structures chimiques des photoproduits induits dans l’ADN par le rayonnement UV par réaction de deux thymines adjacentes : les dimères cyclobutane (CDP) et les photoproduits pyrimidine (6-4) pyrimidone. Par exposition aux UVB, ces deux types de dommages se forment aussi avec des cytosines. À l’inverse, l’irradiation UVA conduit presque exclusivement à la formation du dimère cyclobutane thymine-thymine. |
|
Le rayonnement UVA, une autre source de dommage photo-induits Si le rayonnement UVB est le plus délétère pour l’ADN, il est heureusement un composant minoritaire de la lumière solaire. C’est en fait la région UVA (320-400 nm) qui représente la partie la plus abondante du rayonnement UV. Il est apparu au cours des 15 dernières années que les UVA étaient également mutagènes et pouvaient induire des tumeurs chez des animaux [
5]. Problème pour les photobiologistes : l’ADN n’absorbe que très peu les photons UVA. L’action génotoxique de ces derniers n’est donc pas directe comme l’est celle des UVB. Or, il est établi que le rayonnement UVA, en excitant certains composés endogènes jouant un rôle de photosensibilisateurs [
6], induit la production d’espèces réactives de l’oxygène. Ces dernières peuvent alors endommager les composants cellulaires (lipides, protéines, etc.) et même extracellulaires comme la matrice dermique. Il a donc été rapidement admis que l’action génotoxique des UVA impliquait des processus oxydatifs. Cela a été illustré par la formation de cassures de la double hélice et de bases oxydées dans des cellules exposées au rayonnement UVA [
7,
8]. D’autres travaux ont cependant mis en évidence que les UVA pouvaient également induire la formation de dimères cyclobutane [
9,
10], comme le font les UVB mais avec une efficacité bien moindre. Ces résultats ont été longtemps négligés, souvent considérés à tort comme dus à la présence de traces d’UVB dans les sources UVA utilisées. |
Un nouveau mode d’action génotoxique des UVA La mise au point d’outils analytiques performants a permis à notre équipe, en collaboration avec l’Institut Curie d’Orsay et les Laboratoires Pierre Fabre Dermo-Cosmétique, d’apporter des éléments nouveaux pour l’implication des dimères cyclobutane dans la génotoxicité des UVA. Dans un premier temps, nous avons observé, dans des cellules en culture, que la nature des photoproduits bipyrimidiques induits par les rayonnements UVB et UVA dans l’ADN était très différente [
11,
12]. En effet, l’exposition aux UVA ne conduit qu’à la formation de dimères cyclobutane avec une absence totale de photoproduits (6-4). Autre différence majeure, ce sont essentiellement les sites contenant deux thymines adjacentes qui sont endommagés par les UVA, alors que les cytosines sont aussi des cibles importantes des UVB. Les processus photochimiques impliqués dans la formation des dimères cyclobutane sont donc clairement différents pour les deux régions du spectre ultraviolet. Plus inattendu, la quantité de ces photoproduits induits par le rayonnement UVA est supérieure à celle des dommages de l’ADN issus de réactions d’oxydation, à l’encontre de ce qui était couramment accepté. Plus récemment, nous avons montré que l’ensemble de ces observations étaient également vraies pour la peau humaine [
13]. De plus, en comparant la fréquence des photoproduits dans des kératinocytes en culture avec celle mesurée dans des biopsies de peau, nous avons observé que les couches protectrices supérieures de l’épiderme n’atténuent que faiblement les effets génotoxiques du rayonnement UVA, alors qu’une protection importante est apportée contre ceux induits par les photons UVB. Un autre élément à prendre en compte est la vitesse de réparation des dimères cyclobutane, plus lente après exposition aux UVA qu’après exposition aux UVB [13]. |
La photoprotection UVA, une nécessité en santé humaine Ces diverses observations montrant le rôle important d’une nouvelle classe de dommages de l’ADN induits par les UVA renforcent la notion que ces derniers sont agressifs pour la peau et qu’une protection efficace contre tous les effets délétères du soleil doit être dirigée contre les UVA comme contre les UVB. L’analyse de la protection offerte par les produits de protection solaire contre les cancers cutanés l’a mis à jour sans ambiguïté [
14]. Plusieurs études épidémiologiques ont en effet montré un risque relatif face aux cancers cutanés plus élevé chez les utilisateurs habituels de produits solaires. La seule explication pertinente pour ces résultats troublants est l’absence de protection contre les UVA dans les produits utilisés. À l’inverse, des études récentes ont montré que l’utilisation de produits à large spectre prévient la survenue des carcinomes épidermoïdes et des kératoses actiniques [
15], et limite la survenue de nouveaux nævus chez l’enfant, paramètre dont le lien avec le risque de mélanome est clairement établi [
16]. Pour mieux prendre en compte cette nécessité de protection contre les UVA, les experts réunis par L’Agence Française de Sécurité Sanitaire des Produits de Santé ont établi en 2006 des recommandations portant sur les qualités intrinsèques des produits, les méthodes de calcul des coefficients de protection, l’étiquetage et les conseils d’utilisation.1 En particulier, le rapport des coefficients de protection en UVB et UVA doit être au plus de 3, ce qui pose le problème de la mesure des facteurs de protection. Si cette mesure est parfaitement standardisée pour les UVB, bien que fondée uniquement sur l’apparition de coup de soleil [
17], il n’en est pas de même pour les UVA. Le paramètre le plus couramment utilisé en France est la protection contre la pigmentation immédiate persistante. Malheureusement, les spectres d’action diffèrent fortement selon l’effet biologique considéré ; déduire que la protection qu’offre un produit contre la pigmentation immédiate renseigne sur sa valeur protectrice contre les cancers cutanés se révèle donc pour le moins hâtif ! De fait, il y a aujourd’hui largement place pour définir un coefficient de protection reposant sur l’analyse de phénomènes biologiques impliqués dans la cancérogenèse, comme la formation des dimères cyclobutane. |
L’équipe LAN du CEA-Grenoble remercie les Laboratoires Pierre Fabre Dermo-Cosmétique pour leur soutien financier et scientifique lors des études impliquant les cellules cutanées et la peau.
|
Footnotes |
1. Remontet L, Estève J, Bouvier AM, et al. Estimations nationales : tendances de l’incidence et de la mortalité par cancer en France de 1978 à 2000 (Institut National de Veille Sanitaire). BEH 2003; 41–42 : 190–3. 2. Zanetti R, Rosso S, Martinez C, et al. The multicenter south European study « Helios ». I. Skin characteristics and sunburns in basal and squamous cell carcinomas of the skin. Br J Cancer 1996; 73: 1440–6. 3. Magnaldo T. La « guerre » du NER (nucleotide excision repair). Med Sci (Paris) 2004; 20 : 268–70. 4. Melnikova VO, Ananthaswamy HN. Cellular and molecular events leading to the development of skin cancer. Mutat Res 2005; 571 : 91–106. 5. Sage E, Moustacchi E. Un rôle pour les UVA dans les dommages solaires causés à l’ADN. Med Sci (Paris) 1996; 12 : 806. 6. Wondrak GT, Jacobson MK, Jacobson EL. Endogenous UVA-photosensitizers: mediators of skin photodamage and novel targets for skin photoprotection. Photochem Photobiol Sci 2006; 5 : 215–37. 7. Peak JG, Peak MJ. Comparison of initial yields of DNA-to-protein crosslinks and single-strand breaks induced in cultured human cells by far- and near-ultraviolet light, blue light and X-rays. Mutat Res 1991; 246 : 187–91. 8. Rosen JE, Prahalad AK, Williams GM. 8-Oxodeoxyguanosine formation in the DNA of cultured cells after exposure to H2O2 alone or with UVB or UVA irradiation. Photochem Photobiol 1996; 64 : 117–22. 9. Kielbassa C, Roza L, Epe B. Wavelength dependence of oxidative DNA damage induced by UV and visible light. Carcinogenesis 1997; 18 : 811–6. 10. Perdiz D, Grof P, Mezzina M, et al. Distribution and repair of bipyrimidine photoproducts in solar UV-irradiated mammalian cells. Possible role of Dewar photoproducts in solar mutagenesis. J Biol Chem 2000; 275 : 26732–42. 11. Douki T, Reynaud-Angelin A, Cadet J, et al. Bipyrimidine photoproducts rather than oxidative lesions are the main type of DNA damage involved in the genotoxic effect of solar UVA radiation. Biochemistry 2003; 42 : 9221–6. 12. Courdavault S, Baudouin C, Charveron M, et al. Larger yield of cyclobutane dimers than 8 oxo-7,8-dihydroguanine in the DNA of UVA-irradiated human skin cells. Mutat Res 2004; 556 : 135–42. 13. Mouret S, Baudouin C, Charveron M, et al. Cyclobutane pyrimidine dimers are predominant DNA lesions in whole human skin exposed to UVA radiation. Proc Natl Acad Sci USA 2006; 103 : 13765–70. 14. Beani JC. Photoprotecteurs externes et cancers cutanés. Ann Dermatol Venereol 1996; 123 : 666–74. 15. Green A, Williams G, Neale R, et al. Daily sunscreen application and betacarotene supplementation in prevention of basal-cell and squamous-cell carcinomas of the skin: a randomised controlled trial. Lancet 1999; 354 : 723–9. 16. Gallagher RP, Rivers JK, Lee TK, et al. Broad-spectrum sunscreen use and the development of new nevi in white children: a randomized controlled trial. JAMA 2000; 283: 2955–60. 17. Beani JC. La photoprotection externe. In : Photodermatologie. Paris : Arnette, 2003 : 131–46. |