| |
| Med Sci (Paris). 2007 February; 23(2): 180–186. Published online 2007 February 15. doi: 10.1051/medsci/2007232180.Modèles animaux des maladies neuro-dégénératives Dominique Langui,1 François Lachapelle,1,2 and Charles Duyckaerts1* 1Laboratoire de Neuropathologie Raymond Escourolle, Hôpital de la Salpêtrière, 47, boulevard de l’Hôpital, 75651 Paris Cedex 13, France 2Inserm U546, CHU Pitié-Salpêtrière, 91, boulevard de l’Hôpital, 75634 Paris Cedex 13, France |
 Les maladies neurodégénératives provoquent des lésions bilatérales et habituellement symétriques, affectant avec une grande sélectivité des groupes cellulaires circonscrits. Pour la plupart des phénotypes, sinon tous, on connaît des formes sporadiques (maladie de Parkinson idiopathique commune, par exemple) et génétiques (maladie de Parkinson par mutation de l’α-synucléine, par exemple). Les maladies d’Alzheimer, de Parkinson, de Huntington ou de Friedreich, ainsi que les ataxies spinocérébelleuses, sont des exemples de maladies neurodégénératives que nous aurons l’occasion de considérer dans cet article. Les maladies neurodégénératives provoquent des lésions bilatérales et habituellement symétriques, affectant avec une grande sélectivité des groupes cellulaires circonscrits. Pour la plupart des phénotypes, sinon tous, on connaît des formes sporadiques (maladie de Parkinson idiopathique commune, par exemple) et génétiques (maladie de Parkinson par mutation de l’α-synucléine, par exemple). Les maladies d’Alzheimer, de Parkinson, de Huntington ou de Friedreich, ainsi que les ataxies spinocérébelleuses, sont des exemples de maladies neurodégénératives que nous aurons l’occasion de considérer dans cet article. |
Phénotype clinique et compréhension des mécanismes moléculaires des maladies neurodégénératives La perspective de cet article étant thérapeutique, l’accent est placé sur les modèles permettant de mieux comprendre le mécanisme moléculaire des maladies neurodégénératives, afin de développer des traitements étiologiques. La maîtrise du phénotype clinique n’a, sous cet angle, qu’une importance toute relative. De fait, dans le système nerveux, c’est la topographie des lésions qui détermine les signes cliniques : une lésion de la circonvolution frontale ascendante, quelle que soit sa nature, provoque une hémiplégie ; celle de l’hippocampe, un trouble de la mémoire ; celle de l’aire visuelle primaire, une hémianopsie. Pour reproduire un phénotype, il faut et il suffit de détruire la structure concernée. À titre d’exemple, le « clampage » des vaisseaux cérébraux à destinée cérébrale provoque chez le rat une affection qui présente des analogies phénotypiques avec la démence d’Alzheimer [
1]. Le contraire aurait été étonnant : la destruction du cortex, quelle que soit sa cause, provoque une démence. En tirer la conclusion que la maladie d’Alzheimer est d’origine vasculaire serait à notre avis une erreur. Autrement dit, le phénotype « démence » de l’animal ne nous apprend rien ou très peu sur la maladie d’Alzheimer. À l’inverse, les protéines partenaires de la Huntingtine, mutée chez les patients atteints de chorée de Huntington, peuvent être recherchées chez Caenorhabditis elegans : or, nul n’irait penser que ce ver est un modèle des troubles cognitifs humains. En d’autres termes, la reproduction du phénotype clinique a aujourd’hui beaucoup moins d’importance, en pathologie expérimentale neurologique, que la reproduction du mécanisme moléculaire, ou de la lésion, que l’on cherche à entraver. Il nous importera donc somme toute assez peu que la souris Alzheimer ne soit pas « démente », pourvu qu’elle ait des plaques séniles ou des dégénérescences neurofibrillaires. Dans cette perspective thérapeutique, la découverte d’une mutation dans une maladie neurodégénérative est considérée aujourd’hui comme une chance exceptionnelle d’aborder sa physiopathologie. Elle conduit à la production de souches transgéniques ou à l’inactivation du gène, en général chez la souris. Il est illusoire de tenter aujourd’hui un recensement, même incomplet, des modèles transgéniques de maladies neurodégénératives. Leur multitude correspond à la multitude des mécanismes physiopathologiques existants. Elle démontre, s’il en était besoin, qu’il n’existe pas une « neurodégénérescence » dont les maladies humaines ne seraient que des avatars phénotypiques, mais qu’au contraire chacune d’entre elle relève d’un mécanisme spécifique souvent complexe. Même en nous limitant aux exemples les plus illustratifs, l’énumération peut en paraître fastidieuse, mais elle laisse apercevoir le dynamisme de ce nouveau champ de recherches. Pour nous placer dans une perspective historique, nous envisagerons d’abord rapidement quelques points concernant les modèles toxiques et naturels, les plus anciennement connus. |
Les modèles toxiques ont principalement deux intérêts : ils pourraient correspondre à la physiopathologie de certaines maladies neurodégénératives, et ils sont facilement reproductibles et donc volontiers utilisés dans la recherche thérapeutique à visée symptomatique. Il faut cependant garder à l’esprit que le phénotype obtenu (la mort d’une population spécifique de neurones) peut être similaire dans la maladie humaine et dans son modèle, alors que la cause de la mort neuronale peut être différente. Ce n’est pas parce qu’une toxine tue sélectivement des neurones dopaminergiques qu’elle est la cause de la maladie de Parkinson… Ces modèles ne sont donc pas nécessairement adaptés à la recherche thérapeutique. Les éventuelles causes toxiques des maladies neurodégénératives sont particulièrement difficiles à mettre en évidence, et seules des circonstances spéciales permettent de faire rapidement le lien entre une molécule comme la MPTP (1-méthyl-4-phényl-1, 2, 3, 6-tétrahydropyridine, voir plus loin) et les signes cliniques qu’elle provoque. L’origine toxique de syndromes du type SLA (sclérose latérale amyotrophique) - démence ou Parkinson-démence a été évoquée à plusieurs reprises : c’est ainsi que la cycade, graine du faux palmier, a été tenue responsable du syndrome SLA-démence de l’île de Guam [
2] ; de même, la consommation de décoctions provenant d’annonacées (comme le corossol) a été incriminée dans les syndromes parkinsoniens atypiques observés en Guadeloupe [
3]. La première de ces plantes contient la neurotoxine β-méthylamino-L-alanine (BMAA) et la seconde des acétogénines, puissants inhibiteurs du complexe I de la chaîne respiratoire mitochondriale. Des maladies de Parkinson observées chez des consommateurs de drogues artisanales ont fait découvrir la MPTP, également inhibiteur du complexe I de la chaîne respiratoire et responsable de la mort des neurones de la substantia nigra [
4]. Cette substance est aujourd’hui couramment utilisée pour provoquer expérimentalement une dénervation dopaminergique, notamment pour tester des thérapeutiques substitutives visant à compenser l’effet de la perte d’un groupe cellulaire spécifique. |
On a longtemps cru qu’il existait des modèles naturels des maladies neurodégénératives humaines. De nombreux phénotypes neurologiques, comme ceux observés chez les lignées de souris Reeler, Weaver et Staggerer, présentant des troubles de l’équilibre et de la marche, ont en effet été identifiés puis sélectionnés chez les animaux d’élevage. Les lésions, en rapport avec une perte de fonction de la protéine dont le gène est muté, concernent principalement le développement du cervelet. Contrairement à ce que l’on aurait pu croire, ces trois lignées ne sont pas des modèles d’ataxie humaine. La mutation du gène Reln [
5] provoque une anomalie de migration neuronale responsable des lésions cérébelleuses chez la souris Reeler, mais, chez l’homme, d’une lissencéphalie [
6]. La Reelin - produit du gène Reln - a également été incriminée dans des cas de schizophrénie [
7]. Chez la souris Weaver [
8], les cellules des grains du cervelet et les neurones dopaminergiques de la substantia nigra [
9] sont sélectivement touchés [
10,
11]. La mutation non-sens concerne le gène Girk2 [
12], mais la recherche d’une mutation dans le gène humain homologue s’est révélée jusqu’ici négative [
13]. Chez la souris Staggerer, l’atrophie du cervelet est due à une perte des cellules de Purkinje et des cellules de la couche des grains. Le gène staggerer code le facteur de transcription RORα, un récepteur nucléaire [
14] dont la mutation n’a jamais été identifiée chez l’homme. En conclusion, les phénotypes des modèles naturels ont évoqué ceux des affections humaines, et cette similitude a laissé penser que les lignées sélectionnées pouvaient être utiles pour la recherche des mécanismes physiopathologiques. Il s’agissait le plus souvent de fausses pistes, et la plupart des prédictions se sont révélées erronées, démontrant, une nouvelle fois, qu’analogie phénotypique ne signifiait pas parenté mécanistique. |
Stratégies de mise au point de modèles animaux L’introduction d’un gène humain muté ou son inactivation chez un animal de laboratoire constitue une approche plus directe que l’identification de phénotypes naturels. La souris est l’animal de choix. Elle est plus facile à manipuler et à entretenir que le rat, et a fortiori le primate, et les génomes murin et humain sont relativement proches dans leur structure. La transgenèse additionnelle, première méthode développée, est rarement idéale : insertion à l’aveugle de copies multiples du gène ; surexpression parfois massive de la protéine qu’il code ; modification éventuelle et imprévue du développement embryonnaire ; topographie d’expression parfois anormale, conditionnée par le promoteur associé au transgène ou par un promoteur naturel dépendant du site d’insertion ; effets variables suivant le fond génétique ; persistance de l’expression du gène sauvage. Les altérations observées chez l’animal transgénique conduisent donc souvent à choisir entre deux interprétations alternatives : véritable mécanisme physiopathologique ou traduction d’une voie artificielle de dégradation en rapport avec une surproduction ou une production ectopique de la protéine en cause ? La recombinaison homologue (knock-in, KI), qui invalide le gène sauvage et place le transgène sous le contrôle du promoteur naturel, ou l’expression conditionnelle permettant de contrôler la chronologie de l’expression du transgène, pallient certains des inconvénients mentionnés ci-dessus. Les modèles transgéniques, même évolués, ne permettent pas de reproduire tous les aspects de la maladie humaine qui fait en général intervenir un réseau de protéines interagissant en partenaires : la probabilité que toutes les protéines partenaires d’une espèce (la souris) aient les mêmes affinités réciproques que les molécules humaines est en effet très faible. La chance de mimer un effet s’amenuise donc avec le nombre d’interactions qui le sépare de la protéine mutée. Enfin, la topographie d’expression de la protéine est souvent différente chez l’animal et chez l’homme, et dépend du promoteur du transgène. |
Modèles transgéniques de maladies caractérisées par une accumulation de protéine Plusieurs affections dégénératives sont caractérisées par l’accumulation, intra- ou extracellulaire, d’une protéine anormalement agrégée. Nous en prendrons trois exemples. Souris transgéniques APP et APPxPS1 : étude de l’amyloïdogenèse observée dans la maladie d’Alzheimer Les lésions cérébrales de la maladie d’Alzheimer sont constituées par les plaques séniles et les dégénérescences neurofibrillaires. Les plaques séniles comprennent un cœur amyloïde, où s’accumule le peptide Aβ issu du clivage d’un précurseur, l’ amyloid protein precursor (APP). Les dégénérescences neurofibrillaires sont principalement constituées de protéine tau ( voir ci-dessous). Les mutations responsables des maladies d’Alzheimer héréditaires identifiées aujourd’hui affectent le gène de l’APP, ou celui de protéines intervenant dans son métabolisme : la préséniline 1 ou la préséniline 2. L’hypothèse de la « cascade amyloïde » suppose que les altérations de la protéine tau sont secondaires. Expérimentalement, des dépôts amyloïdes sont produits dans le parenchyme cérébral et la paroi des vaisseaux par un transgène APP humain portant une ou plusieurs mutations. L’association du gène muté de la préséniline accélère l’apparition et la sévérité des dépôts [
15]. Des souris APP croisées avec des animaux porteurs d’un gène PS1 muté introduit par recombinaison homologue (PS1 KI), produisent des quantités encore plus élevées de peptide Aβ, associées à une perte neuronale sélective dans la corne d’Ammon [
16]. Chez la souris APPxPS1, des dépôts extracellulaires et des accumulations intracellulaires de peptide Aβ sous forme de granules sont observés dès l’âge de 3 mois [
17] (Figure 1). La formation des dépôts amyloïdes a pu être suivie in vivo en utilisant un microscope multiphotonique à travers une fenêtre ménagée dans la boîte crânienne [
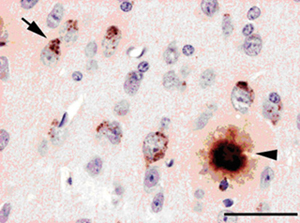
18]. Il est encore trop tôt pour déterminer si les granules intracellulaires contenant le peptide Aβ témoignent d’un mécanisme pathogénique applicable à l’homme, ou doivent être considérés comme la conséquence de la surexpression massive et artificielle de l’APP. 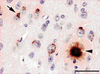 | Figure 1.
Présence de peptide Ab chez des souris transgéniques APPxPS1. Dépôt de peptide Aβ dans le milieu extracellulaire (tête de flèche) et présence de granules Aβ positifs dans les neurones entourant la plaque (flèche). Barre d’échelle : 80 µm (d’après [ 17]). |
La pathologie tau n’a jamais pu être reproduite de façon satisfaisante chez les animaux APP ou APPxPS1. Le lien entre l’accumulation extracellulaire du peptide Aβ et celle, intracellulaire, de protéine tau reste donc mal compris, et a suscité la production de souris exprimant à la fois un transgène tau et APP. Dans ces lignées ont été observées des plaques séniles comportant, comme chez l’homme, un centre amyloïde et des prolongements positifs pour tau. L’injection intracérébrale de peptide Aβ chez la souris tau a favorisé l’apparition de dégénérescences neurofibrillaires dans le corps cellulaire de neurones dont les axones projetaient sur le site d’injection [
19]. Les souris APP sont utilisées aujourd’hui pour tester l’activité de nouveaux traitements visant à réduire les dépôts de peptide Aβ, tels que la vaccination par l’injection de peptide Aβ exogène. En revanche, elles ne permettent pas de déterminer l’impact des nouvelles thérapeutiques sur la pathologie tau, mal reproduite dans les modèles transgéniques simples ou artificiellement recréée dans les lignées doublement transgéniques comportant également une mutation de la protéine tau. Démences frontotemporales et mutations de la protéine tau Les mutations du gène MAPT ( microtubule-associated protein tau), codant pour la protéine tau, sont associées à une démence frontotemporale avec syndrome parkinsonien. Ces « taupathies » héréditaires sont caractérisées par des accumulations intracellulaires polymorphes de protéine tau dans les neurones (dégénérescences neurofibrillaires) et la glie [
20]. Les protéines tau se lient aux microtubules qu’elles stabilisent et dont elles favorisent la polymérisation. Le domaine de liaison comprend, selon l’épissage, 3 ou 4 segments répétitifs. La phosphorylation de tau empêche son interaction avec les microtubules. Une vingtaine de lignées de souris ont été produites avec un transgène tau comportant 3 ou 4 segments répétitifs et des mutations variées. Les promoteurs utilisés ont souvent induit une surexpression de protéine tau particulièrement marquée dans le motoneurone, ce qui explique que le phénotype clinique soit moteur, sans doute en rapport avec une altération du transport axoplasmique [
21,
22]. La protéine tau s’accumule sous forme hyperphosphorylée principalement dans le compartiment somatodendritique du neurone [
23]. La topographie subcellulaire normale, axonale, de tau est conditionnée par l’adressage de son ARNm à la base de l’axone, du fait d’une séquence localisée dans sa partie non codante [
24]. La présence de dégénérescences neurofibrillaires a été rapportée dans une lignée transgénique obtenue par recombinaison homologue de la protéine humaine tau normale [
25]. Un transgène tau conditionnel a permis de montrer que la suppression de l’expression du transgène n’entrave pas la progression des dégénérescences neurofibrillaires, ce qui suggère que la pathologie tau pourrait, une fois installée, s’entretenir spontanément [
26]. La complexité du gène MAPT, de son épissage et de son adressage subcellulaire explique les difficultés rencontrées pour produire des dégénérescences neurofibrillaires ou des inclusions gliales semblables à celles observées chez l’homme. Accumulation d’α-synucléine dans les maladies à corps de Lewy Les maladies à corps de Lewy, dont les expressions cliniques sont variées, comprennent un syndrome moteur (au premier plan dans la maladie de Parkinson) et un déficit cognitif (au premier plan dans la démence à corps de Lewy). Les corps de Lewy sont des inclusions éosinophiles sphériques siégeant dans le corps cellulaire du neurone, et dont l’aspect est fibrillaire en microscopie électronique. Diverses mutations faux-sens ont été identifiées dans le gène codant l’α-synucléine, une protéine synaptique, chez des patients atteints de la forme familiale de la maladie de Parkinson [
27,
28]. Elles ont conduit à la découverte d’α-synucléine dans les corps de Lewy, ces derniers contenant également de l’ubiquitine, qui se fixe sur des protéines destinées à être détruites par le protéasome. Chez les souris transgéniques pour la forme mutée de l’α-synucléine [
29,
30] (Figure 2), la protéine surexprimée remplit le compartiment somatodendritique ou axonal de la cellule. Des agrégations d’α-synucléine ont également été mises en évidence [ 30]. Seules certaines lignées développent un phénotype caractérisé par une paralysie des extrémités [
31] ou des anomalies sensorimotrices [
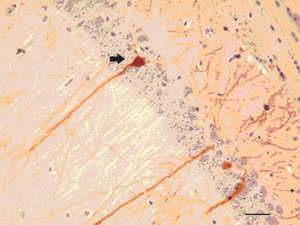
32], différentes de celles de la maladie de Parkinson humaine et en relation avec la topographie corticale et sous-corticale de l’expression du transgène.  | Figure 2.
Expression de l’α-synucléine humaine mutée chez la souris transgénique. Hippocampe d’une souris transgénique exprimant l’α-synucléine humaine mutée (hSynA53T). Expression ectopique de l’α-synucléine dans le corps cellulaire et le fût dendritique (flèche). Barre d’échelle : 20 µm. |
Le croisement de ces souris transgéniques α-synucléine avec des souris APP potentialise l’accumulation de l’α-synucléine, qui peut alors prendre un aspect fibrillaire [
33]. Cette interaction entre pathologies Alzheimer et Parkinson, observée chez l’homme [
34], reste mal comprise. |
Modèles transgéniques des maladies à répétitions de triplet La mutation responsable de la chorée de Huntington [
35] est généralement constituée par l’augmentation du nombre de triplets CAG contigus dans le gène de la Huntingtine. Le triplet code l’acide aminé glutamine. La Huntingtine anormale comporte donc un segment polyglutaminique anormalement long [
36]. C’est dans le modèle transgénique produit lors de la découverte de la mutation que furent initialement mises en évidence des inclusions nucléaires ubiquitinylées [
37]. Elles furent secondairement identifiées chez l’homme [
38]. Le modèle transgénique a donc permis de découvrir une lésion jusqu’alors passée inaperçue, nouveau paradigme dans lequel le modèle animal amène à découvrir des lésions humaines. L’enrichissement de l’environnement retarde les signes moteurs et l’atrophie cérébrale associée dans ce modèle [
39]. Les mutations dues à un allongement d’un segment répétitif CAG sont nombreuses chez l’homme : la plupart ont pour phénotype une ataxie (pour revue, voir [
40]). Ces SCA (spinocerebellar ataxia) autosomiques dominantes s’accompagnent presque invariablement d’inclusions nucléaires lorsqu’elles sont en rapport avec l’allongement d’un segment répétitif CAG. Plusieurs souris transgéniques SCA ont été produites, notamment la souris SCA7 chez laquelle l’ataxie est associée, comme chez l’homme, à une rétinite pigmentaire et à des inclusions nucléaires [
41]. Le rôle physiopathologique des inclusions nucléaires CAG, étudié en détail chez les souris transgéniques et en culture cellulaire, reste discuté : protecteur, par séquestration d’une protéine toxique [
42], ou délétère, en piégeant dans le noyau des facteurs de transcription (pour revue, voir [
43]). |
Modèles transgéniques de neurodégénérescence autosomique récessive La maladie de Parkinson due à une mutation ponctuelle du gène de la parkine (une ubiquitine ligase) et l’ataxie de Friedreich, généralement liée à une expansion GAA dans la frataxine, constituent deux illustrations de transmission récessive d’affections neurodégénératives. Les souris invalidées pour le gène de la parkine n’ont pas de phénotype clinique, mais des perturbations de l’expression de protéines impliquées dans le métabolisme énergétique, le fonctionnement synaptique et la voie de dégradation ubiquitine-protéasome [
44]. Plusieurs souris invalidées pour le gène de la frataxine ont été produites par une technique de ciblage génique conditionnel. Elles développent les principales lésions observées au cours de la maladie humaine : atteinte du cervelet et du ganglion spinal [
45], cardiomyopathie [
46] et diabète [
47]. Elles ont permis de tester de nouvelles molécules thérapeutiques. |
Modèles transgéniques pour l’étude des maladies à prions : les souris prions « humanisées » Les maladies à prions (maladie de Creutzfeldt-Jakob, par exemple) sont héréditaires, sporadiques ou acquises. Dans ce dernier cas, elles ont été transmises principalement ou exclusivement par le tissu nerveux issu d’individus souffrant d’une maladie à prions, quelle que soit son origine (héréditaire, sporadique ou acquise). Selon l’hypothèse de Prusiner (pour revue, voir [
48]), c’est une protéine prion mal conformée (riche en feuillets-β plissés) qui est l’agent transmissible. À son contact, la protéine prion normale de l’hôte [
49] adopte à son tour une conformation anormale. Cette donnée explique que les souris invalidées pour le gène de la protéine prion ne développent pas la maladie après contamination [
50]. Il est difficile de transmettre une maladie à prions d’une espèce à l’autre, la transmission étant limitée par le phénomène de barrière d’espèce. Les souris, par exemple, ne sont que peu sensibles au matériel infectant issu de l’homme. En revanche, la transgenèse de la protéine prion humaine chez la souris (souris « humanisée ») lui confère une sensibilité accrue aux diverses souches de prion humaines [
51]. |
Autres modèles transgéniques La transgenèse peut s’appliquer à d’autres rongeurs comme le rat, dont le comportement a été mieux étudié que celui de la souris. De nombreux outils de génétique moléculaire permettent des criblages à haut débit chez des organismes plus simples que la souris, se reproduisant rapidement et à faible coût. En outre, dans ces espèces, de nombreux mutants sont librement disponibles. C’est ainsi que la drosophile a été utilisée pour étudier l’effet de l’expression de la synucléine, qui provoque l’apparition de corps d’inclusion dans les neurones de l’œil et l’apparition de phénotypes cliniques moteurs [
52]. De son côté, le nématode Caenorhabditis elegans est facile à entretenir et à conserver congelé, et le lignage des cellules qui le composent est entièrement connu. Il a été utilisé pour rechercher les partenaires de la Huntingtine [
53] et pour cribler des molécules à intérêt thérapeutique potentiel [
54] dans la chorée de Huntington. Enfin, le poisson-zèbre, où la transgenèse est facile à réaliser, pourrait constituer un modèle intéressant : il a encore été peu utilisé dans l’étude de la neurodégénérescence. |
En quelques années, les progrès réalisés par la génétique moléculaire ont révolutionné les connaissances sur les maladies neurodégénératives : le neurologue cherchait naguère dans le symptôme (la démence, l’aphasie, le syndrome cérébelleux) l’indice qui lui permettrait un jour de mieux comprendre le mécanisme de ces affections. Force est de constater qu’aucune des découvertes récentes n’est issue de l’étude des symptômes (ou, ce qui revient au même, de la topographie des lésions). Le rôle de la Huntingtine, du peptide Aβ, de l’α-synucléine ou de la protéine tau a été soupçonné par l’analyse génétique des familles et l’isolement des protéines accumulées ; aucune d’entre elles n’a été identifiée en criblant les protéines exprimées spécifiquement dans les structures les plus affectées, celles dont la lésion causait la chorée, la démence ou le syndrome parkinsonien. Par ailleurs, dans les lignées animales présentant spontanément un symptôme ressemblant à celui observé dans une maladie humaine, les mutations n’étaient pas celles identifiées chez l’homme. Dans la majorité des cas, les lésions sont constituées par l’accumulation de protéines tantôt normales, tantôt mutées ou ayant fait l’objet de modifications post-traductionnelles : peptide Aβ, α-synucléine ou protéines comportant un segment allongé de polyglutamine, pour ne citer que les quelques exemples illustrés dans cette revue. L’accumulation protéique est-elle donc toujours rencontrée dans les maladies neurodégénératives ? La réponse est évidemment négative : un groupe important de démences, notamment, ne présente aucun « signe histologique distinctif ». L’anomalie en cause est, dans pareilles circonstances, beaucoup plus difficile à isoler, et donc à reproduire. Il est d’ailleurs possible que les signes histologiques distinctifs conduisent à un biais : les inclusions protéiques permettant d’identifier facilement les affections qui en sont pourvues pourraient ainsi entraîner une surestimation de leur fréquence. La génétique s’est révélée être la seule stratégie véritablement efficace ces dernières années pour élucider le mécanisme des maladies neurodégénératives : la recherche de toxines, de matériel infectieux (en dehors de la maladie de Creutzfeldt-Jakob) ou d’anomalies métaboliques n’a jamais débouché sur une découverte permettant la constitution d’un modèle véritablement étiologique. Est-ce à dire que toute maladie neurodégénérative est génétique, les formes sporadiques relevant d’une transmission polygénique si complexe qu’elle ne se trouve réalisée que chez un seul individu de la famille concernée ? Il y a quelques années, la question aurait paru saugrenue ; elle ne l’est plus aujourd’hui, à l’heure où il a été démontré que des affections en apparence sporadiques, comme la maladie de Parkinson, la paralysie supranucléaire progressive ou encore la dégénérescence corticobasale ont une forte composante génétique. Les modèles animaux de ces affections sporadiques, intégrant plusieurs facteurs génétiques, se révéleront, sans aucun doute, beaucoup plus difficiles à construire. Suffit-il d’introduire un gène pathologique chez l’animal pour reproduire la maladie humaine ? Bien évidemment, non. La protéine peut s’accumuler dans les lysosomes, causer une perturbation qui tient à sa topographie subcellulaire ou s’exprimer sous le contrôle d’un promoteur qui inhibe ou modifie sa toxicité. Mais comment apprécier la similitude du modèle si l’on ignore l’original ? Produire de nouveaux modèles animaux, c’est aussi mieux observer les maladies humaines, en poursuivant la recherche neuropathologique. |
Footnotes |
1. De la Torre JC, Fortin T. A chronic physiological rat model of dementia. Behav Brain Res 1994; 63 : 35–40. 2. Spencer PS, Nunn PB, Hugon J, et al. Guam amyotrophic lateral sclerosis-parkinsonism-dementia linked to a plant excitant neurotoxin. Science 1987; 237 : 517–22. 3. Caparros-Lefebvre D, Sergeant N, Lees A, et al. Guadeloupean parkinsonism: a cluster of progressive supranuclear palsy-like tauopathy. Brain 2002; 125 : 801–11. 4. Langston JW, Ballard P, Tetrud J, Irwin I. Chronic parkinsonism in humans due to a product of meperidine-analog synthesis. Science 1983; 219 : 979–80. 5. D’Arcangelo G, G. Miao G, Chen SC, et al. A protein related to extracellular matrix proteins deleted in the mouse mutant reeler. Nature 1995; 374 : 719–23. 6. Hong SE, Shugart YY, Huang DT, et al. Autosomal recessive lissencephaly with cerebellar hypoplasia is associated with human RELN mutations. Nat Genet 2000; 26 : 93–6. 7. Impagnatiello F, Guidotti AR, Pesold C, et al. A decrease of reelin expression as a putative vulnerability factor in schizophrenia. Proc Natl Acad Sci USA 1998; 95 : 15718–23. 8. Lane PW. New mutation: weaver, wv. Mouse News Lett 1964; 30 : 32–3. 9. Schmidt MJ, Sawyer BD, Perry KW, et al. Dopamine deficiency in the weaver mutant mouse. J Neurosci 1982; 2 : 376–80. 10. Rezai Z, Yoon CH. Abnormal rate of granule cell migration in the cerebellum of weaver mutant mice. Dev Biol 1972; 29 : 17–26. 11. Rakic P, Sidman RL. Organization of cerebellar cortex secondary to deficit of granule cells in weaver mutant mice. J Comp Neurol 1973; 152 : 133–61. 12. Patil N, Cox DR, Bhat D, et al. A potassium channel mutation in weaver mice implicates membrane excitability in granule cell differentiation. Nat Genet 1995; 11 : 126–9. 13. Bandmann O, Davis MB, Mrasden CD, Wood NW. The human homologue of the weaver mouse gene in familial and sporadic Parkinson’s disease. Neuroscience 1996; 72 : 877–9. 14. Gold DA, Baek SH, Schork NJ, et al. RORα coordinates reciprocal signaling in cerebellar development through sonic hedgehog and calcium-dependent pathways. Neuron 2003; 40 : 1119–31. 15. Blanchard V, Moussaoui S, Czech C, et al. Time sequence of maturation of dystrophic neurites associated with Ab deposits in APP/PS1 transgenic mice. Exp Neurol 2003; 184 : 247–63. 16. Schmitz C, Rutten BP, Pielen A, et al. Hippocampal neuron loss exceeds amyloid plaque load in a transgenic mouse model of Alzheimer’s disease. Am J Pathol 2004; 164 : 1495–502. 17. Langui D, Girardot N, El Hachimi H, et al. Subcellular topography of neuronal Ab peptide in APPxPS1 transgenic mice. Am J Pathol 2004; 165 : 1465–77. 18. Robbins EM, Betensky RA, Domnitz SB, et al. Kinetics of cerebral amyloid angiopathy progression in a transgenic mouse model of Alzheimer disease. J Neurosci 2006; 26 : 365–71. 19. Götz J, Chen F, van Dorpe J, Nitsch RM. Formation of neurofibrillary tangles in P301L tau transgenic mice induced by Aβ42 fibrils. Science 2001; 293 : 1491–5. 20. Ghetti B, Hutton ML, Wszolek ZK. Fronto-temporal dementia and parkinsonism linked to chromosome 17 associated with Tau gene mutations (FTDP-17T). In : Dickson D, ed. Neurodegeneration: the molecular pathology of dementia and movement disorders. Basel : ISN Neuropath Press, 2003 : 86–102. 21. Probst A, Gotz J, Wiederhold KH, et al. Axonopathy and amyotrophy in mice transgenic for human four-repeat tau protein. Acta Neuropathol (Berl) 2000; 99 : 469–81. 22. Spittaels K, Van den Haute C, Van Dorpe J, et al. Prominent axonopathy in the brain and spinal cord of transgenic mice overexpressing four-repeat human tau protein. Am J Pathol 1999; 155 : 2153–65. 23. Brion JP, Tremp G, Octave JN. Transgenic expression of the shortest human tau affects its compartmentalization and its phosphorylation as in the pretangle stage of Alzheimer’s disease. Am J Pathol 1999; 154 : 255–70. 24. Behar L, Marx R, Sadot E, et al. Cis-acting signals and trans-acting proteins are involved in tau mRNA targeting into neurites of differentiating neuronal cells. Int J Dev Neurosci 1995; 13 : 113–27. 25. Andorfer C, Acker CM, Kress Y, et al. Cell-cycle reentry and cell death in transgenic mice expressing nonmutant human tau isoforms. J Neurosci 2005; 25 : 5446–54. 26. SantaCruz K, Lewis J, Spires T, et al. Tau suppression in a neurodegenerative mouse model improves memory function. Science 2005; 309 : 476–81. 27. Polymeropoulos MH, Lavedan C, Leroy E, et al. Mutation in the α-synuclein gene identified in families with Parkinson’s disease. Science 1997; 276 : 2045–7. 28. Kruger R, Kuhn W, Muller T, et al. Ala30Pro mutation in the gene encoding α-synuclein in Parkinson’s disease. Nat Genet 1998; 18 : 106–8. 29. Kahle PJ, Neumann M, Ozmen L, et al. Subcellular localization of wild-type and Parkinson’s disease-associated mutant α-synuclein in human and transgenic mouse brain. J Neurosci 2000; 20 : 6365–73. 30. Masliah E, Rockenstein E, Veinbergs I, et al. Dopaminergic loss and inclusion body formation in α-synuclein mice: implications for neurodegenerative disorders. Science 2000; 287 : 1265–9. 31. Giasson BI, Duda JE, Quinn SM, et al. Neuronal α-synucleinopathy with severe movement disorder in mice expressing A53T human α-synuclein. Neuron 2002; 34 : 521–33. 32. Fleming SM, Salcedo J, Fernagut PO, et al. Early and progressive sensorimotor anomalies in mice overexpressing wild-type human α-synuclein. J Neurosci 2004; 24 : 9434–40. 33. Masliah E, Rockenstein E, Veinbergs I, et al. β-amyloid peptides enhance α-synuclein accumulation and neuronal deficits in a transgenic mouse model linking Alzheimer’s disease and Parkinson’s disease. Proc Natl Acad Sci USA 2001; 98 : 12245–50. 34. Schmidt ML, Martin JA, Lee VM, Trojanowski JQ. Convergence of Lewy bodies and neurofibrillary tangles in amygdala neurons of Alzheimer’s disease and Lewy body disorders. Acta Neuropathol 1996; 91 : 475–81. 35. Gusella JF, Wexler NS, Conneally PM, et al. A polymorphic DNA marker genetically linked to Huntington’s disease. Nature 1983; 306 : 234–8. 36. The Huntington’s disease collaborative research group. A novel gene containing a trinucleotide repeat that is expanded and unstable on Huntington’s disease chromosomes. Cell 1993; 72 : 971–83. 37. Davies SW, Turmaine M, Cozens BA, et al. Formation of neuronal intranuclear inclusions underlies the neurological dysfunction in mice transgenic for the HD mutation. Cell 1997; 90 : 537–48. 38. DiFiglia M, Sapp E, Chase KO, et al. Aggregation of Huntingtin in neuronal intranuclear inclusions and dystrophic neurites in brain. Science 1997; 277 : 1990–3. 39. Van Dellen A, Blakemore C, Deacon R, et al. Delaying the onset of Huntington’s in mice. Nature 2000; 404 : 721–2. 40. Koeppen AH. The hereditary ataxias. J Neuropathol Exp Neurol 1998; 57 : 531–43. 41. Yvert G, Lindenberg K, Picaud S, et al. Expanded polyglutamines induce neurodegeneration and trans-neuronal alterations in cerebellum and retina of SCA7 transgenic mice. Hum Mol Genet 2000; 9 : 2491–506. 42. Saudou F, Finkbeiner S, Devys D, Greenberg ME. Huntingtin acts in the nucleus to induce apoptosis but death does not correlate with the formation of intranuclear inclusions. Cell 1998; 95 : 55–66. 43. Everett C, Wood N. Trinucleotide repeats and neurodegenerative disease. Brain 2004; 127 : 2385–405. 44. Periquet M, Corti O, Jacquier S, Brice A. Proteomic analysis of parkin knockout mice: alterations in energy metabolism, protein handling and synaptic function. J Neurochem 2005; 95 : 1259–76. 45. Simon D, Seznec H, Gansmuller A, et al. Friedreich ataxia mouse models with progressive cerebellar and sensory ataxia reveal autophagic neurodegeneration in dorsal root ganglia. J Neurosci 2004; 24 : 1987–95. 46. Puccio H, Simon D, Cossee M, et al. Mouse models for Friedreich ataxia exhibit cardiomyopathy, sensory nerve defect and Fe-S enzyme deficiency followed by intramitochondrial iron deposits. Nat Genet 2001; 27 : 181–6. 47. Ristow M, Mulder H, Pomplun D, et al. Frataxin deficiency in pancreatic islets causes diabetes due to loss of β cell mass. J Clin Invest 2003; 112 : 527–34. 48. Prusiner SB. Molecular biology and pathogenesis of prion diseases. Trends Biochem Sci 1996; 21 : 482–7. 49. Basler K, Oesch B, Scott M, et al. Scrapie and cellular PrP isoforms are encoded by the same chromosomal gene. Cell 1986; 46 : 417–28. 50. Bueler H, Aguzzi A, Sailer A, et al. Mice devoid of PrP are resistant to scrapie. Cell 1993; 73 : 1339–47. 51. Telling GC, Scott M, Hsiao KK, et al. Transmission of Creutzfeldt-Jakob disease from humans to transgenic mice expressing chimeric human-mouse prion protein. Proc Natl Acad Sci USA 1994; 91 : 9936–40. 52. Feany MB, Bender WW. A drosophila model of Parkinson’s disease. Nature 2000; 404 : 394–8. 53. Holbert S, Denghien I, Kiechle T, et al. The Gln-Ala repeat transcriptional activator CA150 interacts with Huntingtin: neuropathologic and genetic evidence for a role in Huntington’s disease pathogenesis. Proc Natl Acad Sci USA 2001; 98 : 1811–6. 54. Parker JA, Arango M, Abderrahmane S, et al. Resveratrol rescues mutant polyglutamine cytotoxicity in nematode and mammalian neurons. Nat Genet 2005; 37 : 349–50. |
 Les maladies neurodégénératives provoquent des lésions bilatérales et habituellement symétriques, affectant avec une grande sélectivité des groupes cellulaires circonscrits. Pour la plupart des phénotypes, sinon tous, on connaît des formes sporadiques (maladie de Parkinson idiopathique commune, par exemple) et génétiques (maladie de Parkinson par mutation de l’α-synucléine, par exemple). Les maladies d’Alzheimer, de Parkinson, de Huntington ou de Friedreich, ainsi que les ataxies spinocérébelleuses, sont des exemples de maladies neurodégénératives que nous aurons l’occasion de considérer dans cet article.
Les maladies neurodégénératives provoquent des lésions bilatérales et habituellement symétriques, affectant avec une grande sélectivité des groupes cellulaires circonscrits. Pour la plupart des phénotypes, sinon tous, on connaît des formes sporadiques (maladie de Parkinson idiopathique commune, par exemple) et génétiques (maladie de Parkinson par mutation de l’α-synucléine, par exemple). Les maladies d’Alzheimer, de Parkinson, de Huntington ou de Friedreich, ainsi que les ataxies spinocérébelleuses, sont des exemples de maladies neurodégénératives que nous aurons l’occasion de considérer dans cet article.