| |
| Med Sci (Paris). 2007 March; 23(3): 238–240. Published online 2007 March 15. doi: 10.1051/medsci/2007233238.
Shigella flexneri sculpte la réponse transcriptionnelle en modulant l’information épigénétique de la cellule hôte Laurence Arbibe* and Philippe Sansonetti* Unité de Pathogénie microbienne moléculaire,Inserm U786,Institut Pasteur,28, rue du Docteur Roux,75724 Paris Cedex 15, France MeSH keywords: Protéines bactériennes, Activation enzymatique, Épigenèse génétique, Extracellular Signal-Regulated MAP Kinases, Régulation de l'expression des gènes, Histone, Humains, Immunité innée, Système de signalisation des MAP kinases, Facteur de transcription NF-kappa B, Phosphosérine, Protein Tyrosine Phosphatases, Shigella flexneri, Transcription génétique, Virulence |
L’injection de protéines de virulence dans la cellule hôte constitue une stratégie classiquement utilisée par les pathogènes bactériens pour interférer avec des voies de transduction pro-inflammatoires et moduler la réponse immunitaire. Cependant, les mécanismes moléculaires permettant à ces effecteurs de contrôler sélectivement l’expression transcriptionnelle de gènes clés de la réponse immunitaire restaient non identifiés. Nous avons donc cherché à élucider un de ces mécanismes lors de l’infection cellulaire par le pathogène bactérien Shigella flexneri [
1]. Malgré une capacité évidente de ce pathogène à activer des voies de signalisation pro-inflammatoires, l’analyse en transcriptome montrait que le profil de gènes activés par ce pathogène restait limité, suggérant que Shigella avait développé une stratégie pour « sculpter » la réponse transcriptionnelle [
2]. Nous avons dans un premier temps observé que Shigella induisait une accumulation nucléaire de la MAP-kinase (mitogen-activated protein kinase) Erk sous sa forme inactive déphosphorylée sur les deux résidus thréonine et tyrosine localisés dans son domaine kinase. Ce résultat suggérait la mise en jeu d’une phosphatase nucléaire que nous avons identifiée comme étant l’effecteur bactérien OspF. L’analyse en transcriptome réalisée sur une lignée de cellules épithéliales coliques montrait que OspF réprimait un nombre très limité de gènes (46 gènes), principalement des gènes codant des protéines de réponse rapide et certaines chimiokines comme CCL20 (MIP-3α) et l’interleukine-8, dont la réponse promotrice est essentiellement sous la dépendance du facteur de transcription NF-κB. Curieusement, nos résultats indiquaient que OspF n’altérait pas l’activation de NF-κB induite par le stress bactérien. Comment cet effecteur pouvait-il donc sélectivement réprimer l’expression d’un nombre limité de gènes dont certains sont principalement sous le contrôle de la voie de signalisation NF-κB ? |
Activité transcriptionnelle et structure de la chromatine L’activité transcriptionnelle d’un gène est étroitement liée à la structure de la chromatine. Les extrémités amino-terminales des histones font saillie à l’extérieur du nucléosome et sont la cible de modifications post-traductionnelles telles que l’acétylation, la phosphorylation ou la méthylation localisées sur des résidus spécifiques pour chaque histone. Il a été suggéré que l’ensemble de ces modifications constitue un code, appelé « code des histones » dont la fonction serait de moduler la liaison de protéines avec le nucléosome [
3]. En particulier, certaines combinaisons de modifications créent des sites de reconnaissance pour des protéines impliquées dans le remodelage chromatinien, et régulent ainsi l’accessibilité des facteurs de transcription au site promoteur. Ainsi, la stimulation des voies de signalisation MAP-kinases Erk ou p38 conduit à la phosphorylation sur le résidu sérine 10 d’une fraction d’histones H3 associée à des promoteurs dont ceux des gènes de réponse rapide et d’un groupe spécifique de chimiokines incluant l’interleukine 8 [
4,
5]. Pour ces gènes, la phosphorylation sur la sérine 10, associée à l’acétylation de l’histone H3 sur la lysine 14, permettrait le recrutement de complexes protéiques favorisant la décompaction de la chromatine et donc l’accessibilité du facteur de transcription NF-κB au site promoteur [5]. Cette étude suggère que certaines chimiokines ont probablement un site promoteur « caché », en raison d’une configuration chromatinienne non permissive, la phosphorylation des histones H3 (sérine 10) induite par l’activité MAP-kinase permettant de passer d’un état de chromatine réprimée pour la transcription à une chromatine permissive capable de recruter NF-κB. |
Activité phosphatase de OspF et modifications épigénétiques Nous avons donc formulé l’hypothèse selon laquelle l’activité phosphatase de OspF dirigée contre les MAPK conduisait à un arrêt de la phosphorylation de l’histone H3, perturbant ainsi l’accessibilité de NF-κB sur son site promoteur. Nos résultats montrent en effet que lors d’un stimulus bactérien, OspF se localise dans le noyau et, en inactivant les MAP-kinases Erk et p38, bloque la phosphorylation de l’histone H3 sur le résidu sérine 10. Des expériences d’immunoprécipitation de chromatine ont montré que l’injection d’OspF permet de bloquer la phosphorylation de l’histone H3 précisément au niveau du promoteur de l’interleukine-8, cet effet n’étant pas observable avec les promoteurs de gènes codant par exemple IκB-α, CD44 ou la protéine ribosomale RLP0 dont les niveaux de phosphorylation restent identiques après infection par les souches de Shigella sauvages ou mutées pour OspF. Ce résultat démontre que les modifications épigénétiques induites par OspF sont spécifiques de certains gènes. Cette spécificité pourrait être en rapport avec la capacité de OspF d’inactiver les MAP-kinases. En effet, diverses études suggèrent que les MAP-kinases sont directement recrutées sur les sites promoteurs des gènes qu’elles régulent [
6–
8]. Ainsi, des travaux essentiellement réalisés chez la levure montrent qu’en réponse au stress osmotique, la kinase Hog1 (homologue de p38 MAP-kinase) est recrutée de façon stable sur ses promoteurs cibles par l’intermédiaire du facteur de transcription Hot1 et que le nombre de gènes occupés par la kinase est faible (39 gènes) comparé aux 600 gènes dont la régulation est sous le contrôle de l’activité Hog1 kinase [6–8]. Cela suggère que le recrutement chromatinien des MAP-kinases sur les sites promoteurs est spécifique de certains gènes, les mécanismes moléculaires conférant cette spécificité restant non élucidés. Nous suggérons donc un modèle dans lequel la localisation nucléaire de l’effecteur OspF pourrait fortement contribuer à l’inactivation des MAP-kinases au niveau chromatinien sur certains sites promoteurs. Ce mécanisme permettrait d’inhiber la phosphorylation de l’histone H3 en sérine 10 sur le gène d’intérêt, et de réduire l’accessibilité de NF-κB sur le site promoteur (Figure 1). Nos résultats indiquent en effet que OspF réprime les recrutements de la sous-unité p65 de NF-κB et de l’ARN polymérase II sur le promoteur de l’interleukine-8. Ainsi, OspF inhibe l’expression de ce gène en perturbant l’accessibilité au site promoteur d’éléments majeurs du complexe transcriptionnel. La production d’interleukine-8 joue un rôle central dans la physiopathologie de la shigellose car elle contrôle l’afflux muqueux des polynucléaires neutrophiles (PN) et leur migration trans-épithéliale, conduisant à la rupture de l’intégrité de la barrière épithéliale nécessaire à l’invasion bactérienne [
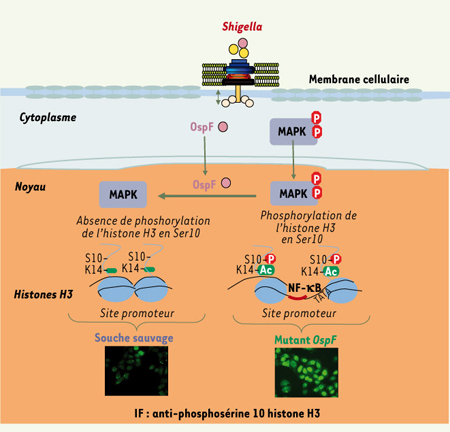
9]. Nous avons donc analysé l’impact in vivo de OspF dans un modèle d’anse intestinale ligaturée de lapin. OspF réprime l’afflux de PN dans la muqueuse et la lumière intestinales. Ce résultat est donc en accord avec les données transcriptionnelles obtenues in vitro et suggère une stratégie habile de survie bactérienne à la surface des muqueuses.  | Figure 1.
Modèle de modulation de l’information épigénétique de la cellule hôte par l’effecteur bactérien OspF. La souche déficiente pour OspF induit la phophorylation de l’histone H3 sur le résidu sérine 10 via l’activation des MAP-kinases p38 et Erk. Cette phosphorylation survient sur des histones H3 acétylées au niveau de la lysine 14 conduisant à un « code histone » favorisant la décompaction chromatinienne et l’ouverture du site promoteur au facteur de transcription NF-κB. La souche sauvage injecte OspF via son appareil de sécrétion de type III. OspF déphosphoryle et inactive les MAP-kinases dans le noyau, altérant ainsi la formation d’histone H3 phosphorylées en sérine 10 au niveau du site promoteur du gène d’intérêt. Ces modifications épigénétiques « verrouillent » l’accès du site promoteur au facteur de transcription NF-κB. |
Perspectives Cette étude montre que le pathogène Shigella flexneri « reprogramme » la réponse transcriptionnelle de la cellule épithéliale de façon précise en modulant l’information épigénétique sur des gènes clés de la réponse immunitaire innée. Ce type de stratégie nous apporte des informations importantes sur les bases moléculaires de la régulation des gènes de l’immunité au niveau épigénétique et, de façon plus générale, sur les mécanismes d’action des phosphatases nucléaires dans la régulation de l’expression des gènes. OspF est une tyrosine phosphatase « atypique » car l’analyse de sa séquence primaire ne permet pas de prédire une activité phosphatase établie d’après les séquences des tyrosine phosphatases eucaryotes et procaryotes. L’élucidation du site catalytique nous permettra de savoir si cette phosphatase constitue une nouvelle classe de tyrosine phosphatases et de rechercher dans le génome humain des homologues potentiels. L’homologie de séquence primaire entre OspF et d’autres protéines de virulence bactériennes telles que les protéines SpvC de Salmonella ou VirA de Chromobacterium violaceum suggère que d’autres pathogènes pourraient développer une stratégie similaire conduisant à une modulation très fine de la réponse immunitaire innée à la surface des muqueuses. Cette réponse joue aussi un rôle essentiel dans le développement de la réponse immunitaire adaptative. OspF réprime en effet un pool spécifique de gènes dont certains jouent un rôle important dans l’élaboration d’une réponse immunitaire protectrice efficace de type Th1 (Gamelas et al., en préparation). L’impact de ce type d’effecteur bactérien dans le développement de la réponse immunitaire adaptative reste donc à élucider. |
1. Arbibe L, Kim DW, Batsche E, et al. An injected bacterial effector targets chromatin access for transcription factor NF-kappaB to alter transcription of host genes involved in immune responses. Nat Immunol 2007; 8 : 47–56. 2. Pedron T, Thibault C, Sansonetti PJ. The invasive phenotype of Shigella flexneri directs a distinct gene expression pattern in the human intestinal epithelial cell line Caco-2. J Biol Chem 2003; 278 : 33878–86. 3. Strahl BD, Allis CD. The language of covalent histone modifications. Nature 2000; 403 : 41–5. 4. Clayton AL, Rose S, Barratt MJ, Mahadevan LC. Phosphoacetylation of histone H3 on c-fos- and c-jun-associated nucleosomes upon gene activation. EMBO J 2000; 19 : 3714–26. 5. Saccani S, Pantano S, Natoli G. p38-Dependent marking of inflammatory genes for increased NF-kappa B recruitment. Nat Immunol 2002; 3 : 69–75. 6. Alepuz PM, Jovanovic A, Reiser V, Ammerer G. Stress-induced map kinase Hog1 is part of transcription activation complexes. Mol Cell 2001; 7 : 767–77. 7. Simone C, Forcales SV, Hill DA, et al. p38 pathway targets SWI-SNF chromatin-remodeling complex to muscle-specific loci. Nat Genet 2004; 36 : 738–43. 8. Pokholok DK, Zeitlinger J, Hannett NM, et al. Activated signal transduction kinases frequently occupy target genes. Science 2006; 313 : 533–6. 9. Sansonetti PJ, Arondel J, Huerre M, et al. Interleukin-8 controls bacterial transepithelial translocation at the cost of epithelial destruction in experimental shigellosis. Infect Immun 1999; 67 : 1471–80. |