| |
| Med Sci (Paris). 2007 March; 23(3): 250–252. Published online 2007 March 15. doi: 10.1051/medsci/2007233250.L’IL-23R, un nouveau gène de susceptibilité dans les maladies inflammatoires chroniques intestinales Laurent Peyrin-Biroulet, Erika Parmentier-Decrucq, Julien Branche, and Pierre Desreumaux* Inserm U795 (ex EA114), Centre de recherchesur les maladies inflammatoires chroniques intestinales, Hôpital Swynghedauw, rue A. Verhaeghe,59037 Lille Cedex, France MeSH keywords: Substitution d'acide aminé, Maladies chez les jumeaux, Prédisposition génétique à une maladie, Humains, Immunité innée, Maladies inflammatoires intestinales, Interleukine-17, Interleukine-6, Mutation faux-sens, Récepteurs aux interleukines, Lymphocytes T auxiliaires, Facteur de croissance transformant bêta |
La maladie de Crohn (MC) et la rectocolite hémorragique (RCH) sont des maladies inflammatoires chroniques de l’intestin (MICI) caractérisées par une anomalie de régulation de la réponse immunitaire muqueuse dirigée contre des éléments de la flore intestinale. Ces pathologies surviennent chez des patients génétiquement prédisposés. |
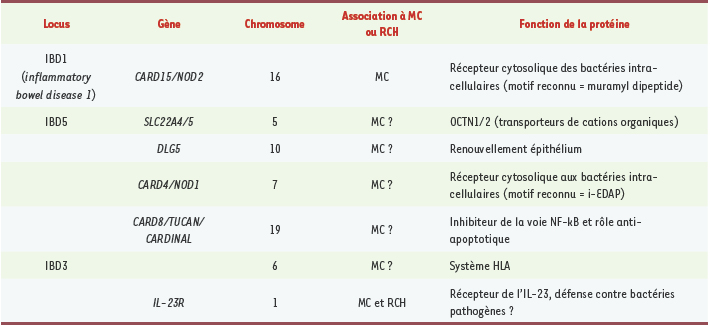
MICI et facteurs génétiques L’hypothèse génétique dans les MICI repose sur un faisceau d’arguments. Le premier est l’existence de formes familiales. La fréquence des formes familiales de MC varie de 8 % à 40% selon les études. Certaines familles exceptionnelles comportent un grand nombre de sujets atteints. Le risque relatif (RR) de MICI pour les apparentés peut être calculé en faisant le rapport entre la prévalence de la maladie estimée dans la population des parents de sujets atteints et la prévalence dans la population générale. Le RR d’être atteint de MC pour un parent au premier degré de sujet atteint de MC est de 10 et le RR de développer une RCH pour un parent de premier degré de sujet atteint de RCH est de 8. Le RR de développer une RCH lorsqu’un parent au premier degré est atteint de MC est lui aussi élevé (3,85) alors que le risque inverse n’est pas significativement différent de celui qui prévaut dans la population générale [
1]. Ainsi, une histoire familiale de MICI est le premier facteur de risque de développer une MICI. Le second argument est le fort taux de concordance chez les jumeaux homozygotes. L’étude de référence est une étude suédoise dans laquelle un croisement des registres de jumeaux et des registres de MICI a été réalisé, dans une population géographiquement définie [
2]. Quarante-quatre paires de jumeaux dont un au moins était atteint de MC et 36 paires dont un au moins était atteint de RCH ont été étudiées. Pour la MC, le taux de concordance chez les monozygotes (58,3 %) était significativement supérieur au taux observé chez les dizygotes (3,9 %) (chiffre équivalent au risque relatif observé chez les parents au premier degré). Les taux de concordance étaient dans les deux cas supérieurs dans la MC aux taux de concordance observés pour la RCH : dans cette maladie, il était de 6,3 % chez les monozygotes, ce qui n’est pas significativement supérieur au taux observé chez les dizygotes (0 %). Une seule paire mixte MC-RCH a été jusqu’à maintenant observée [2]. Ces résultats sont en faveur d’une composante génétique forte mais non exclusive (car la concordance devrait être dans ce cas de 100 %) intervenant dans la physiopathologie de la MC contrairement à la RCH. La concordance incomplète observée entre jumeaux monozygotes confirme que les MICI ne sont pas des maladies à transmission mendélienne simple, mais elle ne permet pas de définir un modèle de transmission. Plus récemment en 2001, l’identification par deux équipes indépendantes de NOD2/CARD15 (codant pour une protéine intracellulaire contenant un domaine N-terminal caspase recruitment, CARD) comme gène de susceptibilité à la MC avait permis de souligner le rôle prépondérant des facteurs génétiques dans la pathogénie de cette maladie [
3,
4]. D’autres gènes comme DLG5 (équivalent humain de discs, large homolog 5 (Drosophila) et SLC22A4/5) pourraient être associés à la MC [
5]. Aujourd’hui, une équipe américaine a mis en évidence un nouveau gène qui pourrait protéger contre le développement des MICI, situé sur le chromosome 1p31 et codant pour le récepteur de l’interleukine-23 (IL-23R) [
6]. Les principaux gènes de susceptibilité aux MICI sont repris dans le Tableau I.  | Tableau I.
Principaux gènes de susceptibilité aux MICI. MC : maladie de Crohn ; RCH : rectocolite hémorragique. |
|
IL-23R, un nouveau gène de susceptibilité dans les MICI Cho et al. ont tout d’abord analysé 547 malades atteints d’une MC iléale et 548 sujets contrôles d’origine européenne, non juifs. Les auteurs ont choisi de restreindre leur analyse aux atteintes iléales de la MC afin de limiter l’hétérogénéité clinique et génétique des patients. Cette étude a mis en évidence une association inverse entre un allèle rare de l’IL23R et le risque de MC à localisation iléale. Ainsi, le polymorphisme codant (rs11209026, c.1142G>A, p.Arg381Gln) pour un acide aminé situé dans la partie intra-cytoplasmique de l’IL23R est moins fréquemment exprimé chez les patients non juifs ayant une MC à localisation iléale que chez les sujets témoins (1,9 % vs 7,0% ; OR = 0,26 ; IC à 95% : 0,15-0,43) (p corrigé = 1,56 x 10−3). Il existait également une association entre le risque de MC iléale et un polymorphisme plus fréquent correspondant à 9 autres marqueurs non codants localisés soit au sein du gène de l’IL23R, soit entre le gène de l’IL-23R et celui de l’IL12RB2 (interleukin 12 receptor, beta-2 chain). Ces résultats ont été confirmés dans une cohorte indépendante de patients d’origine juive atteints de MC iléale, mais aussi dans 883 familles dans lesquelles les parents et leurs enfants étaient atteints de maladies inflammatoires chroniques de l’intestin (MC, RCH, ou colite d’origine indéterminée). Les résultats provenant de ces études familiales ont également montré une association entre IL23R et RCH, mais seulement chez les sujets non juifs. |
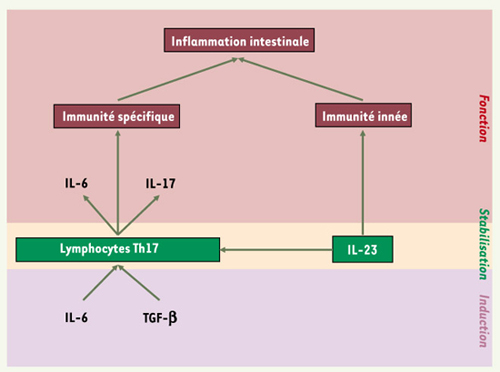
Quelle est la signification fonctionnelle du polymorphisme génétique de l’IL-23R ? À l’issue du travail de Cho et al. [6], une question vient tout naturellement à l’esprit : quelle est la fonction de ce récepteur ? En d’autres termes, quel rôle pourrait jouer cette protéine dans la pathogénie des MICI ? Personne ne peut répondre aujourd’hui clairement à cette question. Les fonctions multiples et redondantes des cytokines et de leurs récepteurs permettent toujours d’envisager une fonction rationnelle protectrice ou prédisposante de ces médiateurs dans la physiopathologie des MICI. Classiquement, les lésions chroniques de MC sont associées à une augmentation de la synthèse d’IL-12 et d’IL-23, cytokines produites notamment par les macrophages de la lamina propria et orientant la réponse immunitaire vers un profil de cytokines Th1, caractérisé par une forte production d’IFNγ (interféron γ). Plus récemment, une nouvelle famille de lymphocytes T appelée Th17, induits par l’IL-6 et le TGF-β (transforming growth factor β), stabilisés par l’IL-23, et caractérisés par leur capacité à produire de l’IL-6 et de l’IL-17 a été mise en évidence au sein du système immunitaire muqueux intestinal [
7,
8] (Figure 1). Ces lymphocytes Th17 et cette production d’IL-23 jouent un rôle important dans l’immunité muqueuse spécifique et innée, pouvant être à l’origine d’une susceptibilité aux infections bactériennes [
9–
11] et du déclenchement de mécanismes inflammatoires intestinaux, dépendants ou non de la présence de lymphocytes T ou B [7, 8].  | Figure 1.
Rôle de l’IL-23 dans la régulation de l’inflammation intestinale.
|
Ainsi, si l’on considère l’allèle rare du polymorphisme de l’IL-23R codant pour l’arginine en positon 381 (Arg381) dans la partie très conservée intracytoplasmique du récepteur, cette modification pourrait augmenter la fonction de l’IL-23 et conférer à la muqueuse iléale une meilleure résistance aux agressions bactériennes, protégeant contre la survenue de la MC. Le rôle de l’IL-23R au cours de la RCH, pathologie classiquement associée à un profil Th2, reste plus énigmatique. |
L’allèle rare du polymorphisme codant pour l’Arg381Gln de l’IL-23R est inversement associé au risque de MC iléale, familiale ou non, survenant chez des patients juifs ou non juifs, mais également dans les formes familiales de RCH survenant chez des patients non juifs. Cet allèle rare serait protecteur vis-à-vis de la MC, mais inversement, le polymorphisme de l’IL-23R pourrait prédisposer à la MC si l’on considère l’allèle fréquent. La considération de travaux dogmatiques associant des pathologies chroniques à des profils de cytokines régulatrices (Th1, Th2, Th3…) dont l’existence chez l’homme est remise en doute ne facilite pas l’interprétation de ces résultats sur un plan fonctionnel. |
1. Halme L, Paavola-Sakki P, Turunen U, et al. Family and twin studies in inflammatory bowel disease. World J Gastroenterol 2006; 12 : 3668–72. 2. Tysk C, Lindberg E, Jarnerot G, Floderus-Myrhed B. Ulcerative colitis and Crohn’s disease in an unselected population of monozygotic and dizygotic twins. A study of heritability and the influence of smoking. Gut 1988; 29 : 990–6. 3. Hugot JP, Chamaillard M, Zouali H, et al. Association of NOD2 leucine-rich repeat variants with susceptibility to Crohn’s disease. Nature 2001; 411 : 599–603. 4. Ogura Y, Bonen DK, Inohara N, et al. A frameshift mutation in NOD2 associated with susceptibility to Crohn’s disease. Nature 2001; 411 : 603–6. 5. Chamaillard M, Iacob R, Desreumaux P, Colombel JF. Advances and perspectives in the genetics of inflammatory bowel diseases. Clin Gastroenterol Hepatol 2006; 4 :143–51. 6. Duerr RH, Taylor KD, Brant SR, et al. A genome-wide association study identifies IL23R as an inflammatory bowel disease gene. Science 2006; 314 : 1461–3. 7. Hue S, Ahern P, Buonocore S, et al. Interleukin-23 drives innate and T cell-mediated intestinal inflammation. J Exp Med 2006; 203 : 2473–83. 8. Yen D, Cheung J, Scheerens H, et al. IL-23 is essential for T cell-mediated colitis and promotes inflammation via IL-17 and IL-6. J Clin Invest 2006; 116 : 1310–6. 9. Mangan PR, Harrington LE, O’Quinn DB, et al. Transforming growth factor-beta induces development of the T(H)17 lineage. Nature 2006; 441 : 231–4. 10. Verreck FA, de Boer T, Langenberg DM, et al. Human IL-23-producing type 1 macrophages promote but IL-10-producing type 2 macrophages subvert immunity to (myco)bacteria. Proc Natl Acad Sci USA 2004; 101 : 4560–5. 11. Cooper AM, Kipnis A, Turner J, et al. Mice lacking bioactive IL-12 can generate protective, antigen-specific cellular responses to mycobacterial infection only if the IL-12 p40 subunit is present. J Immunol 2002; 168 : 1322–7. |