| |
| Med Sci (Paris). 2007 March; 23(3): 252–255. Published online 2007 March 15. doi: 10.1051/medsci/2007233252.Comment le nez se connecte au cerveau Aurélie Mouret and Pierre-Marie Lledo* Unité « Perception et Mémoire », InstitutPasteur, CNRS URA2182, 25, rue du Docteur Roux, 75724 Paris Cedex 15, France MeSH keywords: Animaux, Cartographie cérébrale, AMP cyclique, Protéines G, Humains, Mammifères, Rappel mnésique, Nez, Odeurs, Bulbe olfactif, Nerf olfactif, Voies olfactives, Neurorécepteurs olfactifs, Récepteurs olfactifs, Systèmes de seconds messagers, Odorat |
« Les odeurs ! Premier témoignage de notre fusion au monde »
G. Bachelard (La poétique de la rêverie)
Sens archaïque, l’odorat a été transmis pendant des centaines de millions d’années, jusqu’à ce qu’il nous parvienne, presque inchangé. Chez les mammifères, cet héritage se manifeste aujourd’hui par la connexion directe des neurones olfactifs sensoriels au premier relais central : le bulbe olfactif. Ainsi, le message olfactif qui naît dans l’organe sensoriel pénètre rapidement le cerveau olfactif pour y transmettre un flux d’informations sur la nature, exquise ou non, des molécules odorantes qui parviennent à nos narines. Autre preuve attestant de cet héritage lointain, l’odorat se met en place dès la formation de l’embryon, bien avant sa naissance. Mais comment la « connectique » qui relie l’organe sensoriel au premier relais cérébral peut-elle s’établir si précocement et en même temps si précisément ? Récemment, l’équipe dirigée par H. Sakano de l’université de Tokyo vient de répondre à cette question [
1]. |
La saga des récepteurs olfactifs Depuis l’avènement de la biologie moléculaire, portée par R. Axel et L. Buck dans le champ de l’olfaction, nos connaissances sur l’odorat n’ont cessé de s’accroître. Aujourd’hui, ce sens mystérieux livre peu à peu ses secrets et l’opinion publique est fascinée par la découverte du pouvoir des odeurs. Limité jusqu’alors aux mondes des poètes, gastronomes, œnologues et autres parfumeurs, ce sujet d’étude attire désormais l’attention des scientifiques contemporains. Aussi connaissons-nous assez bien les premières étapes qui participent à la perception et à la reconnaissance des molécules odorantes. Nous savons que la sélection des aliments, la détection des substances toxiques et des nourritures avariées, l’attraction et la reconnaissance des partenaires sexuels, l’établissement de liens parentaux et sociaux, manifestes chez l’animal et encore très présents chez l’humain, reposent sur une organisation neuronale complexe et bien particulière. Celle-ci suppose que dans la cavité nasale, les neurones sensoriels de la muqueuse olfactive (organe sensoriel de l’odorat) soient capables de capter les molécules volatiles de notre environnement. À cet endroit, les molécules odorantes se dissolvent, sont captées par les neurones sensoriels qui émettent un signal électrique, transmis ensuite au bulbe olfactif [
2]. Mais pour émettre un tel signal, le neurone sensoriel doit d’abord convenablement convertir le signal chimique reçu. Les études des mécanismes de la transduction des signaux olfactifs ont d’abord montré l’importance d’une première cascade enzymatique impliquant un second messager (l’AMP cyclique) [
3]. Vint ensuite la découverte de la participation d’un processus de transduction faisant intervenir une protéine liée au GTP, qui fournit à L. Buck et R. Axel le fil conducteur de l’élégante stratégie qui allait les conduire à découvrir les récepteurs aux molécules odorantes [
4], puis à l’obtention du prix Nobel en 2004 [
5]. Grâce à leurs travaux, nous sommes aujourd’hui assurés qu’il s’agit de protéines, et nous avons accumulé un certain nombre de connaissances précises sur leur constitution et leur fonctionnement (Figure 1). Les récepteurs olfactifs sont des protéines transmembranaires dont le nombre avoisine le millier chez les rongeurs et 330 chez l’homme. Leur activation concourre à la formation d’AMP cyclique (AMPc) qui contrôle des canaux ioniques responsables de la dépolarisation du neurone sensoriel. C’est donc à partir de l’activation spécifique de récepteurs protéiques par les molécules odorantes que prend forme l’odeur. À titre d’exemple, l’odeur de jasmin se compose de plus de deux cents molécules. Qu’il vienne à en manquer une seule et l’odeur délicate du jasmin sera profondément transformée.  | Figure 1.
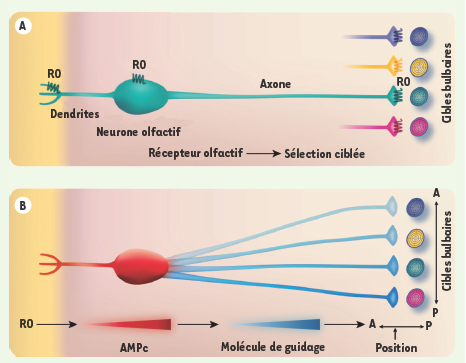
Formation de la carte olfactive. A. Chez les mammifères, les récepteurs olfactifs (RO) pourraient guider les axones des neurones olfactifs sensoriels vers leurs cibles glomérulaires appropriées au niveau du bulbe olfactif. B. En fonction de l’identité du récepteur olfactif exprimé dans un neurone, une certaine quantité d’AMP cyclique (AMPc) est produite, qui induit l’expression de certaines molécules de guidage (comme les neuropilines). Il existe une corrélation entre la quantité d’AMPc intracellulaire, et donc celle des molécules de guidage, et la position de la cible glomérulaire sur l’axe antéro-postérieur (A/P) du bulbe olfactif. |
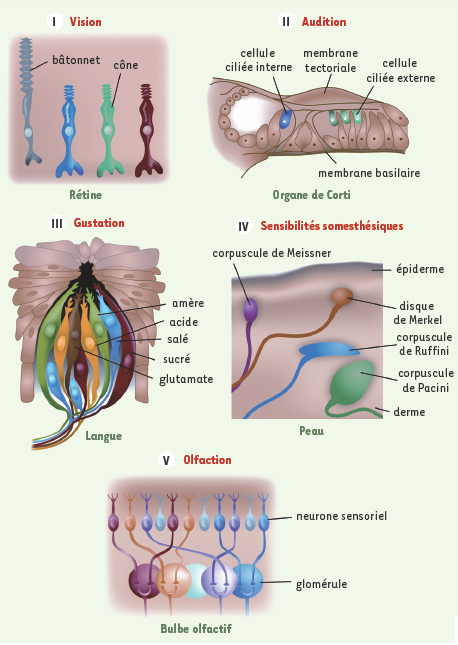
Les résultats issus de la biologie moléculaire nous ont appris que de tous les codages d’information fournis par nos systèmes sensoriels, celui de l’olfaction restait de loin le plus singulier. Si trois photorécepteurs nous suffisent pour percevoir l’infinité des couleurs, plusieurs centaines de récepteurs aux molécules odorantes nous sont nécessaires pour sentir la vaste gamme des effluves qui nous entourent (Figure 2). Chacun des neurones sensoriels exprime un seul des récepteurs aux molécules odorantes, et ceux qui expriment le même convergent vers une structure anatomique nommée glomérule, située à une position précise dans le bulbe olfactif (Figure 2). C’est ainsi que se crée l’image bidimensionnelle d’une odeur : à partir de la précision de ces projections, et via une combinaison de processus d’activation de ces récepteurs, le cerveau parvient à distinguer l’odeur de cannelle de celle de vanille. Dans ces conditions, comment cette organisation spatiale cruciale pour le codage de l’information sensorielle peut-elle se construire si précisément ?  | Figure 2.
La découverte de la nature des récepteurs olfactifs montre combien le système olfactif est unique. Ce dernier adopte une stratégie différente de celle qui est suivie par les autres systèmes sensoriels. Pour analyser les informations visuelles, auditives, gustatives ou tactiles, les systèmes sensoriels correspondants ont développé un nombre limité de récepteurs et les ont répartis sur la surface de l’organe sensoriel de façon à ce qu’une partie du codage de l’information afférente renseigne sur la localisation précise des récepteurs activés par le stimulus. On parle dans ce cas de codage spatial. La découverte de l’existence d’une très grande diversité de récepteurs olfactifs montre que le système olfactif ne procède pas selon cette même forme de codage. Il est vrai que non seulement le stimulus olfactif n’a pas de dimension spatiale, mais ses paramètres sont de plus trop nombreux pour être correctement transposés dans les deux dimensions d’une surface sensorielle. La grande variété des récepteurs moléculaires capables de reconnaître les molécules odorantes montre qu’une association précise et particulière de récepteurs activés participe au traitement de l’information olfactive. Contrairement aux autres modalités sensorielles, le codage des odeurs est donc de nature combinatoire. |
|
La construction des images olfactives À l’heure actuelle, nous ne savons toujours pas exactement comment les neurones sensoriels exprimant un récepteur donné identifient leur cible glomérulaire aussi précisément. Si certaines molécules de guidage ont été identifiées, leur diversité, même combinatoire, ne suffit pas à expliquer le positionnement si précis de tant de glomérules différents ! La surprise fut grande lorsque l’on s’aperçut que non seulement les récepteurs olfactifs reconnaissaient les molécules odorantes, mais qu’ils apportaient aussi une information de position nécessaire au développement et à l’établissement des contacts synaptiques entre le neurone sensoriel et sa cible glomérulaire [
6,
7]. Mais comment peut-on relier l’identité des récepteurs olfactifs à une carte précise ? Sachant que les récepteurs olfactifs sont exprimés jusque dans les terminaisons neuronales [
8], on peut supposer qu’ils agissent directement comme récepteurs des molécules de guidage. Une autre hypothèse qui peut être avancée serait que l’identité du récepteur olfactif contrôle l’expression spécifique de certains récepteurs et/ou molécules de guidage. Cependant, bien que des molécules de guidage aient été impliquées dans la mise en place des cartes olfactives, jusqu’ici leur lien avec l’identité des récepteurs olfactifs n’avait pas été établi. Le travail du groupe de H. Sakano démontre que la teneur en AMPc dans le neurone sensoriel participe, via l’expression de molécule de guidage comme les neuropilines, à l’adressage des terminaisons des neurones sensoriels sur l’axe antéro-postérieur du bulbe olfactif (Figure 1). Ce modèle apporte enfin des éléments de réponse à l’énigme que représente le code permettant de relier un récepteur protéique donné à une position précise. Il reste à vérifier comment chaque récepteur peut être lié à un niveau d’AMPc intracellulaire unique. Il semble donc que les axones convergent vers une position glomérulaire donnée en suivant un gradient de molécules de guidage, et ce de manière indépendante de l’activité neuronale. Néanmoins, sous cette forme, l’adressage semble bien grossier et pourrait représenter uniquement la première étape de l’adressage des axones. Les mécanismes intervenant dans l’établissement d’une « connectique » bien plus précise lorsque les axones ont atteint approximativement leur cible commencent à être élucidés. La même équipe vient en effet de démontrer que selon l’identité du récepteur olfactif présent dans un neurone, certaines molécules d’adhérence cellulaire et de répulsion sont spécifiquement exprimées et régulées d’une manière dépendante de l’activité [
9]. Jusqu’à maintenant, selon l’opinion générale, l’activité sensorielle n’est pas requise pour la mise en place des connexions appropriées dans le bulbe et ces nouveaux résultats posent de nouvelles interrogations fascinantes. Ainsi peut-on se demander si cette activité neuronale nécessaire est simplement spontanée (ou aléatoire), ou bien si elle est coordonnée par certaines molécules, parmi lesquelles pourraient figurer les molécules odorantes. Le fait que l’activité neuronale soit dépendante de l’activité sensorielle pourrait ressembler à ce que l’on constate lors du raffinement des connexions olfactives qui s’effectue après la naissance [
10]. Le modèle selon lequel des gradients moléculaires, puis des processus dépendants de l’activité sculptent les connexions rappellent les mécanismes décrits lors de la mise en place des cartes neurales des autres systèmes sensoriels. Cependant, si pour les systèmes visuel, auditif et somatosensoriel une carte topographique précise est essentielle à la représentation des informations sensorielles, il n’est pas clairement établi si l’agencement spatial des glomérules a des implications fonctionnelles immédiates pour le traitement des informations olfactives. Reste qu’il est particulièrement satisfaisant pour les biologistes de s’apercevoir que la mise en place du système olfactif, malgré ses propriétés singulières, suit des règles analogues à celles qui régissent le développement des autres systèmes sensoriels. Quelle belle confirmation de l’unité du Vivant ! |
1. Imai T, Suzuki M, Sakano H. Odorant receptor-derived cAMP signals direct axonal targeting. Science 2006; 314: 657–61. 2. Lledo PM, Gheusi G, Vincent JD. Information processing in the mammalian olfactory system. Physiol Rev 2005; 85: 281–317. 3. Buck LB. The search for odorant receptors. Cell 2004; 116: 117–9. 4. Buck L, Axel R. A novel multigene family may encode odorant receptors: a molecular basis for odor recognition. Cell 1991; 65 : 175–87. 5. MacLeod P. Le prix Nobel de Médecine 2004 à Richard Axel et Linda B. Buck. L’olfaction sous les projecteurs. Med Sci (Paris) 2004; 20 : 1045. 6. Wang F, Nemes A, Mendelsohn M, Axel R. Odorant receptors govern the formation of a precise topographic map. Cell 1998; 93 : 47–60. 7. Mombaerts P, Wang F, Dulac C, et al. Visualizing an olfactory sensory map. Cell 1996; 87 : 675–86. 8. Barnea G, O’Donnell S, Mancia F, et al. Odorant receptors on axon termini in the brain. Science 2004; 304 : 1468. 9. Serizawa S, Miyamichi K, Takeuchi H, et al. A neuronal identity code for the odorant receptor-specific and activity-dependent axon sorting. Cell 2006; 127: 1057–69. 10. Zou DJ, Feinstein P, Rivers AL, et al. Postnatal refinement of peripheral olfactory projections. Science 2004; 304 : 1976–9. |