| |
| Med Sci (Paris). 2007 April; 23(4): 353–355. Published online 2007 April 15. doi: 10.1051/medsci/2007234353.Nouveaux mécanismes régulateurs
de Bcl10 : une avancée dans la compréhension de la survenue des lymphomes du MALT ? Camille Lobry and Robert Weil* Unité de Signalisation Moléculaire et Activation Cellulaire, URA 2582 Centre National de la Recherche Scientifique (CNRS), Institut Pasteur, 25, rue du Docteur Roux, 75724 Paris Cedex 15, France MeSH keywords: Protéines adaptatrices de la transduction du signal, Caspases, Noyau de la cellule, Transformation cellulaire néoplasique, Chromosomes humains de la paire 14, Cytoplasme, Régulation de l'expression des gènes tumoraux, Humains, Lymphome B de la zone marginale, Modèles biologiques, Facteur de transcription NF-kappa B, Protéines tumorales, Protéines de fusion oncogénique, Phosphorylation, Maturation post-traductionnelle des protéines, Translocation génétique |
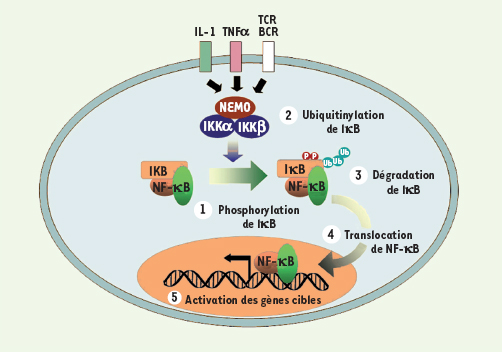
NF-κB et lymphomes du MALT La voie de signalisation NF-κB (Figure 1) joue un rôle important dans les réponses immune, inflammatoire et anti-apoptotique, à la fois au cours des processus de différenciation (en particulier dans le système hématopoïétique) et de cancérogenèse [
1]. Dans ce dernier cas, son implication est liée en grande partie à la présence, parmi ses gènes cibles, d’un grand nombre de gènes de résistance à l’apoptose, tels que Bcl-XL, XIAP, A1, IEX-1L et GADD45β ainsi que de gènes impliqués dans la croissance tumorale, comme la cycline D1 et le proto-oncogène c-myc.  | Figure 1.
Mécanisme d’activation de NF-κB. En l’absence de signaux extracellulaires spécifiques, les dimères NF-κB sont retenus inactifs dans le cytoplasme par leur interaction avec les molécules de la famille IκB. À la suite de diverses stimulations (TNFα, interleukine-1, TCR ou BCR…), les molécules IκB sont phosphorylées : (1) par un complexe kinase composé de trois sous-unités, deux sous-unités catalytiques à activité protéine kinase (IKKα et IKKβ) et une sous-unité régulatrice, NEMO/IKKγ. À la suite de ces phosphorylations, les IκB sont ubiquitinylées (2) puis dégradées par le protéasome (3), et les complexes NF-κB sont alors transportés dans le noyau (4) où ils se fixent sur les promoteurs de leurs gènes cibles (5).
|
Les lymphomes du MALT (mucosa-associated lymphoid tissue) sont un exemple de cancers impliquant NF-κB. Ce sont des formes hétérogènes de lymphomes non hodgkiniens impliquant une prolifération lymphoïde B dont l’origine est la zone marginale des follicules lymphoïdes associés aux muqueuses. Les lymphomes du MALT sont souvent associés à une stimulation antigénique chronique impliquant les pathogènes suivants : H. pylori dans le lymphome du MALT gastrique, C. jejuni dans le lymphome du MALT intestinal, B. bugdorferi dans le lymphome du MALT cutané, et enfin très récemment C. psittaci dans le lymphome du MALT oculaire. Quatre translocations chromosomiques, t(11 ;18)(p21 ;q21), t(1 ;14)(p22q32), t(14 ;18)(q32 ;q21) et t(3 ;14)(p13 ;q32) sont spécifiquement associées aux lymphomes du MALT. Les translocations t(1 ;14)(p22q32) et t(14 ;18)(q32 ;q21) fusionnent respectivement le gène BCL10 et le gène MALT1 avec le promoteur des chaînes lourdes des immunoglobulines tandis que t(11 ;18)(p21 ;q21) fusionne les gènes API2 et MALT1. Les produits des gènes MALT1 et BCL10 sont directement impliqués dans les voies de signalisation menant à l’activation de NF-κB par le récepteur des lymphocytes B (BCR) et le récepteur des lymphocytes T (TCR). Des effecteurs communs aux voies du BCR (B cell receptor) et du TCR (T cell receptor) ont été identifiés [
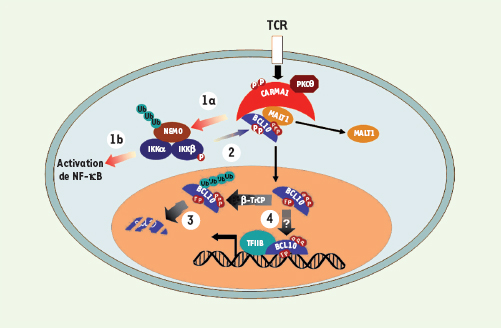
2] dont : (1) CARMA1, qui fait partie d’une famille caractérisée par la présence d’un domaine CARD (caspase recruitement domain) amino-terminal, d’un domaine coiled-coil et d’un motif carboxy-terminal « MAGUK » (membrane-associated guanylate kinase) contenant des motifs PDZ, SH3 et guanylate (GUK) ; (2) Bcl10, une protéine possédant un domaine homotypique CARD et un domaine riche en sérine et thréonine ; et (3) la paracaspase MALT1. Différentes approches biochimiques et génétiques ont permis de déterminer l’ordre chronologique des événements conduisant à l’activation de NF-κB par le récepteur des lymphocytes T : dans un premier temps, CARMA1 est phosphorylée par PKCθ, ce qui permet le recrutement de Bcl10/MALT1 pour former le complexe CARMA1/Bcl10/MALT1 (CBM). Dans un deuxième temps, le complexe NEMO/IKK est recruté au niveau de CBM. Dans un troisième temps, Bcl10, en association avec MALT1, va activer le complexe NEMO/IKK par un mécanisme complexe mettant en jeu l’ubiquitinylation de NEMO et la phosphorylation d’IKKβ par la kinase TAK1 (Figure 2-partie 1).  | Figure 2.
Mécanismes régulateurs de Bcl10. CARMA1 est phosphorylée par PKCθ, ce qui permet le recrutement de Bcl10/MALT1 pour former le complexe CARMA1/Bcl10/MALT1 (CBM). Bcl10, en association avec MALT1, va activer le complexe NEMO/IKK (1a) par un mécanisme mettant en jeu l’ubiquitinylation de NEMO et la phosphorylation d’IKKβ. Le complexe NEMO/IKK, après avoir permis l’activation de NF-κB (1b),phosphoryle Bcl10 sur plusieurs sites (2). Bcl10 se dissocie du complexe CBM et est transporté dans le noyau où il est dégradé (3) et pourrait avoir un rôle sur la transcription des gènes (4).
|
|
Régulation post-traductionnelle de Bcl10 De nombreux travaux se sont focalisés sur les points de contrôle de cette voie d’activation et plus particulièrement sur les modifications post-traductionnelles de Bcl10. Plusieurs études indépendantes ont suggéré que la phosphorylation de Bcl10 pourraient réguler à la fois positivement et négativement l’activation de NF-κB. Ainsi une étude menée par Ruefli-Brasse et al. [
3] suggère que Bcl10 pourrait être phosphorylée par la kinase Rip2 pour permettre l’activation de NF-κB. Ishiguro et al. [
4] proposent que la phosphorylation de Bcl10 par la calmoduline kinase 2 entraîne une atténuation de l’activation de NF-κB. Pour Wegener et al. [
5] Bcl10 serait phosphorylée par IKKβ, régulant à la fois positivement et négativement NF-κB, d’une part en stabilisant l’interaction de Bcl10 avec CARMA1 et, d’autre part, en dissociant le complexe activateur formé par l’interaction entre Bcl10 et MALT1. Différentes études ont montré que Bcl10 était dégradée en réponse à la stimulation du TCR [
6–
8]. Récemment, nous avons montré que lors de l’activation du TCR, le complexe kinase NEMO/IKK phosphoryle Bcl10 (Figure 2-partie 2) sur une séquence consensus (DS/TΨXXS/T) reconnue par la machinerie d’ubiquitinylation SCF-β-TrCP, ce qui permet sa dégradation par le protéasome [8] (Figure 2-partie 3). Cette dégradation de Bcl10 régule négativement la réponse immune, car l’expression dans des lymphocytes d’une forme non dégradable de Bcl10 est responsable d’une production très augmentée d’IL-2 (une cytokine dont la synthèse dépend de l’activation de NF-κB) en réponse à une stimulation du TCR. Par une approche de microscopie, nous avons étudié dans des lymphocytes T la localisation subcellulaire à l’état basal et après stimulation du TCR de la forme sauvage et du mutant non dégradable de Bcl10. Ces expériences ont montré que, contrairement à la molécule Bcl10 sauvage qui est présente de façon diffuse dans le cytoplasme avant stimulation et disparaît après stimulation, le mutant non dégradable de Bcl10 se concentre sous forme de structures nucléaires punctiformes après stimulation du TCR. Cette accumulation nucléaire de Bcl10 peut aussi être mise en évidence en bloquant sa dégradation avec un inhibiteur du protéasome. L’ensemble de ces résultats suggère que l’activation du TCR induit la phosphorylation de Bcl10 par les IKK, son ubiquitinylation et sa dégradation par le protéasome dans le noyau. |
Localisation nucléaire de Bcl10 et lymphomes du MALT La localisation nucléaire de Bcl10 ayant été observée dans plusieurs types de lymphomes, dont les lymphomes du MALT, des mutations dans la séquence consensus DS/TΨXXS/T pourraient être impliquées dans la survenue de lymphomes par le biais d’au moins deux mécanismes différents mais non exclusifs : (1) la stabilisation de Bcl10 pourrait prolonger l’activation de NF-κB et permettre ainsi l’expression de gènes anti-apoptotiques ; (2) et/ou la stabilisation et la translocation nucléaire de Bcl10 pourrait avoir un rôle sur l’expression de certains gènes directement impliqués dans la cancérogenèse. Cette dernière hypothèse repose sur des études montrant que Bcl10 pourrait être un activateur transcriptionnel et peut interagir avec TFIIB (Figure 2-partie 4), un composant essentiel de la machinerie de transcription [
9]. De plus, l’existence de mutations affectant l’acide aspartique (D) de la séquence consensus DS/TΨXXS/T de Bcl10 a été observée dans un cas de lymphome B à grandes cellules [
10] et dans un cas de mésothéliome [
11]. Un acide aspartique homologue présent dans la séquence consensus DS/TΨXXS/T de β-caténine est la cible de mutations dans un grand nombre de cancers [
12,
13]. De nombreuses données expérimentales placent ainsi Bcl10 au centre d’une cascade d’évènements de phosphorylations et d’ubiquitinylations permettant l’activation de NF-κB par le TCR. L’étude des mécanismes de régulation de Bcl10 devrait permettre de mieux comprendre les dysfonctionnements cellulaires à l’origine des lymphomes du MALT et pourrait également offrir de nouvelles cibles thérapeutiques. |
1. Karin M. Nuclear factor-kappaB in cancer development and progression. Nature 2006; 441 : 431–6. 2. Weil R, Israël A. Deciphering the pathway from the TCR to NF-kappaB. Cell Death Differ 2006; 13 : 826–33. 3. Ruefli-Brasse AA, Lee WP, Hurst S, Dixit VM. Rip2 participates in Bcl10 signaling and T-cell receptor-mediated NF-kappa B activation. J Biol Chem 2003; 279 : 1570–74. 4. Ishiguro K, Ando T, Goto H, Xavier R. Bcl10 is phosphorylated on Ser138 by Ca2+/calmodulin-dependent protein kinase II. Mol Immunol 2007; 44 : 2105–10. 5. Wegener E, Oeckinghaus A, Papadopoulou N, et al. Essential role for IkappaB kinase beta in remodeling Carma1-Bcl10-MALT1 complexes upon T cell activation. Mol Cell 2006; 23 : 13–23. 6. Scharschmidt E, Wegener E, Heissmeyer V, et al. Degradation of Bcl10 induced by T-cell activation negatively regulates NF-kappa B signaling. Mol Cell Biol 2004; 24 : 3860–73. 7. Hu S, Alcivar A, Qu L, et al. CIAP2 inhibits antigen receptor signaling by targeting Bcl10 for degradation. Cell Cycle 2006; 5 : 1438–42. 8. Lobry C, Lopez T, Israel A, Weil R. Negative feedback loop in T cell activation through IkappaB kinase-induced phosphorylation and degradation of Bcl10. Proc Natl Acad Sci USA 2007; 104 : 908–13. 9. Liu Y, Dong W, Chen L, et al. Characterization of Bcl10 as a potential transcriptional activator that interacts with general transcription factor TFIIB. Biochem Biophys Res Commun 2004; 320 : 1–6. 10. Lee SH, Shin MS, Kim HS, et al. Point mutations and deletions of the Bcl10 gene in solid tumors and malignant lymphomas. Cancer Res 1999; 59 : 5674–7. 11. Willis TG, Jadayel DM, Du MQ, et al. Bcl10 is involved in t(1;14)(p22;q32) of MALT B cell lymphoma and mutated in multiple tumor types. Cell 1999; 96 : 35–45. 12. Wu G, Xu G, Schulman BA, et al. Structure of beta-TrCP-Skp1-beta-catenin complex: destruction motif binding and lysine specificity of the SCFbeta-TrCP1 ubiquitin ligase. Mol Cell 2003; 11 : 1445–56. 13. Chan EF, Gat U, McNiff JM, Fuchs E. A common human skin tumour is caused by activating mutations in beta-catenin. Nat Genet 1999; 21 : 410–3. |