| |
| Med Sci (Paris). 2007 April; 23(4): 371–378. Published online 2007 April 15. doi: 10.1051/medsci/2007234371.Immunité muqueuse et vaccination Fabienne Anjuère1* and Cécil Czerkinsky2* 1Inserm U721, Immunité muqueuse et vaccination, Faculté de Médecine Pasteur, avenue de Valombrose, 06107 Nice Cedex 2, France 2Inserm U721, Immunité muqueuse et vaccination, Faculté de Médecine Pasteur, avenue de Valombrose, 06107 Nice Cedex 2, France et International Vaccine Institute, Séoul, Corée du Sud |
Les muqueuses couvrent les tractus aéro-digestif et uro-génital, la conjonctive, la paroi de l’oreille interne ainsi que les canaux des glandes exocrines. Les surfaces muqueuses sont protégées des agressions extérieures par des mécanismes de défense physico-chimiques et un système immunitaire muqueux inné et spécifique spécialisé. Le système immunitaire associé aux muqueuses (SIAM) (mucosa associated lymphoid tissue, MALT) comprend environ 80 % des cellules immunitaires de l’organisme et constitue le plus important système lymphoïde chez les mammifères [
1]. Il a trois grandes fonctions : (1) protéger les surfaces muqueuses contre la colonisation et l’invasion par des pathogènes microbiens ; (2) prévenir l’internalisation de bactéries commensales ou d’antigènes non dégradés comme les protéines dérivées de l’alimentation et de l’environnement ; et (3) empêcher le développement de réactions inflammatoires non désirées contre certains antigènes qui franchissent la barrière épithéliale. |
Le tissu lymphoïde associé aux muqueuses Le SIAM possède des sites inducteurs, où les lymphocytes naïfs sont activés par des cellules présentatrices d’antigènes (CPAg), et des sites effecteurs, où les cellules effectrices (lymphocytes activés et cellules de l’immunité innée) contrôlent localement les agents étrangers. Par exemple, le tissu lymphoïde associé au tractus digestif (gut-associated lymphoreticular tissue, GALT) comprend les plaques de Peyer, les ganglions mésentériques, l’appendice ou encore les amygdales, organes lymphoïdes organisés qui constituent les principaux sites d’induction des réponses immunitaires intestinales [
2]. Les sites effecteurs muqueux sont constitués par l’épithélium de revêtement où se concentrent les lymphocytes T intra-épithéliaux (LIE) et les anticorps sécrétoires, notamment les IgA sécrétoires (S-IgA). Le compartiment sous-épithélial, ou chorion, constitue un site effecteur diffus où s’accumulent les cellules effectrices (cellules NK-like, macrophages, lymphocytes B et T). Des CPAg parmi lesquelles les cellules dendritiques (CD), sentinelles du système immunitaire, sont également présentes dans le tissu lymphoïde muqueux diffus, prêtes à capturer les agents étrangers. Mécanismes inducteurs Les antigènes présents à la surface muqueuse peuvent être capturés par les cellules épithéliales ou les cellules M présentes dans certains tissus muqueux et spécialisées dans l’échantillonnage des antigènes (pour revue, voir [
3]). Brièvement, les antigènes ainsi absorbés, ou leurs dérivés, sont transmis aux CPAg muqueuses (lymphocytes B, macrophages, CD). Parmi ces CPAg, les CD peuvent aussi capturer directement les antigènes dans la lumière de la muqueuse grâce à l’extension de leurs dendrites entre les cellules épithéliales. Les CPAg migrent alors vers les sites inducteurs pour y activer les lymphocytes T CD4 + et CD8 + naïfs. Certains antigènes peuvent également être présentés directement par les cellules épithéliales aux lymphocytes T intra-épithéliaux avoisinants (lymphocytes γδ, lymphocytes NKT…). La nature des antigènes, leur concentration et leur biodisponibilité, le type de CPAg impliquées et le microenvironnement sont autant de paramètres qui vont influer sur les réponses immunitaires induites. Ainsi, la présentation antigénique, par les CD muqueuses, de la plupart des molécules étrangères non pathogènes conduit à un phénomène d’immunosuppression appelé tolérance orale. Ce type de réponse s’explique principalement par la génération de lymphocytes T auxiliaires de type 2 (Th2) et de lymphocytes T régulateurs produisant de l’IL-10 ou du TGF-β [
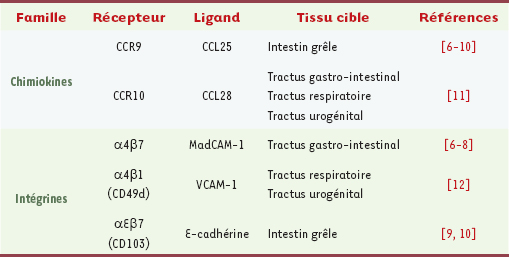
4]. En revanche, les antigènes et molécules immunostimulantes constitutifs de la plupart des agents pathogènes sont porteurs de motifs moléculaires particuliers ou PAMP ( pathogen-associated molecular patterns) constituant des signaux de danger. Les PAMP sont reconnus par des récepteurs spécifiques ou senseurs de danger (parmi lesquels les récepteurs de type Toll-like) exprimés par les cellules épithéliales, certains macrophages ou les CD. L’activation de ces différents détecteurs de danger déclenche une cascade de signaux conduisant à l’initiation des réponses immunitaires humorales et cellulaires anti-infectieuses et au contrôle de la tolérance orale [ 2, 3]. Les lymphocytes B et T activés émigrent dans la circulation sanguine via la lymphe efférente et se dispersent sélectivement dans les tissus effecteurs muqueux pour se différencier en cellules effectrices (plasmocytes sécréteurs d’anticorps, cellules cytotoxiques, cellules régulatrices). Un contingent de lymphocytes activés au niveau des sites inducteurs se convertit en cellules mémoire qui circulent entre les différents sites inducteurs. La migration des cellules effectrices vers les muqueuses est sous la dépendance de facteurs chimiotactiques (chimiokines) et/ou inflammatoires produits par le microenvironnement muqueux. Leur domiciliation muqueuse est orchestrée par des mécanismes de reconnaissance moléculaire restreints aux muqueuses impliquant des intégrines et adressines spécifiques [
5] (Tableau I). Les CD des sites inducteurs muqueux semblent jouer un rôle important dans la migration sélective des lymphocytes muqueux. Ainsi, des CD murines isolées de ganglions mésentériques et de plaques de Peyer augmentent l’expression de l’intégrine α4β7 et du récepteur de chimiokine CCR9 à la surface des lymphocytes T qu’elles activent, signature moléculaire d’un devenir intestinal [
6,
7]. L’acide rétinoïque produit par certaines populations de CD intestinales semble impliqué dans cet effet [
8]. Il a été également montré récemment que les CD intestinales exprimant l’intégrine αEβ7 (CD103) étaient responsables de la différenciation de lymphocytes T CD4 et CD8 en cellules effectrices à devenir muqueux [
9,
10]. L’ensemble de ces données explique en partie le concept de compartimentalisation du SIAM, suggéré par l’observation d’une redistribution préférentielle des lymphocytes activés au niveau d’une muqueuse dans la muqueuse d’origine ou dans une muqueuse distante plutôt que dans un organe systémique.  | Tableau I.
Récepteurs et ligands impliqués dans la migration et la domiciliation muqueuse des lymphocytes. MadCAM-1 : mucosal vascular addressin cell adhesion molecule-1 ; VCAM-1 : vascular cell adhesion molecule-1. |
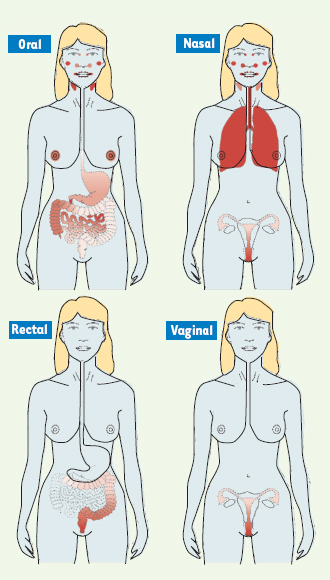
Cela implique que, dans une approche vaccinale, la voie d’immunisation soit choisie en fonction du site où la réponse effectrice doit être exprimée. Comme l’illustre la Figure 1, alors que l’immunisation par voie orale peut induire des réponses anticorps notables dans l’intestin grêle, le côlon ascendant et les glandes salivaires et mammaires, cette voie est inefficace pour la production d’anticorps de type IgA au niveau du segment distal du côlon, des amygdales et de la muqueuse génitale féminine [
13,
14]. L’immunisation par voie nasale induit préférentiellement des réponses anticorps dans la muqueuse du tractus respiratoire et dans les sécrétions régionales (nasales et salivaires) [14,
15]. De plus, l’immunisation par voie nasale peut induire des réponses anticorps dans la muqueuse cervico-vaginale, une observation particulièrement intéressante pour le développement de vaccins contre les maladies sexuellement transmissibles [14, 15]. 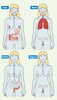 | Figure 1.
Réponses sécrétoires à IgA induites par différentes voies d’immunisation muqueuse chez la femme. Le système immun muqueux commun est plus compartimenté qu’initialement décrit. Chez l’humain, l’administration de la sous-unité B de la toxine cholérique (CTB) par différentes voies muqueuses a permis d’établir clairement que les réponses les plus puissantes sont celles qui sont induites localement [ 13, 14]. Des réponses notables sont ensuite engendrées dans les muqueuses voisines ou spécifiquement inter-connectées comme dans le cas de la muqueuse intestinale et des glandes mammaires chez la femme allaitant. De plus, fait unique, l’immunisation par voie nasale induit non seulement de fortes réponses immunitaires au niveau du tractus respiratoire, mais également au niveau de la muqueuse cervico-vaginale [ 14, 15]. L’intensité de l’ombrage (rouge-rose) représente la puissance des réponses sécrétoires observées après l’administration de l’antigène par différentes voies muqueuses. |
Mécanismes effecteurs Les muqueuses sont dotées de trois niveaux de défense contre les agents étrangers, déclenchés en fonction du danger : (1) les cellules épithéliales produisent du mucus et des facteurs anti-microbiens ou défensines ; (2) les cellules de l’immunité innée (neutrophiles, macrophages, cellules NK-like, mastocytes, CD) recrutées au niveau des muqueuses peuvent déclencher une réaction immunitaire non spécifique immédiate contre les pathogènes ; (3) les CD font le lien entre l’immunité innée et spécifique et participent à l’initiation des réponses immunitaires spécifiques anti-infectieuses et régulatrices. Réponses immunitaires protectrices La défense immunitaire humorale spécifique des surfaces muqueuses est contrôlée principalement par les immunoglobulines sécrétoires de type IgA (S-IgA), anticorps prédominants des sécrétions humaines (Tableau II). La production des IgA spécifiques dirigées contre des pathogènes muqueux ou des antigènes protéiques solubles est T-dépendante [
16]. Des cytokines, dont le TGF-β et l’IL-10 produites par les différentes cellules du tissu muqueux (cellules épithéliales mais aussi fibroblastes et cellules de l’immunité innée), participent, avec les lymphocytes T auxiliaires, à la commutation isotypique des lymphocytes B muqueux et à leur différenciation en plasmocytes sécréteurs d’IgA. Cela suggère l’importance du microenvironnement muqueux dans ce phénomène [
17]. Des immunoglobulines de type IgM ou IgG d’origine muqueuse ou sérique contribuent également à la défense immunitaire des muqueuses uro-génitale et du tractus respiratoire.  | Tableau II.
Les S-IgA dans la défense immunitaire muqueuse.
|
Les lymphocytes T muqueux cytotoxiques (CTL) sont des cellules effectrices majeures dans la défense immunitaire contre les infections par certains pathogènes (virus et parasites intracellulaires) [
18,
19]. Ainsi, après une immunisation orale, nasale, rectale ou vaginale avec des antigènes en présence de molécules immunostimulantes, qu’on appelle des adjuvants, l’essentiel des réponses CTL s’exprime localement, et dans certains cas de façon systémique [
20,
21]. Les pathogènes, ou des vecteurs vivants atténués, sont les plus efficaces pour induire des réponses T cytotoxiques dans les tissus muqueux. Les toxines bactériennes natives ou leurs dérivés détoxifiés peuvent également stimuler l’induction de CTL [
22]. La génération de lymphocytes T CD4+ auxiliaires qui pourraient activer des phagocytes lors d’une infection virale ou bactérienne ou après immunisation muqueuse avec des adjuvants semble indispensable à la défense immunitaire contre certains virus ou bactéries. Ainsi, des souris déficientes pour le complexe majeur d’histocompatibilité de classe II, immunisées par voie nasale, ne sont pas protégées de l’infection par H. pylori [
23]. Réponses immunitaires régulatrices Le SIAM a également développé des propriétés de tolérance immunologique permettant de contrôler les réactions inflammatoires contre la pléthore d’antigènes non pathogènes présents dans l’environnement. La tolérance muqueuse peut être induite par différents mécanismes régulateurs incluant la délétion ou l’anergie de lymphocytes activés, ou l’induction de lymphocytes T régulateurs [
24]. Différents types de lymphocytes régulateurs peuvent participer au contrôle des réponses muqueuses : (1) des lymphocytes T spécifiques de l’antigène 1 ; (2) des lymphocytes T CD4 +CD25 + naturels (Treg) contrôlant la prolifération par contact cellulaire. Ces derniers semblent jouer un rôle central dans la différenciation des lymphocytes T de type Tr1 ou Th3 [
25]. À noter que des lymphocytes Tγδ intra-épithéliaux et les lymphocytes intra-hépatiques peuvent également participer respectivement à la régulation des réponses immunitaires induites par inhalation ou par ingestion d’antigènes [
26,
27]. Par ailleurs, certains macrophages intestinaux peuvent également contrôler l’inflammation liée à la présence de pathogènes par un mécanisme inné d’anergie anti-inflammatoire tout en conservant une activité bactéricide [
28,
29]. L’activation, l’expansion et la survie des différents lymphocytes effecteurs (protecteurs et/ou régulateurs) sont contrôlées par des CPAg. Parmi ces dernières, les CD résidant dans le tissu muqueux jouent un rôle déterminant. Comme l’illustre la Figure 2, le degré de différenciation et la localisation tissulaire de ces CD muqueuses ainsi que la nature de l’antigène qu’elles capturent puis présentent aux lymphocytes, ont un effet majeur sur le(s) type(s) de réponses immunitaires induites, qu’il s’agisse de réponses productives ou de tolérance [4,
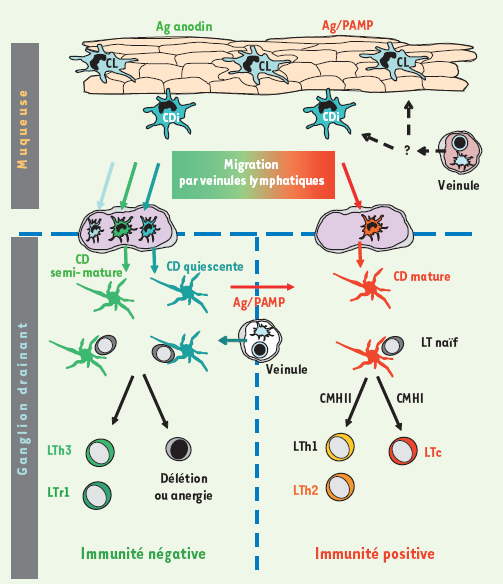
30]. Cette notion est importante pour l’élaboration de vaccins à administration muqueuse qui devront non seulement induire le recrutement mais aussi la maturation des CD muqueuses. 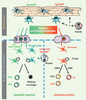 | Figure 2.
Cellules dendritiques muqueuses et réponses T effectrices. Des CD de type Langerhans (CL) et interstitielles (CDi) sont présentes respectivement dans l’épithélium et le chorion sous-épithélial de la muqueuse à l’état basal. Elles proviennent de précurseurs ou de CD qui arrivent dans le tissu par la circulation. Le rôle et l’hétérogénéité de ces différentes populations de CD restent encore à déterminer. D’une manière générale, les antigènes (Ag) et signaux de danger (PAMP) portés par les pathogènes lors d’une infection muqueuse vont influer sur le phénotype et le nombre de CD présentes dans la muqueuse, sur leur capacité à migrer dans les ganglions drainants et sur la nature des réponses T qu’elles vont induire. Ainsi, les CD du tissu muqueux (CDi ou CL) peuvent migrer dans le ganglion drainant après avoir capturé et apprêté un antigène anodin ou issu d’un pathogène (Ag/PAMP) pour se transformer en CD semi-mature (CD verte, colonne gauche) ou mature (CD rouge, colonne droite) capables de présenter des épitopes dérivés de cet antigène aux lymphocytes T du ganglion. Les antigènes peuvent également être capturés et apprêtés par les CD quiescentes présentes dans les ganglions qui proviennent des tissus ou de la circulation. Les CD localisées dans un ganglion présentant à leur surface l’antigène qu’elles auront capturé au niveau du tissu muqueux ou dans le ganglion induisent la différenciation de lymphocytes T naïfs (LT) en lymphocytes T effecteurs de type auxiliaires 1 ou 2 (LTh1 et LTh2), de lymphocytes T cytotoxiques (LTc) ou de lymphocytes T régulateurs (LTr1 et LTh3) spécifiques de l’antigène présenté. |
|
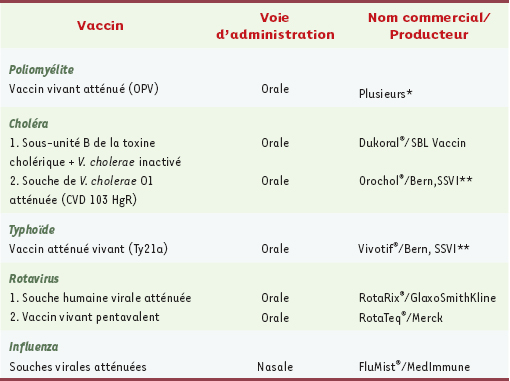
La majorité des infections débute par contact muqueux et l’application d’un vaccin au site de pénétration de l’agent pathogène est souvent nécessaire à l’induction d’une immunité protectrice. C’est le cas pour les infections gastro-intestinales causées par H. pylori, V cholerae, E. coli, Shigella spp., Clostridium difficile, les rotavirus et calicivirus ; pour les infections respiratoires dues à Mycoplasma pneumoniae, au virus de la grippe et au virus syncytial respiratoire et enfin pour les infections génitales sexuellement transmissibles induites par le VIH ou les virus herpétiques, Chlamydia trachomatis et Neisseria gonorrhoeæ. À noter cependant que dans certains cas, bien que ne protégeant pas de l’entrée du pathogène, les IgG systémiques sont suffisantes pour la protection (exemple du poliovirus). L’enjeu de la vaccination muqueuse est d’induire une barrière immunitaire muqueuse adaptée au pathogène, constituée de S-IgA neutralisantes et/ou de lymphocytes T auxiliaires et cytotoxiques. Les anticorps sécrétoires pourront bloquer la colonisation de l’épithélium muqueux par des bactéries non invasives, ou empêcher l’attachement de toxines microbiennes sur les cellules épithéliales, les lymphocytes T cytotoxiques pourront éliminer les cellules infectées et empêcher la multiplication microbienne. À titre d’exemple, dans le cas d’infections gastro-intestinales par V. cholerae et ETEC (Enterotoxigenic E. coli, responsable des diarrhées des voyageurs), la production locale de S-IgA est cruciale pour la protection de l’hôte et pour l’induction de la mémoire immunologique. Malgré l’attrait potentiel de la vaccination muqueuse, le développement de tels vaccins est limité par le manque d’adjuvants utilisables chez l’homme capables d’induire des réponses sécrétoires et cellulaires satisfaisantes. Aujourd’hui, seulement six vaccins sont couramment administrés par voie muqueuse (Tableau III) (pour revue, voir [
31]).  | Tableau III.
Vaccins commercialisés administrés par voie muqueuse. * Non disponibles en France. ** Swiss Serum and Vaccine Institute. |
|
Vaccins anti-inflammatoires Le système immunitaire a évolué de façon à éviter des réactions inflammatoires non désirées grâce à différents types de mécanismes régulateurs. La propriété de tolérance muqueuse s’avère une stratégie attrayante de contrôle des pathologies liées à des réponses inflammatoires contre les allergènes ou les antigènes du soi. Vaccins contre les désordres auto-immuns L’induction d’une tolérance muqueuse est spécifique de l’antigène utilisé mais peut avoir un impact non spécifique localement lorsqu’elle est due à la production de cytokines régulatrices comme le TGF−β et l’IL-10. Dans différents modèles animaux, il est possible de prévenir ou de retarder l’apparition de maladies auto-immunes expérimentales, d’arthrite rhumatoïde ou de diabète de type I [ 31,
32]. La dose d’auto-antigène utilisé ainsi que la voie et la fréquence d’administration influent sur la nature de la réponse. Ainsi, des lymphocytes synthétisant l’IL-10 sont produits en réponse à un antigène administré à faible dose par voie nasale, alors que le même antigène stimule préférentiellement des lymphocytes T producteurs de TGF-β lorsqu’il est administré par voie orale. En revanche, des doses importantes d’antigènes favorisent l’anergie des lymphocytes T spécifiques, voire leur mort. Cette approche thérapeutique s’est cependant révélée décevante chez l’homme, dans différents essais cliniques de phase III d’induction de tolérance par voie orale, par exemple dans le diabète de type I [
33] ou la sclérose en plaques [
34]. Il est cependant difficile à ce stade de savoir si la nature et/ou les doses des auto-antigènes utilisées sont responsables des résultats négatifs obtenus, ou si ces résultats indiquent que la tolérance orale n’est inductible que chez le sujet non sensibilisé. Cette dernière possibilité semble improbable au vu de plusieurs observations. En effet, la co-administration par voie orale ou nasale d’auto-antigènes liés à la sous-unité B de la toxine cholérique (CTB), vecteur de ciblage cellulaire d’antigènes aux propriétés tolérogènes, favorise la tolérance muqueuse dans différents modèles animaux de maladies expérimentales pré-établies [ 32]. De manière intéressante, le traitement par voie orale de patients atteints de maladie de Behcet par la CTB couplée à un peptide immuno-dominant de la HSP ( heat shock protein) 65 (essai clinique de phase I/II incluant 8 patients) s’est avéré efficace comme le suggère l’absence d’uvéite [
35]. L’efficacité clinique de cette approche doit être confirmée par un essai de phase III réalisé sur un plus grand nombre de patients. Vaccins anti-allergiques Les allergies de type I sont dues à l’activation de lymphocytes T auxiliaires de type CD4 + spécifiques d’allergènes impliqués dans la différenciation de plasmocytes à IgE, ces immunoglobulines étant responsables de la pathologie allergique. La stratégie thérapeutique actuellement utilisée, appelée immunothérapie anti-allergique spécifique ou désensibilisation, consiste à administrer par voie sous-cutanée des doses croissantes et répétées d’allergènes afin de réduire la production d’IgE par suppression ou déviation des réponses T CD4 pathologiques. L’immunothérapie par administration sublinguale d’allergènes, utilisée dans des essais cliniques de phase II/III, s’est avérée efficace dans des cas de rhinites et d’asthme (Tableau IV). Cette nouvelle stratégie est non invasive et permet l’auto-administration d’allergènes. De plus, fait intéressant, aucun épisode anaphylactique n’a été rapporté même lors de l’administration de fortes doses d’allergènes par cette voie. L’immunothérapie sublinguale constitue donc une approche recommandée par les directives de l’OMS depuis 1998.  | Tableau IV.
Essais cliniques d’immunothérapie anti-allergique par voie sublinguale. Efficacité démontrée par la réduction des symptômes cliniques et la diminution de la prise d’anti-histaminiques. |
Des extraits d’allergènes administrés à des doses élevées ont été utilisés dans la majorité de ces essais cliniques. De nouvelles approches utilisant la vaccination à l’aide d’analogues peptidiques d’allergènes en combinaison avec des composés immunomodulateurs administrés par voie muqueuse pourraient accroître l’innocuité et l’efficacité de l’immunothérapie anti-allergique. |
Optimisation des vaccins muqueux Les vaccins muqueux préventifs ou thérapeutiques doivent être conçus pour cibler le système immunitaire local. Le vaccin idéal doit : (1) préserver les antigènes vaccinaux des dégradations enzymatiques ou chimiques et limiter leur élimination ou leur dilution excessive; (2) cibler les cellules susceptibles de capturer l’antigène, cellules épithéliales ou cellules dendritiques ; (3) stimuler de façon appropriée l’immunité innée et spécifique afin d’induire une immunité spécifique adaptée. Système de ciblage cellulaire d’antigènes à administration muqueuse Une multitude de systèmes de ciblage cellulaire d’antigènes ont été utilisés : citons des vecteurs inertes (divers complexes lipidiques enrobant les antigènes,des particules biodégradables à base d’acide lactique ou glycolique, des protéines de transport ciblant les cellules épithéliales ou dendritiques), des vecteurs viraux (adénovirus, virus de la rougeole ou poxvirus) ou des vecteurs bactériens atténués (dérivés de S. typhi,
B. pertussis ou de bactéries commensales) [ 32]. Malgré leur efficacité dans différents modèles animaux, aucun de ces vecteurs n’a été pour l’instant approuvé pour son application en thérapeutique humaine. À noter que l’utilisation de pseudovirus ou VLP (particules virales dépourvues d’acide nucléique), potentiellement utiles comme vecteurs de ciblage cellulaire d’antigènes protéiques ou d’ADN mais aussi de molécules immunostimulantes, induit des réponses IgA sécrétoires et des réponses T cytotoxiques muqueuses protectrices dans plusieurs systèmes expérimentaux d’infection muqueuse [
36]. Adjuvants muqueux La toxine cholérique (CT) ou l’entérotoxine thermolabile de E. coli (LT) sont les adjuvants muqueux les plus puissants connus à ce jour [ 32]. De nombreux travaux ont tenté de développer des toxines détoxifiées ayant conservé un pouvoir adjuvant acceptable et utilisable chez l’homme. Parmi ces dérivés, la CTB recombinante est utilisée pour stimuler l’immunité sécrétoire ou pour induire une tolérance muqueuse contre des auto-antigènes ou allergènes. Des mutations de la sous-unité A toxique ont permis de concevoir des mutants de CT et LT ayant une cytotoxicité réduite mais leur pouvoir adjuvant est moindre. Par ailleurs, le pouvoir adjuvant de molécules contenant des PAMP, motifs moléculaires évoqués ci-dessus, sont en cours d’évaluation et pourraient constituer la prochaine génération d’adjuvants. Parmi ces PAMP, les ADN bactériens non méthylés (CpG) spécifiques du récepteur TLR-9 sont prometteurs et stimulent l’immunité innée et l’immunité spécifique après immunisation par voie nasale, orale et génitale. Fait intéressant, l’activité adjuvante des molécules de type CpG sur les réponses muqueuses peut être fortement amplifiée par leur couplage à la CTB [ 32]. |
Conclusion et perspectives Les avancées méthodologiques de cette dernière décennie ont permis une meilleure compréhension du SIAM. Ces progrès devraient faciliter le développement de vaccins muqueux anti-infectieux et anti-inflammatoires. Des méthodes analytiques permettant le suivi des réponses immunitaires sécrétoires et humorales au cours d’essais cliniques chez l’homme ont été élaborées. En revanche, la pauvreté voire l’absence de techniques fiables permettant d’évaluer l’activité tolérogène de formulations vaccinales ou la capacité d’un vaccin donné d’induire des réponses CTL, constitue un obstacle majeur au développement de vaccins anti-inflammatoires et anti-viraux. Le développement d’un plus grand nombre de vaccins muqueux requiert l’accès à des vecteurs de transport et de livraison d’antigènes et adjuvants qui permettront de stimuler et d’orienter précisément les réponses immunitaires pour obtenir l’effet désiré. Les avancées récentes dans ces deux domaines devraient faciliter le développement de nouveaux vaccins muqueux anti-infectieux et anti-inflammatoires. Ces formulations muqueuses doivent cependant être évaluées chez l’homme, chez lequel la diversité génétique mais également les différences de flore intestinale, d’habitudes alimentaires et d’histoire immunologique sont autant de mises à l’épreuve pour l’innocuité et l’efficacité de vaccins candidats. Dans ce sens, certains vaccins muqueux tels que le vaccin oral contre la polio ou les vaccins oraux contre le choléra ou le rotavirus et la fièvre typhoïde se sont avéré moins efficaces dans les pays en voie de développement que dans les pays industrialisés. |
Les auteurs remercient l’Agence Nationale de Recherches sur le Sida et les associations Sidaction et Faire face au Sida pour leur support financier. Les auteurs remercient tous les collaborateurs de l’Unité Inserm U721 et collaborateurs extérieurs pour leur contribution scientifique.
|
Footnotes |
1. Mestecky J, Lamm ME, Strober W, et al.
Mucosal immunology, 3rd ed. San Diego: Academic Press, 2005 : 1868 p. 2. Mowat AM. Anatomical basis of tolerance and immunity to intestinal antigens. Nat Rev Immunol 2003; 3 : 331–41. 3. Kelsall BL, Leon F. Involvement of intestinal dendritic cells in oral tolerance, immunity to pathogens, and inflammatory bowel disease. Immunology 2005; 6 : 132–48. 4. Akbari O, DeKruyff RH, Umetsu DT. Pulmonary dendritic cells producing IL-10 mediate tolerance induced by respiratory exposure to antigen. Nat Immunol 2001; 2 : 725–31. 5. Salmi M, Jalkanen S. Lymphocyte homing to the gut: attraction, adhesion and commitment. Immunol Rev 2001; 206 : 100–13. 6. Stagg AJ, Kamm MA, Knight SC. Intestinal dendritic cells increase T cell expression of alpha4beta7 integrin. Eur J Immunol 2002; 32 : 1445–54. 7. Mora JR, Bono MR, Manjunath N, et al. Selective imprinting of gut-homing T cells by Peyer’s patch dendritic cells. Nature 2003; 424 : 88–93. 8. Iwata M, Hirakiyama A, Eshima Y, et al. Retinoic acid imprints gut-homing specificity on T cells. Immunity 2004; 21 : 527–38. 9. Johansson-Lindbom B, Svensson M, Pabst O, et al. Functional specialization of gut CD103+ dendritic cells in the regulation of tissue-selective T cell homing. J Exp Med 2005; 202 : 1063–73. 10. Annacker O, Coombes JL, Malmstrom V, et al. Essential role for CD103 in the T cell-mediated regulation of experimental colitis. J Exp Med 2005; 202 : 1051–61. 11. Lazarus NH, Kunkel EJ, Johnston B, et al. A common mucosal chemokine (mucosae-associated epithelial chemokine/CCL28) selectively attracts IgA plasmablasts. J Immunol 2003; 170 : 3799–805. 12. Abonia JP, Hallgren J, Jones T, et al. Alpha-4 integrins and VCAM-1, but not MAdCAM-1, are essential for recruitment of mast cell progenitors to the inflamed lung. Blood 2006; 108 : 1588–94. 13. Quiding M, Nordstrom I, Kilander A, et al. Intestinal immune responses in humans. Oral cholera vaccination induces strong intestinal antibody responses, gamma-interferon production, and evokes local immunological memory. J Clin Invest 1991; 88 : 143–8. 14. Kozlowski PA, Cu-Uvin S, Neutra MR, Flanigan TP. Comparison of the oral, rectal, and vaginal immunization routes for induction of antibodies in rectal and genital tract secretions of women. Infect Immun 1997; 65 : 1387–94. 15. Johansson EL, Wassén L, Holmgren J, et al. Nasal and vaginal vaccinations have differential effects on antibody responses in vaginal and cervical secretions in humans. Infect Immun 2001; 69 : 7481–6. 16. Hornquist CE, Ekman L, Grdic KD, et al. Paradoxical IgA immunity in CD4-deficient mice. Lack of cholera toxin-specific protective immunity despite normal gut mucosal IgA differentiation. J Immunol 1995; 155 : 2877–87. 17. Goodrich ME, McGee DW. Regulation of mucosal B cell immunoglobulin secretion by intestinal epithelial cell-derived cytokines. Cytokine 1998; 10 : 948–55. 18. Kunisawa J, Kiyono H. A marvel of mucosal T cells and secretory antibodies for the creation of first lines of defense, Cell Mol Life Sci 2005; 62 : 1308–21. 19. Franco MA, Greenberg HB. Role of B cells and cytotoxic T lymphocytes in clearance of and immunity to rotavirus infection in mice. J Virol 1995; 69 : 7800–6. 20. Klavinskis LS, Bergmeier LA, Gao L, et al. Mucosal or targeted lymph node immunization of macaques with a particulate SIVp27 protein elicits virus-specific CTL in the genito-rectal mucosa and draining lymph nodes. J Immunol 1996; 157 : 2521–7. 21. Luci C, Hervouet C, Rousseau D, et al. Dendritic cell-mediated induction of cytotoxic responses following intravaginal immunization with the non-toxic B subunit of cholera toxin. J Immunol 2006; 176 : 2749–57. 22. Simmons CP, Hussell T, Sparer T, et al. Mucosal delivery of a respiratory syncytial virus CTL peptide with enterotoxin-based adjuvants elicits protective, immunopathogenic, and immunoregulatory antiviral CD8+ T cell responses. J Immunol 2001; 166 : 1106–13. 23. Ermak TH, Giannasca PJ, Nichols R, et al. Immunization of mice with urease vaccine affords protection against Helicobacter pylori infection in the absence of antibodies and is mediated by MHC class II-restricted responses. J Exp Med 1998; 188 : 2277–88. 24. Wu HY, Weiner HL. Oral tolerance. Immunol Res 2003; 28 : 265–84. 25. Stassen M, Fondel S, Bopp T, et al. Human CD25+ regulatory T cells: two subsets defined by the integrins alpha 4 beta 7 or alpha 4 beta 1 confer distinct suppressive properties upon CD4+ T helper cells. Eur J Immunol 2004; 34 : 1303–11. 26. Hanninen A, Harrison LC. Gamma delta T cells as mediators of mucosal tolerance: the autoimmune diabetes model. Immunol Rev 2000; 173 : 109–19. 27. Crispe IN Hepatic T cells and liver tolerance. Nat Rev Immunol 2003; 3 : 51–62. 28. Smith PD, Ochsenbauer-Jambor C, Smythies LE. Intestinal macrophages: unique effector cells of the innate immune system. Immunol Rev 2005; 206 : 149–59. 29. Smythies LE, Sellers M, Clements RH, et al. Human intestinal macrophages display profound inflammatory anergy despite avid phagocytic and bacteriocidal activity. J Clin Invest 2005; 115 : 66–75. 30. Anjuere F, Luci C, Lebens M, et al. In vivo adjuvant-induced mobilization and maturation of gut dendritic cells after oral administration of cholera toxin. J Immunol 2004; 173 : 5103–11. 31. Holmgren J, Czerkinsky C. Mucosal immunity and vaccines. Nat Med 2005; 11 : S45–53. 32. Holmgen J, Adamsson J, Anjuere F, et al. Mucosal adjuvants and anti-infection and anti-immunopathology vaccines based on cholera toxin, cholera toxin B subunit and CpG DNA. Immunol Lett 2005; 9 : 181–8. 33. Chaillous L, Lefevre H, Thivolet C, et al. Oral insulin administration and residual beta-cell function in recent-onset type 1 diabetes: a multicentre randomised controlled trial. Lancet 2000; 12 : 545–9. 34. Wiendl H, Hohlfeld R. Therapeutic approaches in multiple sclerosis: lessons from failed and interrupted treatment trials. BioDrugs 2002; 16 : 183–200. 35. Stanford M, Whittall T, Bergmeier LA, et al. Oral tolerization with peptide 336–351 linked to cholera toxin B subunit preventing relapses of uveitis in Behcet’s disease. Clin Exp Immunol 2004; 137 : 201–8. 36. Tacket CO, Sztein MB, Losonsky GA, et al. Humoral, mucosal, and cellular immune responses to oral Norwalk virus-like particles in volunteers. Clin Immunol 2003; 108 : 241–7. |