| |
| Med Sci (Paris). 2007 April; 23(4): 379–385. Published online 2007 April 15. doi: 10.1051/medsci/2007234379.Nouvelles voies d’administration : vaccinations par voie épidermique, intradermique, muqueuse François Denis,* Sophie Alain,* and Marie-Cécile Ploy* Laboratoire de Bactériologie-Virologie-Hygiène, EA 3175, CHU Dupuytren, 2, avenue Martin Luther King, 87042 Limoges Cedex, France |
Voie épidermique-percutanée Immunisation épidermique L’application d’antigènes directement sur la peau est susceptible d’induire une réponse immunitaire humorale. L’enjeu n’est pas négligeable car le recours à des patchs constituerait un mode d’administration simple, non douloureux et utilisable à tout âge notamment chez les nourrissons. La peau est compétente sur le plan immunologique car pourvue en cellules impliquées dans l’immunité, notamment en cellules de Langerhans et en cellules dendritiques. Dans les conditions normales, en l’absence de préparation, le stratum corneum (SC) constitue une barrière efficace à la pénétration des fluides, des molécules et des particules de grande taille, y compris les microbes. Mais l’utilisation de patchs et un traitement minimal du stratum corneum permettent le passage d’antigènes de 1 MDa [
1]. Différentes stratégies peuvent être utilisées pour favoriser cette pénétration : simple occlusion, hydratation du SC qui provoque un gonflement transitoire des kératinocytes et un mélange des liquides dans les espaces intercellulaires, qui disparaît quand la peau se dessèche. On peut aussi utiliser des crèmes exfoliantes. D’autres méthodes, abrasives, sont plus brutales : utilisation d’un ruban adhésif, frottements répétés avec de la gaze, de la toile Emery, une pierre ponce, des ultrasons, sur une peau préalablement hydratée. Des essais réalisés chez la souris ont donné des résultats encourageants [
2]. Par exemple, si l’on administre à une souris de l’anatoxine tétanique, par voie épidermique après frottement à la toile Emery (10 fois) ou à la pierre ponce (20 fois), les taux sériques d’anticorps sont voisins de ceux qui sont obtenus après injection, par voie intramusculaire, de la même dose de toxine associée à l’hydroxyde d’aluminium (adjuvant). Chez la souris, l’utilisation d’adjuvants de vaccination sous forme d’applications « topiques » (patchs) entraîne l’apparition des isotypes IgG et IgA spécifiques de l’anatoxine tétanique dans les sécrétions muqueuses de l’animal, notamment dans les sécrétions pulmonaires et les selles, et même au niveau de la muqueuse vaginale ! Il existe des patchs adjuvants (IS® Iomai Band-Aid®). La répétition des applications induit des réponses anamnestiques et permet d’obtenir des titres d’anticorps sériques plus durables et stables. Immunisation trans-cutanée (ITC) Chez l’homme, les études d’ITC en sont encore au stade préliminaire [ 1]. Une prévention contre les diarrhées à E. coli faite en immunisant simultanément avec la toxine LT (entérotoxine thermolabile) et le facteur de colonisation (CS6) montre la présence d’IgG et IgA anti-CS6 sériques respectivement chez 65 % et 53 % des sujets vaccinés et anti-LT chez 100 % et 90 % d’entre eux. Mais les paramètres assurant l’efficacité de la stratégie percutanée (préparation de la peau, durée du contact, rythme des « rappels », quantité d’antigènes, addition d’adjuvants) ne sont pas encore complètement définis. De même l’évaluation des effets indésirables, lésions papulomaculeuses, prurit, douleur, doit être complétée, même si les essais montrent globalement une bonne tolérance. |
Vaccination par voie intradermique BCG Le vaccin antituberculeux, ou vaccination par le BCG (bacille de Calmette et Guérin), est dérivé d’un isolat de Mycobacterium bovis qui a perdu sa virulence par passages successifs sur des milieux à base de pommes de terre auxquels on ajoute de la bile et de la glycérine. Deux techniques vaccinales étaient utilisées en France jusqu’à la fin de l’année 2005, le système dit par applicateur ou bague ( multipuncture) et la voie intradermique. Depuis, la production du vaccin par applicateur (bague Monovax ®) est arrêtée, et seul le vaccin administré par voie intradermique est disponible. L’injection (0,05 ml chez le nourrisson de moins de 1 an ou 0,1 ml chez les sujets plus âgés) se fait au niveau du bras avec une aiguille spéciale. La souche actuellement utilisée est le BCG SSI ® (souche Copenhague, produit par le Statens Serum Institut du Danemark). La pratique est délicate chez le nourrisson, le succès est signé par un aspect de « peau d’orange ». L’efficacité de la vaccination par le BCG a été réévaluée récemment : si la protection des enfants vis-à-vis de la méningite tuberculeuse et de la tuberculose miliaire est de l’ordre de 75 à 80 %, la protection vis-à-vis de la tuberculose de l’adulte, est, elle, très controversée (de 0 à 80 % selon les études), ce qui fait que seule l’option vaccinale du nourrisson, principale cible bénéficiant réellement de cette vaccination, est actuellement retenue. Les complications vaccinales sont locales, abcès, adénopathies, ulcérations (1 à 2 %), et il existe aussi des réactions systémiques plus graves dont les BCGites infectieuses généralisées (2 à 5 cas/million de sujets vaccinés) survenant traditionnellement chez les enfants atteints de déficits immunitaires sévères, et ces derniers, qu’ils soient d’origine congénitale ou acquis, constituent des contre-indications à la vaccination par le BCG. Les études de protéomique ont permis de mieux caractériser des antigènes candidats et d’obtenir des souches - notamment de BCG - modifiées, ou des souches recombinantes d’autres espèces de mycobactéries telles que M. microti, M. vaccae ou M. smegmatis, hyperproductrices d’antigènes de M. tuberculosis [
3–
5]. La vaccination antivariolique Elle a été interrompue depuis l’éradication de la variole en 1980 et peut être reprise en cas d’alertes bioterroristes. Dans le passé, elle a été pratiquée par scarifications ou bagues, mais actuellement, on préconise la vaccination intradermique avec recours à une aiguille bifurquée, pour les équipes de vaccinateurs volontaires qui interviennent en première ligne. Il s’agit d’un vaccin vivant, qui utilise du virus de la vaccine dérivée du Cowpox virus atténué. Deux souches sont utilisées, la souche Lister et la souche NYC BOH. La vaccination est très efficace (protection de l’ordre de 98 %) et l’immunité est conférée probablement pour des décennies. Mais le vaccin est assez mal toléré [
6] surtout lors de la primo-vaccination avec des complications loco-régionales ou générales pouvant engager le pronostic vital, vaccines progressives, vaccines généralisées et encéphalites post-vaccinales (dont l’incidence est respectivement de 0,9, 23,4 et 2,9 cas/million de primo-vaccinations) sans compter le risque d’auto-inoculation (dissémination dans des sites autres que celui de l’inoculation initiale) et de transmission à l’entourage. Dermatoses, déficits immunitaires congénitaux ou acquis (patients ayant reçu une transplantation, patients infectés par le VIH, grossesse) constituent des contre-indications. |
La voie intradermique a été utilisée pour d’autres vaccins tués ou à base d’antigènes purifiés (hors autorisation de mise sur le marché), permettant d’immuniser des patients réfractaires à une immunisation par voie intramusculaire - c’est le cas des hémodialysés qui ne répondent pas au vaccin contre l’hépatite B [
7] - et d’utiliser des quantités moindres d’antigènes [
8]. Mais la standardisation de la technique est délicate, la réponse inconstante et la durée de protection probablement inférieure à celle que confère d’autres voies. Cette voie intradermique est actuellement testée en France pour la vaccination antigrippale et anti-rabique, et pour tenter d’obtenir une meilleure immunisation anti-HBV chez les sujets infectés par le VIH. |
Vaccination par voie muqueuse Le fonctionnement du système immunitaire muqueux (MALT, mucosa-associated lymphoid tissues) a été très étudié. Le mieux connu est celui qui est associé à la muqueuse intestinale (GALT, gut-associated lymphoid tissues) et des similitudes ont été trouvées entre GALT et BALT (bronchi-associated lymphoid tissues) alors que le tractus génital présente des caractéristiques qui lui sont propres [
9]. Le mécanisme intime de la réponse muqueuse fait l’objet d’un article spécifique dans ce numéro [
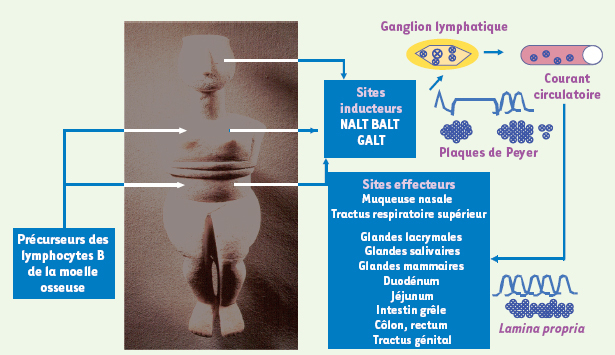
10]. Le spectre des sites effecteurs est plus large que le spectre des sites inducteurs (Figure 1). L’immunité locale est caractérisée par l’induction d’une production locale d’immunoglobulines de l’isotype A (IgA) au niveau de la muqueuse et par une réponse systémique avec production d’immunoglobulines sériques d’isotype G (IgG) susceptibles de traverser la muqueuse ; ainsi, au niveau vaginal, les IgG sont majoritaires.  | Figure 1.
Schéma hypothétique représentant le système immunitaire commun des muqueuses. Il existe un système commun des muqueuses chez l’homme, MALT (mucosa-associated lymphoid tissues), impliquant des tissus lymphoïdes de différents sites anatomiques : muqueuse nasale (anneau de Waldeyer), bronchiques, intestinaux (plaques de Peyer, lamina propria), génitaux (cellules de Langerhans), etc. Ces différentes formations lymphöides représentent le site d’induction de la réponse. Le second compartiment est formé de lymphocytes T mûrs et de plasmocytes qui, après migration hémolymphatique disséminent dans les différentes muqueuses et constituent les effecteurs de la réponse locale humorale et cellulaire. Ainsi, à partir du site inducteur situé au niveau de l’arbre digestif, tel que l’iléon, le spectre des sites effecteurs peut s’élargir, développant une immunité muqueuse allant de l’arbre respiratoire supérieur aux glandes lacrymales, salivaires, mammaires, à l’intestin grêle, au gros intestin voire au tractus génital. NALT : tissus lymphoïdes associés à la muqueuse nasale (nasal-associated lymphoïd tissue) ; BALT : tissus lymphoïdes associés aux bronches (bronchi-associated lymphoïd tissue) ; GALT : tissus lymphoïdes associés à l’intestin (gut-associated lymphoïd tissue). |
L’administration d’un vaccin par voie muqueuse nécessite un système de vectorisation assurant un ciblage optimal vers les organes lymphoïdes inducteurs de la réponse muqueuse. Deux approches sont développées, utilisant les vaccins sous-unités constitués d’antigènes protecteurs délivrés via divers systèmes de vectorisation, et les vaccins vivants de virulence atténuée [
11]. Différentes voies d’administration sont envisageables : voie orale (voire rectale) pour les agents responsables de maladies diarrhéiques ou dont la porte d’entrée est digestive, voie nasale pour les microbes responsables d’infections respiratoires, voie génitale pour les infections sexuellement transmissibles (IST). Mais, en dehors du recours à une immunisation via la voie qui peut correspondre à la porte d’entrée, on peut aussi recourir à la voie muqueuse pour induire une réponse systémique voire « multi-muqueuse » vis-à-vis de n’importe quel antigène pour prévenir une infection quelles qu’en soient la porte d’entrée ou les manifestations cliniques. |
Vaccination par voie orale Vaccins bactériens Ce sont surtout les bactéries responsables d’infections entériques - agent du choléra ( Vibrio cholerae), shigelles, agent de la fièvre typhoïde ( Salmonella typhi) - et d’infections cholériformes causées par les Escherichia coli entérotoxinogènes (ETEC), qui ont donné lieu à des recherches ciblant essentiellement trois types d’antigènes : le système d’adhérence ou d’interaction des pathogènes avec l’épithélium intestinal, les entérotoxines ou cytotoxines protéiques, les antigènes somatiques (Ag O) ou éventuellement les antigènes capsulaires (Ag K). Pour V. cholerae, plusieurs souches vivantes atténuées sont à l’étude. Le vaccin Dukoral® (SBL Vaccines AB. Stockholm) est administré per os à raison de 2 ou 3 doses. Il doit être mélangé avec du bicarbonate de sodium afin de neutraliser l’acidité gastrique qui dénature rapidement la sous-unité B de la toxine cholérique, l’un des constituants du vaccin ; il contient aussi des Vibrio cholerae 01 tués (biotype classique et El Tor des sérotypes Inaba et Ogawa). Les études conduites au Bengladesh et au Pérou ont montré une efficacité protectrice à court terme (6 mois) de 85 %, mais transitoire puisqu’elle n’est plus que de 60 % la seconde année [
12]. Différents vaccins sont à l’étude ou disponibles contre les Shigella : S. flexneri sérotype 2a (SC 602), S. dysenteriae 1 (SC 599) et sont administrés en une seule dose. Ils sont en phase 2 de développement et les résultats sont encourageants, mais ils sont spécifiques de sérotype. Contre Salmonella enterica, serovar Typhi, un vaccin vivant oral de virulence atténuée a été développé. La souche Ty 21 (Vivotil®) confère une protection dont l’importance varie selon les études. Les résultats utilisant des souches portant des délétions dans des gènes codant pour des facteurs essentiels à la survie intratissulaire de la bactérie sont satisfaisants en termes de tolérance et d’immunogénicité. Pour prévenir les infections à E. coli (ETEC), un vaccin oral proche de celui qui a été développé contre le choléra a été fabriqué : il associe des bactéries tuées et la sous-unité B de V. cholerae (CTB), et la protection est de l’ordre de 50 % à 67 % [
13]. Une immunisation par voie orale avec une souche vivante de Chlamydia trachomatis a induit une réponse de type IgA au niveau des tractus génital, respiratoire et digestif ; un rappel local au niveau de la muqueuse génitale induit une meilleure réponse qu’un rappel administré par voie orale [12]. Des pistes novatrices sont explorées : par exemple, l’induction d’une immunisation avec des aliments transgéniques (bananes par exemple) qui, exprimant des antigènes d’intérêt vaccinal, que ceux-ci concernent ou non la prévention d’infections entériques, induisent des réponses immunes protectrices chez l’homme. Vaccins viraux Le vaccin poliomyélitique oral (VPO) Il a été conçu par Sabin et la formulation arrêtée six ans après le développement du vaccin injectable (VPI) par Salk en 1955. Le vaccin oral contient des souches atténuées appartenant aux trois sérotypes (souches Sabin 1, 2 et 3). L’atténuation des souches reflète leur capacité réduite d’atteindre ou de proliférer dans le système nerveux central de l’homme alors même que leur capacité de proliférer dans l’intestin est intacte. L’administration du vaccin se fait par voie orale, et induit une immunité muqueuse probablement de durée limitée et, facteur essentiel, une immunité humorale bloquant la virémie. Cela empêche, en cas d’infection des sujets vaccinés par une souche sauvage neurovirulente que celle-ci n’atteigne les tissus nerveux. Le calendrier vaccinal de l’OMS recommande un schéma en 4 doses de VPO pour les pays en voie de développement avec administration à la naissance puis à 6, 10 et 14 mois. Ce schéma résulte en un pourcentage élevé de sujets immunisés contre les sérotypes 1 (88-98 %), 2 (97-100 %) et 3 (72-100 %) dans trois pays (Gambie, Oman, Thaïlande) [
14]. Le VPO, outil privilégié par l’OMS pour éradiquer la poliomyélite, mais qui n’est plus disponible en France, présente des avantages et des inconvénients par rapport au VPI (Tableau I).  | Tableau I.
Principaux avantages et inconvénients des vaccins antipoliomyélitiques (adapté de [ 14]). |
Le dernier cas autochtone de poliomyélite a été observé en France en 1990. L’éradication de la poliomyélite grâce au recours aux deux types de vaccins (VPI et VPO) semblait à portée de main, mais une récente flambée, ayant comme point de départ le Nigéria, est à l’origine d’une reprise de l’infection dans une dizaine de pays sur plusieurs continents. Les vaccins rotavirus [
15,
16] Les rotavirus présentent une grande diversité antigénique. Les souches humaines (HRV) appartiennent essentiellement au groupe A et sont désignées notamment par leurs antigènes G et P. Les anticorps neutralisants sont essentiellement dirigés contre l’antigène G. Beaucoup de combinaisons sont possibles du fait de réassortiments génétiques favorisés par le caractère segmenté de l’ARN. Les souches les plus répandues étant G1P [ 16], G2P [
4], G3 [P8] et G4P [ 16] ; les types G1 à G4 regroupent plus de 90 % des souches circulant dans les pays développés. Tous les vaccins développés sont vivants, atténués, et administrés par voie orale. Le Rotashield® (Wyeth) contenait une souche simienne (G3) et trois souches recombinantes entre ce virus et des souches humaines (G1, G2 ou G4). Il avait été autorisé aux États-Unis, puis retiré du fait d’une augmentation du risque d’invagination intestinale. Deux autres vaccins plus récents ont été développés : le Rotateq® (Merck) est un vaccin pentavalent (3 doses) fait de souches recombinantes humaines - bovines (WC3) exprimant les types G1, G2, G3 et G4 et le type P [16]. Le Rotarix® (GlaxoSmithKline, GSK) est un vaccin monovalent (2 doses) dérivé d’une souche humaine G1P [16] atténuée par passages successifs sur des cultures cellulaires. Ce vaccin induirait une immunité protectrice croisée vis-à-vis des autres types. Les études de phase 3 de ces deux derniers vaccins portent sur plus de 60 000 enfants âgés de 2 à 4 mois, et montrent une protection de l’ordre de 75-85 % vis-à-vis de toutes les diarrhées à rotavirus. La protection atteint 98-100 % pour la prévention des infections sévères, sans risque accru d’invagination intestinale. Ces deux vaccins sont sur le point d’être commercialisés. La vaccination, administrée selon le vaccin en 2 ou 3 prises orales avant l’âge de 6 mois, protège le nourrisson, sans rappel, pour toute la tranche d’âge à risque (< 5 ans). Coronavirus Le virus du syndrome respiratoire aigu (SRAS) étant transmis par inhalation ou sur le mode fécal-oral, l’obtention d’une immunité muqueuse (et systémique) est très intéressante. Récemment, l’administration orale et nasale d’une souche bactérienne de Lactobacillus casei recombinante [
17] produisant des segments de la protéine S d’une souche de SRAS-CoV a induit une réponse sérique de type IgG et muqueuse de type IgA (anticorps neutralisants) dirigée contre les peptides S. Des essais chez l’homme sont envisagés. |
Vaccin coqueluche Des essais très récents utilisant une souche de Bordetella pertussis génétiquement atténuée ont montré son efficacité dans un modèle animal, après administration, en une seule dose, par voie intranasale [
18,
19]. Vaccin influenza [
20–
22] La vaccination avec des souches de virus grippal vivantes nécessite une atténuation de la virulence, obtenue par exemple en cultivant les souches à basse température, 25-26°C au lieu de 37 °C pendant des dizaines de passages successifs afin d’obtenir des souches dites cold-adapted (Ca). Cela a pour effet de réduire leur réplication par rapport à celle des souches initiales. Les souches vaccinales sont ensuite réalisées en cocultivant les souches Ca atténuées et des souches grippales virulentes. La souche vaccinale garde 6 des 8 gènes de la souche Ca et intègre 2 gènes de la souche sauvage en l’occurrence ceux qui codent pour l’hémagglutinine (H ou HA) et la neuraminidase (N ou NA). Le vaccin trivalent dit live-cold adapted (CAIV-T) contient trois souches A/H1 N1, A/H3 N2 et B ; la formule en est adaptée annuellement. L’administration se fait par voie intranasale à raison de 0,25 ml dans chaque narine. Ce vaccin entraîne une augmentation du taux des anticorps sériques d’isotypes IgM et IgA deux semaines après la vaccination, taux qui décline ensuite après 4 semaines, alors que le pic des IgG se situe entre les 4e et 12e semaines post-vaccination ; ces anticorps persisteraient au moins 1 an. Il existe aussi une production nasale d’IgA, maximale entre 2 et 11 semaines après l’administration du vaccin, et déclinant au-delà de 6 mois. Ces isotypes IgA peuvent persister chez l’enfant durant 1 an. La synthèse d’anticorps muqueux est considérée comme un meilleur indicateur que les anticorps sériques de l’immunogénicité du vaccin atténué et de la protection qu’il confère [20]. Plusieurs travaux ont comparé l’efficacité de vaccins vivants atténués administrés par voie nasale (CAIV) et de vaccins tués (TIV) en administrant chez les adultes volontaires des souches sauvages H1N1 et H3N2 [
21]. Les deux vaccins stimulent différemment le système immunitaire avec une efficacité assez voisine qui serait toutefois en faveur du CAIV par rapport au TIV (efficacité 85 % versus 71 %), mais tous deux révèlent une immunogénicité et une efficacité réduites chez les sujets âgés [20]. Virus respiratoire syncitial [ 22] Différentes approches vaccinales actuellement testées dans des essais cliniques de phase 3 utilisent des fractions antigéniques (protéines F et G) administrées par voie parentérale. La voie muqueuse utilisant un vaccin vivant atténué est apparue logique. Divers mutants ont été testés : mutants thermosensibles cpts (cold passaged temperature sensitive), souches génétiquement modifiées avec incorporation des protéines F et G, souches chimériques humaines/bovines. Ces approches sont conceptuellement intéressantes, la vaccination mimant l’infection, mais les essais sont actuellement décevants et ces vaccins ne sont pas exempts d’effets secondaires. Vaccin rougeole-oreillons-rubéole L’administration sous forme d’aérosols de vaccins vivants atténués initialement destinés à être utilisés par voie intramusculaire donne des résultats très encourageants. L’évaluation du taux des anticorps après l’administration chez des adultes du vaccin rougeole-oreillons-rubéole par ces deux voies montre que les aérosols induisent des titres d’anticorps sériques plus élevés que l’administration parentérale pour les trois valences (rougeole-oreillons-rubéole). Mais les infections respiratoires dues à d’autres germes sont susceptibles d’entraver la réponse. Des dizaines de tentatives de vaccination contre la rougeole par différentes voies [
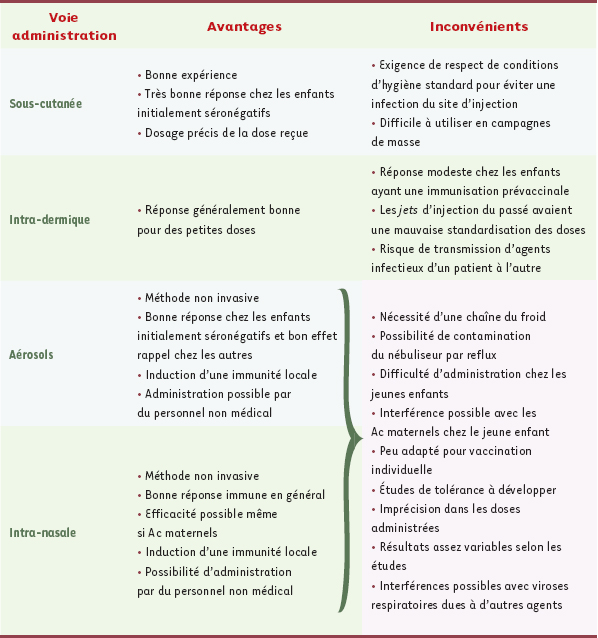
23] ont permis de cerner les avantages et les inconvénients des voies muqueuse, nasale, et par aérosols comparativement aux voies sous-cutanée et intradermique (Tableau II).
 | Tableau II.
Avantages et inconvénients des différentes voies d’administration : exemple du vaccin atténué rougeole (adapté de [
28]). |
Virus du Sida La voie nasale, seule ou combinée à la voie orale, a été utilisée pour immuniser et protéger des primates non humains contre des virus apparentés au VIH (SIV mac 251, S HIV 89.6 P). L’administration de virus recombinants poliovirus 1-SIV ou de particules SIV p55 (avec de la toxine cholérique CT) entraîne une réponse sérique (IgG) voire rectale et vaginale (IgA) (pour revue, voir [
24]). |
Cette voie peut être appropriée pour immuniser contre des agents entéropathogènes tels que les rotavirus. Alors que des pseudoparticules virales (virus like particles) de rotavirus administrées par voie orale à des souris BALBc n’induisent pas de protection, le recours à la voie rectale et à des adjuvants (toxine cholérique CT ou d’E. coli LT) entraîne une réponse spécifique et protectrice de type IgA dans les selles, la salive et le sérum, et de type IgG dans le sérum [
25]. Des vaccinations intrarectales utilisant des souches atténuées ou des antigènes de poliovirus, des peptides VIH/VIS, ou encore des virus grippaux, ont induit des réponses spécifiques locales (intestin) et dans d’autres sites partageant une immunité muqueuse commune [24,
26,
27]. En conclusion, la voie muqueuse apparaît très prometteuse, mais nécessite, comme la voie cutanée, le recours à des adjuvants afin d’optimiser la réponse. Toutefois, des facteurs limitants spécifiques à la voie muqueuse pourraient émerger, comme des phénomènes de tolérance (tolérance muqueuse), ou l’induction de phénomènes d’auto-immunité se traduisant par des maladies inflammatoires de l’appareil digestif [26, 27], sans compter les risques encourus par les patients immunodéprimés s’ils utilisent des souches vivantes même atténuées par voie muqueuse. |
Le choix des modalités vaccinales est complexe et les résultats peuvent être influencés par de nombreux facteurs : outre la nature des antigènes, il peut s’agir de la dose, du type d’adjuvant, des délais entre l’administration du vaccin et l’évaluation de son efficacité. Jusqu’à ce jour, à de rares exceptions près, les vaccins étaient surtout administrés par voie sous-cutanée ou intramusculaire. L’avantage de ces voies tient à un contrôle de la dose injectée, et à un dépôt de l’antigène, libéré progressivement en stimulant le système immunitaire de manière adéquate, mais en induisant surtout une réponse systémique. La voie intradermique ne permet pas un strict contrôle de la dose administrée. Quant aux voies non invasives, qu’il s’agisse des technologies transcutanées et des administrations muqueuses, elles ont pour elles leur simplicité. La voie épidermique ou transcutanée est prometteuse et peut révolutionner la vaccination de masse [28]. La voie muqueuse est connue depuis des décennies et a déjà été utilisée très largement (vaccination par voie orale contre le poliovirus). Certains vaccins utilisables par cette voie sont disponibles et prometteurs (grippe, rotavirus), d’autres plus limités (typhoïde, choléra) et beaucoup d’autres en développement ciblant la prévention d’infections microbiennes respiratoires, digestives voire sexuellement transmissibles. Ces vaccins d’utilisation simple peuvent conférer une protection locale, muqueuse et systémique. Les « vaccins-aliments » constituent aussi une perspective de vaccination combinant nutrition et immunisation. Il est essentiel de poursuivre l’effort vaccinal tant dans les pays riches que dans les pays en développement en facilitant l’accessibilité aux vaccins, et en simplifiant leur administration en utilisant notamment la voie muqueuse, particulièrement dans le domaine des infections respiratoires et des maladies diarrhéiques. Chaque année, plusieurs milliards d’épisodes diarrhéiques causent plus de cinq millions de décès [
29] et plus de 95 % de ces infections surviennent dans les pays en voie de développement. |
Footnotes |
1. Glenn GM, Kenney RT, Ellingsworth LR, et al. Transcutaneous immunization and immunostimulant strategies: capitalizing on the immunocompetence of the skin. Expert Rev Vaccines 2003; 2 : 253–67. 2. Glenn GM, Rao M, Matyas GR, Alving CR. Skin immunization made possible by cholera toxin. Nature 1998; 391 : 851–3. 3. Doherty TM, Andersen P. Vaccines for tuberculosis: novel concept and recent progress. Clin Microbiol Rev 2005; 18 : 687–702. 4. Fine PEM, Rodrigues LC. Mycobacterial diseases. In : Moxon ER, ed. Modern vaccines : current practice and new approaches. A Lancet review. London : Edward Arnold, 1990 : 67–74. 5. Girard MP, Fruth V, Kieny MP. A review of vaccine research and development: tuberculosis. Vaccine 2005; 23 : 5725–31. 6. Henderson DA, Borio LL, Lane JM. Smallpox and vaccinia. In : Plotkin SA. Orenstein WA, eds. Vaccines, 4th ed. Philadelphia : Saunders, 2004 : 123–53. 7. Poux JM, Ranger-Rogez S, Lagarde C, et al. Vaccination contre l’hépatite B : intérêt de l’administration intradermique chez les dialysés non-répondeurs par voie intramusculaire. Presse Med 1995; 34 : 803–6. 8. Grosheide PM, Heijtink RA, De Knegt RJ, Schalm SW. Low dose hepatitis B vaccination in medical students: experience with the intradermal versus intramuscular route, and plasma versus recombinant vaccines. In : Coursaget P, Tong MJ, eds. Progress in hepatitis B immunization. Colloque Inserm, vol. 194. Paris : Inserm-John Libbey Eurotext, 1990 : 258. 9. Denis F, Cogne M, Belec L. Femme enceinte et défense immunitaire antivirale. In : Denis F, ed. Les virus transmissibles de la mère à l’enfant. Paris : John Libbey Eurotext, 1999 : 24–56. 10. Anjuère F, Czerkinsky C. Vaccination préventive et approches innovantesImmunité muqueuse et vaccination. Med Sci (Paris) 2007; 23 : 371–8. 11. Phalipon A, Sansonetti P. La vaccination muqueuse cherche sa place parmi les nouvelles stratégies vaccinales. Med Sci (Paris) 2000; 16 : 905–11. 12. Cui ZD, Tristram D, La Scolea LJ, et al. Induction of antibody response to Chlamydia trachomatis in the genital tract by oral immunization. Infect Immun 1991; 59 : 1465–9. 13. Hill DR, Ford L, Lalloo DG. Oral cholera vaccines: use in clinical practice. Lancet 2006; 6 : 361–73. 14. Delpeyroux F, Crainic R. L’éradication de la poliomyélite : un défi à l’aube du XXIe siècle. Virologie 1998; 2 (n° spécial) : 30–41. 15. Desselberger V. Vaccins antirotavirus : développements et perspectives. Virologie 2005; 9 : 177–80. 16. Pothier P, Agnello D. Les rotavirus et leur prévention. Spectra Biologie 2006; n° 150 : 23–7. 17. Lee JS, Poo H, Han DP, et al. Mucosal immunization with surface-displayed severe acute respiratory syndrome coronavirus spike proteins on Lactobacillus casei induces neutralizing antibodies in mice. J Virol 2006; 80 : 4079–87. 18. Locht C. Live attenuated B. pertussis as a single-dose nasal vaccine against whooping cough. Plos Pathogens 2006; 2 : 7. 19. Guiso N. Impact de la vaccination sur l’épidémiologie des maladies infectieuses : exemple de la coqueluche. Med Sci (Paris) 2007; 23 : 399–403. 20. Belshe RB, Gruber WC, Mendelman PM, et al. Correlates of immune protection induced by live, attenuated, cold-adapted, trivalent intranasal influenza virus vaccine. J Infect Dis 2000; 181 : 1133–7. 21. Belshe RB, Maassab HF, Mendelman PM. Influenza vaccine-live. In : Plotkin SA, Orenstein WA, eds. Vaccines, 4th ed. Philadelphia : Saunders, 2004 : 371–88. 22. Denis F, Alain S, Hantz S, Lagrange P. Vaccination antivirale et immunité muqueuse respiratoire : un concept séduisant pour des résultats encore décevants. Presse Med 2005; 34 : 1245–53. 23. De Castro JF, Bennett JV, Rincon HG, et al. Evaluation of immunogenicity and side effects of triple viral vaccine (MMR) in adults, given by two routes: subcutaneous and respiratory (aerosol). Vaccine 2005; 23 : 1079–84. 24. Neutra MR, Kozlowski PA. Mucosal vaccines: the promise and the challenge. Nat Rev Immunol 2006; 6 : 148–58. 25. Parez N, Fourgeux C, Mohamed A, et al. Rectal immunization with rotavirus virus-like particles induces systemic and mucosal humoral immune responses and protects mice against rotavirus infection. J Virol 2006; 80 : 1752–61. 26. Ogra PL, Faden H, Welliver RC. Vaccination strategies for mucosal immune responses. Clin Microbiol Rev 2001; 14 : 430–45. 27. Ogra PL, Fishaut M, Gallagher MR. Viral vaccination via the mucosal routes. Rev Infect Dis 1980; 2 : 352–69. 28. Glenn GM, Kenney RT. Mass vaccination: solutions in the skin. In : Plotkin SA, ed. Mass vaccination: global aspects-progressand obstacles. Berlin-Heidelberg : Springer-Verlag, 2006 : 247–68. 29. World Health Reports. Fifty facts from the world health report 1998 : global health situation and trends. Geneva, Switzerland : World Health Organization, 1998 : 1955–2025. |