| |
| Med Sci (Paris). 2007 April; 23(4): 399–403. Published online 2007 April 15. doi: 10.1051/medsci/2007234399.Impact de la vaccination sur l’épidémiologie des maladies infectieuses : exemple de la coqueluche Nicole Guiso* Unité de Prévention et Thérapies des Maladies Humaines, FRE CNRS 2849, Centre National de Référence de la coqueluche et autres Bordetelloses, Institut Pasteur, 25, rue du Docteur Roux, 75724 Paris Cedex 15, France |
Une dizaine de vaccins sont maintenant utilisés depuis plusieurs décennies en routine dans les pays développés. Leur principal impact a été de réduire considérablement la mortalité et la morbidité dues aux maladies infectieuses qu’ils ciblent. Des millions de vies humaines ont ainsi été sauvées. La variole a été éradiquée, la poliomyélite est en cours d’éradication, la diphtérie est contrôlée dans de nombreux pays mais la coqueluche est toujours endémique, malgré un vaccin très efficace. Pourquoi ? La coqueluche est l’exemple d’une maladie infectieuse bactérienne pour laquelle l’immunité de la population a changé après l’introduction de la vaccination généralisée pour les nourrissons et les jeunes enfants. Il y a eu passage d’une immunité attribuable seulement à l’infection avec rappels naturels tout au long de la vie à une immunité attribuable pendant plusieurs décennies à un certain type de vaccin. Ces différents types d’immunité ont des conséquences importantes sur la protection vis-à-vis de l’infection, les caractéristiques cliniques de la maladie, et sa transmission. Dans les populations vaccinées, une transmission des adultes-adolescents vers les nouveau-nés est observée alors qu’une transmission d’enfants à enfants est observée dans les populations non vaccinées. Ce changement est principalement dû à l’immunité post-vaccinale qui diminue (tout comme l’immunité post-infectieuse) au cours du temps, et à une absence de rappel naturel ou vaccinal chez les adolescents et chez les adultes anciennement vaccinés ou infectés. Pour cette raison, et grâce à la mise au point de nouveaux vaccins anti-coquelucheux sous-unitaires mieux tolérés, des rappels vaccinaux ont été récemment introduits pour l’adolescent et l’adulte. L’utilisation de la vaccination pour protéger l’homme des maladies infectieuses a déjà une longue histoire mais ce n’est qu’au XXe siècle qu’elle a été utilisée en routine. Les vaccins utilisés depuis plusieurs décennies ciblent la variole, le tétanos, la diphtérie, la poliomyélite, la coqueluche, la tuberculose, la fièvre jaune, la rougeole, les oreillons et la rubéole. Plus récemment, d’autres vaccins ont été développés et peuvent maintenant être utilisés en routine : c’est le cas des vaccins contre la méningite à Haemophilus influenzae b, les hépatites A et B, les gastroentérites à rotavirus, les infections à pneumocoques et à méningocoques, la varicelle. Depuis l’introduction de ces vaccins, la mortalité et la morbidité dues à ces maladies ont considérablement diminué. Cependant, seule la variole a été éradiquée, certaines maladies sont contrôlées, mais d’autres sont toujours endémiques malgré l’utilisation de vaccins efficaces. La variabilité de ces résultats est due à la maladie elle-même (ses caractéristiques cliniques facilement ou difficilement reconnaissables, son degré de transmission plus ou moins important, par exemple), au type de vaccin utilisé, à son efficacité plus ou moins élevée, au type et à la durée de l’immunité infectieuse ou vaccinale qu’il induit, à sa tolérance, à la stratégie vaccinale utilisée, à la couverture vaccinale obtenue, à la capacité du germe responsable de la maladie à échapper à l’immunité vaccinale, à la population humaine elle-même (caractéristiques génétiques, densité…). Tous ces paramètres n’ont commencé à être analysés que relativement récemment puisque les vaccins ne sont utilisés de façon intensive que depuis quelques décennies. La variole a été la première maladie, et est à ce jour la seule, à être éradiquée. C’est dés 1959 que l’Organisation Mondiale de la Santé (OMS) a indiqué que la variole pourrait être éradiquée dans une région endémique si « l’on vaccinait ou revaccinait 80 % de la population dans une période de 4 à 5 ans ». Cette phrase sous-entendait déjà, comme le souligne Paul Fine [
1], qu’il était important que la communauté acquière une certaine immunité, et que cette immunité pouvait diminuer au cours du temps (vaccination ou revaccination). La notion d’immunité de « troupeau » (herd immunity) apparaît clairement. Les maladies pour lesquelles existe une prévention vaccinale et dont l’éradication pourrait être possible dans les prochaines décennies sont la poliomyélite et la rougeole. Dans le cas de la poliomyélite, le type de vaccin et la stratégie vaccinale sont au cœur des discussions. Deux vaccins sont utilisés dans le monde et leurs caractéristiques, tout comme leur coût, varient : (1) un vaccin vivant qui protège contre l’infection de façon durable ; mais si les virus qu’il contient ont une virulence atténuée, celle-ci peut redevenir élevée dans certaines conditions et donc causer la maladie dans des populations où la couverture vaccinale est trop faible (c’est-à-dire qui sont faiblement immunes) ; (2) un vaccin composé de virus tués, qui protège contre la maladie, mais avec une durée limitée, ce qui nécessite donc de revacciner la population. Dans le cas de la rougeole, maladie très contagieuse, il est indispensable que l’immunité de la population soit très élevée et donc que la couverture vaccinale soit très élevée. Ce niveau élevé, donc très coûteux, pourra-t-il être atteint ? Parmi les autres maladies contre lesquelles une prévention vaccinale est possible et dans les pays où l’utilisation du vaccin est importante, certaines sont contrôlées, comme la diphtérie ; en revanche, la coqueluche, contre laquelle un vaccin a été mis au point quelques années après l’isolement de son agent causal [
2], demeure toujours endémique, malgré l’utilisation d’un vaccin efficace. Les raisons de cette situation impliquent la contagiosité élevée de la maladie, la durée de l’immunité infectieuse ou vaccinale, l’absence de corrélat entre immunité et protection, le type de vaccin, la stratégie vaccinale et l’évolution du germe. L’ensemble de ces raisons est analysé dans cet article. |
Les caractéristiques de la coqueluche La coqueluche, qui touche en majorité les enfants dans les populations non vaccinées, a été responsable d’une mortalité et d’une morbidité très élevées avant l’introduction de la vaccination. Cette maladie est récente puisqu’elle n’a été décrite pour la première fois qu’en 1578 par Guillaume de Baillou lors d’une épidémie à Paris [
3]. Cette apparition récente serait due à une adaptation à l’homme d’une bactérie responsable d’infections respiratoires chez un grand nombre de mammifères [
4,
5]. La contamination se fait principalement par voie respiratoire, au contact d’un sujet malade qui tousse. Cependant, des porteurs asymptomatiques ont été décrits [5,
6]. Dans les populations qui ne sont pas vaccinées, la maladie est typique et comprend quatre phases : une phase silencieuse d’une dizaine de jours ; une phase catarrhale d’une dizaine de jours aussi, pendant laquelle la bactérie se multiplie (le sujet est alors très contagieux) et qui se caractérise par une simple toux avec rhinorrhée ; une phase d’état, pouvant durer plusieurs semaines, sans fièvre, pendant laquelle la toux va se transformer pour devenir insistante et survenir par quintes, plus souvent nocturnes, qui empêchent une reprise inspiratoire efficace (d’où le nom de chant du coq ou coqueluche, en France), entraînant une congestion du visage, voire une cyanose et des complications mécaniques, par exemple des vomissements, des fractures de côtes, une incontinence urinaire. Enfin, la phase de convalescence au cours de laquelle les quintes diminuent puis disparaissent, peut aussi durer plusieurs semaines [
7]. Chez le nourrisson, la maladie peut être dramatique voire mortelle. Les quintes peuvent être asphyxiantes, des apnées ou des bradycardies profondes peuvent être observées. Les vomissements peuvent compromettre l’alimentation et entraîner une déshydratation ou une dénutrition. Une étude rétrospective française, analysant les années 1999-2000, place la coqueluche au premier rang des causes de décès par infection bactérienne chez des enfants âgés de 10 jours à 2 mois [
8]. Chez l’adolescent et l’adulte anciennement vaccinés, la coqueluche peut être typique mais aussi atypique voire asymptomatique [6, 7]. Tout va dépendre de l’immunité résiduelle du sujet (immunité résiduelle post-vaccinale ou post-maladie). Au vu des conclusions de plusieurs études réalisées en France [
9] et en Europe ou Amérique du Nord [
10], la coqueluche est considérée comme l’une des étiologies possibles des toux chroniques. Cependant, du fait de la vaccination, les formes atypiques sont devenues les plus fréquentes et touchent les grands enfants, adolescents et adultes. Ces formes cliniques passent souvent inaperçues et contribuent à la contamination des jeunes nourrissons non vaccinés. Il devient nécessaire d’évoquer au plus tôt le diagnostic de coqueluche, devant les deux critères que sont : l’existence d’une toux surtout nocturne qui ne s’améliore pas au bout de 8 jours, et la notion de contage dans l’entourage en tenant compte de la longueur de la durée d’incubation, c’est-à-dire 10 à 15 jours. Il est alors nécessaire de confirmer le diagnostic biologiquement et de prévenir la transmission bactérienne en prescrivant une antibiothérapie adaptée (macrolides ou cotrimoxazole en cas de contre-indication ou d’intolérance aux premiers) aux personnes ayant été en contact avec le patient [
11]. |
L’agent causal de la coqueluche L’agent causal est une bactérie appelée Bordetella pertussis car isolée en 1906 par Bordet et Gengou après la mise au point d’un milieu spécifique à base d’amidon et de sang de cheval [
12]. Cette bactérie, centenaire, pathogène uniquement pour l’homme, est particulièrement difficile à isoler et cultiver. La coqueluche est en fait due à l’expression par la bactérie de nombreux facteurs de virulence, classés en adhésines et toxines [5,
13]. Depuis des dizaines d’années, de nombreuses recherches ont été entreprises afin de mieux caractériser les propriétés de ces facteurs. Les adhésines facilitent l’adhérence de la bactérie aux cellules de l’hôte (aussi bien épithéliales que phagocytaires) et comportent l’hémagglutinine filamenteuse ou FHA, les protéines fimbriales ou FIM, la pertactine ou PRN, le domaine B de la toxine de pertussis, et quelques autres protéines appelées auto-transporteurs. Outre cette abondance d’adhésines, B. pertussis exprime aussi plusieurs toxines. Tout d’abord une toxine cytotrachéale ou TCT, qui va détruire l’épithélium respiratoire cilié. Durant cette phase de destruction, les bactéries se multiplient et sécrètent d’autres toxines comme la toxine de pertussis ou PT et l’adényl cyclase-hémolysine ou AC-Hly, qui vont protéger les bactéries des défenses immunitaires de l’hôte. Les caractéristiques de ces protéines ont mis en exergue leur synergie d’action. En effet, le domaine B de la PT et les FIM, en se liant aux leucocytes, activeraient l’intégrine CR3 (CD11b/CD18 ou αMβ2) sur laquelle se fixerait la FHA. La FHA, quant à elle, ne pourrait être une adhésine efficace sans interagir avec la PRN et l’AC-Hly. La PT agirait de concert avec l’AC-Hly pour déclencher la réaction inflammatoire pendant que la TCT détruirait les cellules trachéales ciliées. La FHA et l’AC-Hly coopèrent pour inactiver les défenses des neutrophiles. |
Deux types de vaccins coquelucheux étaient disponibles en France ; des vaccins coquelucheux à germes entiers (ou Ce) composés de suspensions bactériennes inactivées par la chaleur, et des vaccins coquelucheux sous-unitaires ou acellulaires pour l’enfant (ou Ca), composés de protéines bactériennes purifiées et inactivées, et sous-unitaires pour l’adulte (ou ca) contenant les mêmes antigènes que les vaccins pour l’enfant mais à des doses plus faibles (pour ne pas augmenter les effets secondaires résultant de multiples revaccinations) [2,
14]. Les vaccins Ce ont été utilisés en routine pendant plus de 50 ans dans certains pays. Ils peuvent s’avérer très efficaces et la France en est un très bon exemple. Mais d’une part, leur fabrication est difficile de façon reproductible, d’autre part, ils sont mal tolérés, empêchant leur emploi de façon répétée. La mauvaise tolérance de ces vaccins a conduit au développement des recherches sur les protéines bactériennes responsables de la pathogénicité de B. pertussis et au développement des vaccins Ca. Ces vaccins Ca se sont montré, au cours de différents essais vaccinaux, efficaces et mieux tolérés par les nourrissons [14]. Les deux objectifs ayant été atteints, les vaccins Ca ont été très rapidement mis sur le marché et utilisés par plusieurs pays industrialisés dont la couverture vaccinale était nulle ou très faible depuis plusieurs années, souvent par refus d’utilisation du vaccin Ce. Depuis 2005, la plupart des pays développés qui utilisaient un vaccin Ce en routine l’ont aussi abandonné au profit des vaccins Ca [2, 14]. Depuis quelques mois ces vaccins Ce ne sont plus disponibles en France. Les vaccins Ca comprennent soit de la PT et de la FHA, soit de la PT, de la FHA et de la PRN soit de la PT, de la FHA et des FIM. |
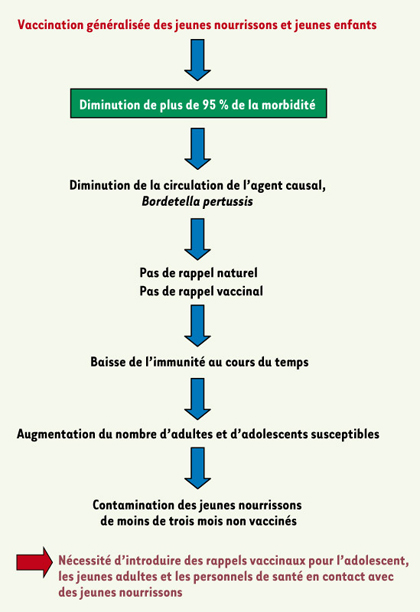
L’épidémiologie de la coqueluche avant et après l’introduction de la vaccination généralisée Au niveau de la population humaine Dans les populations qui ne sont pas vaccinées, l’incidence de la coqueluche est très élevée, tout comme la circulation de la bactérie. Les enfants contractent généralement la maladie quand ils se trouvent en collectivité vers 5-6 ans et les adultes, qui ont des contacts réguliers avec la bactérie tout au long de leur vie, ont des rappels que l’on appelle naturels et sont le plus souvent immuns. Lorsque le vaccin Ce était utilisé en routine, le calendrier vaccinal comportait généralement une primo-vaccination entre 3 et 6 mois, et dans certains pays un rappel au bout de 18-24 mois. Rapidement après l’introduction de la vaccination, l’on a observé une très forte diminution de la morbidité et de la mortalité et les enfants entre 2 et 8-10 ans étaient protégés car vaccinés. En France, par exemple, la déclaration obligatoire a été arrêtée en 1987, la maladie n’a plus été enseignée et les diagnostics biologiques oubliés. Mais, dès les années 1990, l’on observait une augmentation du nombre de nouveau-nés hospitalisés pour coqueluche, souvent après leur contamination par un adulte ou un adolescent [
15,
16]. Il s’est avéré que la principale cause de ce changement de transmission de la maladie est la baisse de l’immunité vaccinale de la population au cours du temps. Cette baisse de l’immunité, 20 ans après l’introduction de la vaccination, est due à la diminution de la circulation de la bactérie et donc à une absence de rappels naturels chez les adolescents et les adultes ayant été vaccinés dans l’enfance. L’absence de rappels vaccinaux, en raison du coût, mais aussi de la mauvaise tolérance du vaccin Ce, y contribue également. De plus, contrairement au dogme, l’immunité infectieuse est de courte durée et il est possible de développer la maladie plusieurs fois dans sa vie [ 10] (Figure 1).  | Figure 1.
Impact de la vaccination coquelucheuse généralisée des nourrissons et jeunes enfants.
|
La France a été le premier pays à introduire un rappel de vaccination pour l’adolescent âgé de 11-13 ans grâce à la mise sur le marché des vaccins Ca en 1998. Dès 1996, l’Institut de veille sanitaire a mis en place un réseau de surveillance, le réseau RENACOQ, incluant 43 centres hospitaliers répartis dans toute la France, et le Centre National de Référence de la Coqueluche et autres Bordetelloses [16]. Une enquête menée en 1999-2000 en région parisienne montre que l’incidence estimée de la coqueluche chez des adultes toussant depuis plus de 7 jours et moins de 31 jours, sans qu’une cause évidente ait été décelée, est entre 507 et 880 pour 100 000 [9]. Enfin, des infections nosocomiales dues soit à la contamination de patients par du personnel soignant infecté, soit à la contamination de personnel soignant par des nouveau-nés infectés sont observées [
17–
19]. Un rappel vaccinal a été ensuite introduit en 2004 pour les jeunes adultes en âge d’avoir des enfants et pour le personnel de santé grâce à la mise sur le marché de vaccins Ca pour l’adulte [
20,
21]. L’épidémiologie de la coqueluche varie suivant les pays car les calendriers vaccinaux, les couvertures vaccinales, les vaccins utilisés, les méthodes de surveillance sont différents, ce qui rend très difficile toute généralisation. Cependant, les pays ayant eu une couverture élevée avec un vaccin efficace ont une épidémiologie semblable et ont, ou vont, comme la France, ajouter un rappel vaccinal à leur calendrier pour la tranche d’âge 11-15 ans avec un vaccin Ca, et une vaccination adulte. D’autres pays ont ajouté un rappel vaccinal à 5-7 ans, soit parce qu’ils n’avaient pas de rappel à 16-18 mois soit dans l’optique d’un rattrapage si le vaccin Ce utilisé n’était pas aussi efficace que d’autres. En 2007, dans plusieurs pays européens, en Australie et en Amérique du Nord, les vaccins utilisés en primo-vaccination sont des vaccins Ca. Les vaccins Ce restent, cependant, encore utilisés dans un grand nombre de pays. L’épidémiologie et les priorités de santé varient donc dans le monde, mais il est souhaitable que la couverture soit la plus élevée possible pour les nourrissons et les enfants et que la vaccination soit étendue aux adolescents et adultes. Au niveau de la bactérie La dernière préoccupation est l’éventuelle modification de la bactérie qu’entraîneraient les changements de l’immunité de la population humaine sous l’influence de la vaccination généralisée. L’analyse et la comparaison des isolats bactériens ont été réalisées, soit au niveau des protéines qu’ils expriment, soit au niveau de portions de leur génome, soit enfin au niveau de leur génome tout entier [
22–
24]. Il s’avère que le polymorphisme des isolats est très restreint. Il est toutefois possible de distinguer les isolats qui circulaient de façon majoritaire avant la vaccination et l’établissement des souches vaccinales de ceux qui sont majoritaires actuellement, d’une part, et d’observer une diminution de la diversité génétique au cours du temps, d’autre part. Les isolats circulant actuellement sont un peu différents des souches vaccinales. Cela est certainement dû au fait qu’ils sont moins sensibles à l’immunité vaccinale que les isolats semblables aux souches vaccinales. Pour l’instant cette différence n’a pas modifié l’épidémiologie de la maladie en France depuis 10 ans alors que les isolats ont évolué [ 16]. Il est cependant crucial de poursuivre la surveillance de l’évolution des isolats et surtout de l’expression de leurs toxines et adhésines car nous avons pu constater des différences d’expression entre des isolats circulant en Finlande et en France, deux pays dont la couverture vaccinale est élevée, mais qui n’utilisent pas le même vaccin Ce [
25]. La surveillance est d’autant plus importante que beaucoup de pays ont maintenant décidé d’utiliser les vaccins Ca qui induisent une immunité différente car elle n’est dirigée que contre quelques protéines bactériennes. |
Conclusion et perspectives Comme nous venons de le voir l’introduction d’une vaccination généralisée peut avoir un effet considérable en réduisant la morbidité et la mortalité dues à une maladie infectieuse ciblée dans la population humaine. Cependant, la maladie infectieuse ne doit pas être oubliée pour autant et la surveillance doit être poursuivie. En effet, la vaccination généralisée, malgré ses effets bénéfiques indéniables, peut à long terme avoir des effets sur les populations humaines ou le germe responsable de la maladie. La surveillance continue des maladies infectieuses permettra d’adapter les stratégies vaccinales et d’intervenir à temps. Les maladies infectieuses ne sont pas toujours pédiatriques et elles peuvent toucher l’homme à n’importe quel âge. Il est donc de plus en plus important, pour prévenir leur survenue chez les nourrissons, d’informer de la nécessité de la prévention dans la population adulte. Il faut aussi souligner l’urgence de réaliser des études évaluant l’incidence des maladies infectieuses chez les personnes âgées dont le nombre ne fera qu’augmenter dans le futur, en particulier d’analyser la tolérance, l’immunogénicité et l’efficacité des différents vaccins chez cette catégorie d’adultes. |
Footnotes |
1. Fine PEM. Community immunity. In: Plotkin SA, Orenstein WA, eds. Vaccines, 4th ed. Elsevier Inc USA, 2004 : 1443–62. 2. Gaudelus J, Guiso N, Cohen R. Quel vaccin coquelucheux et à quel âge ? Mt Pédiatrie 2006; 9 : 160–9. 3. Guiso N. Histoire de la coqueluche. Mt Pédiatrie 2006; 9 : 135–7. 4. Guiso N. Précis de Bactériologie. Paris : Éditions ESKA 2007 (sous presse). 5. Mattoo S, Cherry JD. Molecular pathogenesis, epidemiology, and clinical manifestations of respiratory infections due to Bordetella pertussis and other Bordetella Subspecies. Clin Microbiol Rev 2005; 18 : 326–82. 6. Grimprel E, Njamkepo E, Begue P, et al. Rapid diagnosis of pertussis in young infants: comparison of culture, PCR, and infant’s and mother’s serology. Clin Diagn Lab Immunol 1997; 4 : 723–6. 7. Grimprel E, Bassinet L. Formes cliniques de la coqueluche : du nourrisson à l’adulte. Mt Pédiatrie 2006; 9 : 138–46. 8. Floret D, Groupe de pathologie infectieuse pédiatrique, Groupe francophone de réanimation et d’urgence pédiatrique. Les décès par infection bactérienne communautaire. Enquête dans les services de réanimation pédiatrique français. Arch Pediatr 2001; 8 : 705–11. 9. Gilberg S, Njamkepo E, Du Chatelet IP, et al. Evidence of Bordetella pertussis infection in adults presenting with persistent cough in a French area with very high whole-cell vaccine coverage. J Infect Dis 2002; 186 : 415–8. 10. Wirsing von Konig CH, Halperin S, Riffelmann M, et al. Pertussis of adults and infants. Lancet Infect Dis 2002; 2 : 744–50. 11. Direction Générale de la Santé. Rapport du Conseil supérieur d’hygiène publique de France (section maladies transmissibles) relatif à la conduite à tenir devant un ou plusieurs cas de coqueluche. Paris : DGS, 2005. 12. Bordet J, Gengou O. Le microbe de la coqueluche. Ann Inst Pasteur 1906; 20 : 731–41. 13. Caro V. Quelles nouveautés sur un agent pathogène centenaire ? Mt Pédiatrie 2006; 9 : 147–54. 14. Edwards KM, Decker MD. Pertussis Vaccine. In: Plotkin SA, Orenstein WA, eds. Vaccines, 4th ed. Elsevier Inc USA, 2004 : 471–528. 15. Baron S, Njamkepo E, Grimprel E, et al. Epidemiology of pertussis in French hospitals in 1993 and 1994: thirty years after a routine use of vaccination. Pediat Infect Dis J 1998; 17 : 412–8. 17. Nouvellon M, Gehanno JF, Pestel-Caron M, et al. Usefulness of pulsed-field gel-electrophoresis in assessing nosocomial pertussis transmission. Infect Control Hosp Epidemiol 1999; 20 : 758–60. 18. Bassinet L, Matrat M, Njamkepo E, et al. Nosocomial pertussis outbreak among adult patients and healthcare workers. Infect Control Hosp Epidemiol 2004; 25 : 995–7. 19. Ward A, Caro J, Bassinet L, et al. Health and economic consequences of an outbreak of pertussis among healthcare workers in a hospital in France. Infect Control Hosp Epidemiol 2005; 26 : 288–92. 20. Calendrier vaccinal 2004. BEH 2004; 28-29 : 121–5. 21. Calendrier vaccinal 2006. BEH 2006; 29-30 : 211–26. 22. Schouls LM, van der Heide HG, Vauterin L, et al. Multiple-locus variable-number tandem repeat analysis of Dutch Bordetella pertussis strains reveals rapid genetic changes with clonal expansion during the late 1990s. J Bacteriol 2004; 186 : 5496–505. 23. Caro V, Njamkepo E, Van Amersfoorth SC, et al. Pulsed-field gel electrophoresis analysis of Bordetella pertussis populations in various European countries with different vaccine policies. Microbes Infect 2005; 7 : 976–82. 24. Caro V, Hot D, Guigon G, et al. Temporal analysis of French Bordetella pertussis isolates by comparative whole-genome hybridization. Microbes Infect 2006; 8 : 2228–35. 25. Caro V, Elomaa A, Brun D, et al.
Bordetella pertussis, Finland and France. Emerg Infect Dis 2006; 12 : 987–9. |