Staphylococcus aureus est une bactérie cocci à Gram positif, aéro-anaérobie facultative parmi les plus courantes en pathologie humaine. Il appartient à la flore saprophyte transitoire cutanéo-muqueuse de l’homme. Les infections à S. aureus sont très fréquentes et constituent des tableaux spécifiques notamment d’infections cutanéo-muqueuses. On retrouve essentiellement des atteintes cutanées à type de folliculites, panaris, abcès cutanés ou surinfections de plaies, et des atteintes respiratoires avec une fréquence particulière chez le sujet bronchiteux chronique, l’enfant atteint de mucoviscidose ou dans le cas des patients en réanimation sous ventilation mécanique. Enfin, on décrit des infections invasives avec passage de la bactérie dans le sang. Les bactériémies à S. aureus sont parmi les plus fréquentes. Elles peuvent parfois être suivies d’atteintes organiques localisées constituant des métastases septiques [ 1]. L’atteinte métastatique la plus classique est l’endocardite [ 2]. D’autres foyers sont aussi fréquemment retrouvés, notamment des infections osseuses, rénales ou autres abcès profonds. Par exemple, les atteintes rénales à S.aureus sont le plus souvent le résultat de métastases septiques avec atteinte du tractus urinaire par voie hématogène. S.aureus est donc une bactérie responsable de nombreuses infections, parfois graves, très fréquentes en pathologie communautaire mais aussi nosocomiale, en particulier chez des patients fragilisés et porteurs de voies d’abord cutanées. S. aureus représente d’ailleurs le premier germe isolé par sa fréquence, dans les infections hospitalières. Ainsi, l’infection staphylococcique constitue un problème important de santé publique d’autant qu’il est de plus en plus difficile de la traiter. S. aureus est en effet caractérisé par le développement rapide, contrairement aux autres bactéries à Gram positif, de résistances aux différentes molécules antibiotiques, et par la dissémination inquiétante des souches multi-résistantes. On décrit dans l’histoire du traitement des infections à S. aureus trois évènements essentiels : l’apparition de la résistance croisée à l’ensemble des β-lactamines, la diffusion de ces souches chez les patients ambulatoires présentant des infections communautaires [ 3], et l’émergence de la première souche résistante aux glycopeptides aux États-Unis en 2002 [ 4].
Dans un travail récemment publié, nous montrons qu’une souche de S. aureus, isolée du sang lors d’un épisode bactériémique associée à une spondylodiscite, produit la formation de larges tunnels ou macroapertures (MA) au travers des cellules endothéliales in vitro et ex vivo [ 5]. L’ouverture de ces MA dans le tapis cellulaire endothélial rend possible la fixation des bactéries au niveau de la matrice extracellulaire (Figure 1). Ces structures sont provoquées par le facteur EDIN (epidermal cell differentiation inhibitor). Ce facteur protéique a été décrit dans 7,8 % des souches de S. aureus responsables d’infections, mais son rôle dans la virulence bactérienne reste encore mal connu [ 6]. En revanche, son mode d’action moléculaire est bien décrit. EDIN appartient à la famille des exoenzymes de la famille C3 de Clostridium botulinum [ 7, 8]. Ces exoenzymes inactivent la protéine cellulaire RhoA par ADP-ribosylation. RhoA est un membre de la famille des protéines GTPases Rho, régulateurs centraux de l’organisation et de la dynamique du cytosquelette d’actine. En effet, la protéine RhoA est un activateur de la Rho kinase. Cette kinase induit de façon directe et indirecte la phosphorylation et l’activation de la sous-unité régulatrice de la chaîne légère de la myosine. Cela entraîne la formation de câbles d’actine et leurs contractions. L’inhibition ou la déplétion de RhoA après ADP-ribosylation par le facteur EDIN conduit à une dissolution des câbles d’actine et à l’induction des macroapertures notamment dans les cellules endothéliales [5]. L’ouverture de MA dans les cellules peut aussi être induite par des agents chimiques déstabilisateurs des câbles d’actine, par inhibition de la Rho kinase, ou encore à la suite de la dépletion de RhoA par interférence par l’ARN. L’analyse de ces structures par vidéomicroscopie a permis d’établir qu’in vitro l’ouverture de ces tunnels intracellulaires est transitoire. L’actine filamentaire est recrutée en périphérie des MA. Il se forme alors un voile membranaire qui progresse jusqu’à fermeture de la structure. Enfin, l’analyse de l’effet de l’EDIN sur des monocouches de cellules endothéliales et dans un modèle animal indique que l’ouverture des MA corrèle avec l’induction par l’EDIN d’une perméabilité vasculaire. L’EDIN est donc un facteur bactérien capable de produire des brèches dans la barrière endothéliale.
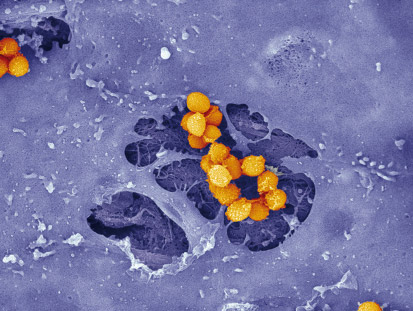
| Figure 1.
L’infection de l’endothélium, ex vivo, par une souche de S. aureus productrice d’EDIN induit la formation de larges tunnels, ou macroapertures, au travers des cellules endothéliales. Cela offre aux bactéries un accès direct aux fibres de la matrice extracellulaire (image prise en microscopie électronique à balayage). |
Cette découverte soulève de nombreuses questions. Existe-il une implication de ces tunnels intracellulaires dans la régulation physiologique de la perméabilité vasculaire ? Une étude indique en effet que l’augmentation de la pression vasculaire conduit à la formation de tunnels dans les cellules endothéliales [ 9] et que certains événements de diapédèse font intervenir un passage des leucocytes dans les cellules endothéliales [ 10]. Une autre question est de mieux comprendre le mécanisme moléculaire par lequel se produit l’ouverture des tunnels intracellulaires : élargissement d’un pore préexistant ou fusion des membranes endothéliales apicale et basale ? Ce phénomène étant dynamique, quels sont les signaux et le mécanisme par lequel la cellule perçoit la présence de ces macroapertures pour induire leur fermeture. Enfin, quelle pourrait être la place de ces structures, et donc du facteur EDIN, dans la virulence des souches de S. aureus et dans la gravité des infections. En effet, un tel mécanisme semble pouvoir être impliqué dans le développement des métastases septiques à S. aureus en conférant à la bactérie un mode d’invasion des tissus jusqu’ici inconnu.