| |
| Med Sci (Paris). 2007 May; 23(5): 473–474. Published online 2007 May 15. doi: 10.1051/medsci/2007235473.Une étape de maturation terminale des granules cytotoxiques est nécessaire à l’excrétion de leur contenu lytique Mickaël Ménager1,2 and Geneviève de Saint Basile1,2,3 1Inserm U768, Laboratoire du Développement Normal et Pathologique du Système Immunitaire, 149, rue de Sèvres, Paris, F-75015 France. 2Université Paris Descartes, Faculté de Médecine René Descartes, IRNEM (IFR95), Paris, F-75015 France. 3AP-HP, Hôpital Necker Enfants-Malades, Unité d’Immunologie-Hématologie Pédiatrique, Paris, F-75015 France MeSH keywords: Survie cellulaire, Granulations cytoplasmiques, Exocytose, Humains, Protéines membranaires, Synapses, Lymphocytes T cytotoxiques, Protéines G rab |
La cytotoxicité est l’ensemble des mécanismes qui permettent aux lymphocytes T CD8+ (CTL) et aux cellules natural killer (NK) d’éliminer une cellule tumorale ou infectée par un virus. Les cellules cytotoxiques exercent cette activité en utilisant la sécrétion polarisée de granules cytotoxiques contenant des effecteurs lytiques tels que la perforine et les granzymes [
1,
2]. De tels granules sont décrits comme ayant une dualité fonctionnelle, arborant à la fois des caractéristiques de lysosomes (faible pH, présence de marqueurs lysosomiaux comme lamp1, lamp2 et CD63) et d’organites de sécrétion pour les effecteurs lytiques [
3]. Après reconnaissance par un récepteur spécifique d’un antigène présenté par une cellule cible, les cellules cytotoxiques réorganisent leur cytosquelette et leur centre organisateur de microtubules (MTOC) vers la zone de contact avec la cellule cible, autour d’une structure macromoléculaire dénommée synapse immunologique (SI). Les granules cytotoxiques sont alors transportés le long des microtubules, s’accumulent autour du MTOC qui, en contactant la membrane plasmique, permet à ces derniers d’atteindre le site de sécrétion au niveau de la SI. Au point de contact, les granules cytotoxiques s’arriment au niveau de la membrane plasmique avec laquelle ils fusionnent et ils libèrent leur contenu dans une fente formée transitoirement entre les deux cellules. Les effecteurs lytiques pénètrent alors dans la cellule cible et induisent sa mort par apoptose [
4]  | Figure 1.
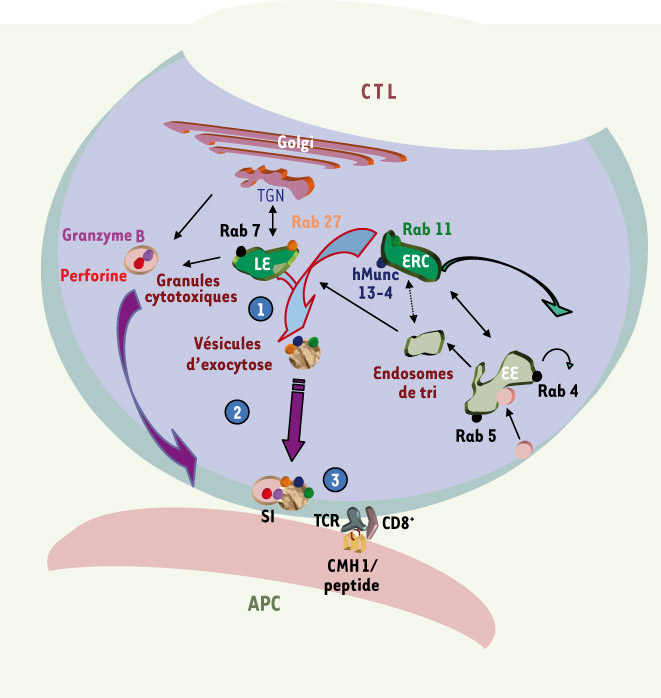
Différentes étapes de la maturation des granules cytotoxiques nécessaire à l’exocytose de leur contenu au niveau de la synapse immunologique. Dans une première étape de maturation des granules cytotoxiques (❶), hMunc13-4 (point bleu) rassemble une fraction du compartiment endosomique tardif (LE) associant Rab27a (point orange) avec une fraction du compartiment endosomique de recyclage (ERC) associant Rab11 (point vert). Cette étape conduit à la formation d’un contingent de vésicules, les « vésicules d’exocytose » qui portent les effecteurs nécessaires à l’excrétion des granules cytotoxiques (hMunc13-4 et Rab27a). Cette étape ne requiert ni l’activation des lymphocytes T ni la présence de la protéine Rab27a. La reconnaissance d’un complexe peptide antigénique/CMHI par le récepteur des cellules T (TCR) conduit à la formation d’une synapse immunologique (SI) vers laquelle polarise le MTOC. Dans une deuxième étape de maturation (❷) les « vésicules d’exocytose » et les granules cytotoxiques contenant la perforine (point rouge) et le granzyme B (point violet) polarisent, de façon indépendante, le long des microtubules vers la SI. Au cours d’une troisième étape de maturation (❸) les granules cytotoxiques et les « vésicules d’exocytose » coopèrent et/ou fusionnent pour excréter leur contenu lytique vers la cellule présentatrice d’antigène (APC). EE : endosomes précoces ; TGN : appareil de Golgi. |
Des études précédentes, qui s’appuyaient sur l’identification des causes moléculaires responsables de pathologies hyper-immunes, nous avaient permis de caractériser deux protéines indispensables à la sécrétion du contenu des granules cytotoxiques, Rab27a et hMunc13-4. Rab27a est une petite GTPase supposée intervenir au niveau du transport terminal ou de l’arrimage des granules cytotoxiques à la membrane plasmique. hMunc13-4 joue un rôle de facteur d’amorçage de la fusion membranaire des granules arrimés en les rendant compétents pour l’étape de fusion avec la membrane plasmique, au niveau de la SI [
5–
8]. |
hMunc13-4 et Rab27a sont associées à des vésicules distinctes des granules cytotoxiques des lymphocytes L’étude que nous avons réalisée [
9] montre que, de façon inattendue, les protéines Rab27a et hMunc13-4 exprimées transitoirement dans les cellules cytotoxiques, ne se localisent pas sur les granules lytiques contenant la perforine et le granzyme B, mais sur des vésicules distinctes. L’utilisation d’autres membres de la famille Rab comme marqueurs des différents compartiments cellulaires, permet de montrer que hMunc13-4 cible le compartiment endosomique de recyclage, identifié par Rab11 et localisé autour du MTOC. La protéine Rab27a est retrouvée majoritairement avec Rab7, associée au compartiment endosomal tardif, situé à l’intersection des voies d’endocytose et d’exocytose [
10]. Ces résultats indiquent que les granules cytotoxiques ne sont pas des vésicules préformées prêtes à être excrétées. Une étape supplémentaire de maturation de ces granules s’avère nécessaire pour que les effecteurs de l’exocytose, Rab27a et hMunc13-4, se redistribuent sur les granules cytotoxiques et leur confèrent cette capacité à excréter leur contenu lytique. |
hMunc13-4 permet la formation d’un contingent de « vésicules d’exocytose » L’expression transitoire de hMunc13-4 dans la cellule cytotoxique met en évidence un rôle additionnel de cette protéine dans la formation d’un contingent de vésicules issues de la fusion d’endosomes de recyclage avec des endosomes tardifs. Nous avons dénommé ces vésicules, « vésicules d’exocytose » car elles permettent de regrouper au sein d’une même structure, distincte des granules cytotoxiques, les effecteurs de l’exocytose, hMunc13-4 et Rab27a, ainsi que la protéine Rab11. La fonction de hMunc13-4 est nécessaire au rassemblement des vésicules endosomiques qui forment les « vésicules d’exocytose ». Cette étape ne nécessite ni la présence de Rab27a, ni l’activation lymphocytaire. |
La formation d’une synapse immunologique induit une maturation terminale du granule cytotoxique Nos travaux montrent également qu’une étape terminale de maturation du granule cytotoxique est induite de novo par la formation d’une SI avec la cellule cible. Durant cette étape, les « vésicules d’exocytose » de nature endosomique et les granules cytotoxiques de nature lysosomale polarisent indépendamment vers la SI. Une colocalisation entre ces deux types d’organelles est observée exclusivement au niveau de la zone de contact intime entre les membranes plasmiques des deux cellules, au lieu d’excrétion des granules cytotoxiques. Une analyse beaucoup plus résolutive de ces différents phénomènes par microscopie électronique, permet d’observer quelques rares évènements où il existe une redistribution des protéines hMunc13-4, Rab27a et Rab11 sur la membrane des granules cytotoxiques proche du site d’excrétion. Ces observations permettent de conclure à l’existence d’une ultime étape de maturation des granules cytotoxiques ayant polarisé à la SI, qui fusionnent avec des « vésicules d’exocytose » formées sous l’action de hMunc13-4. Cette étape permet ainsi le regroupement des protéines lytiques et des effecteurs de l’exocytose sur un même type vésiculaire. À ce stade très tardif de la voie d’exocytose, l’interaction entre hMunc13-4 et Rab27a, qui est mise en évidence, pourrait permettre de coordonner l’arrimage des granules cytotoxiques avec l’amorçage de leur fusion membranaire, les rendant compétents pour excréter leur contenu. |
Ces données apportent des éléments nouveaux quant aux mécanismes moléculaires qui régulent la voie d’excrétion des granules cytotoxiques. Elles pourraient en partie expliquer la dualité fonctionnelle des lysosomes de sécrétion dans ces cellules. Nos résultats suggèrent en effet que, aussi longtemps que les granules cytotoxiques n’ont pas fusionné avec les « vésicules d’exocytose », ils ne possèdent pas les propriétés d’organites de sécrétion et agissent comme des lysosomes de dégradation conventionnels, jusqu’à ce qu’une activité cytotoxique soit requise. Ce mécanisme de maturation tardive pourrait également permettre de contrôler le nombre de granules cytotoxiques capables d’excréter leur contenu à la SI, et ainsi réguler précisément l’intensité d’une réponse cytotoxique. Il est également possible que ce même mécanisme de contrôle permette aux cellules cytotoxiques de disposer d’une fonction cytotoxique itérative leur conférant ce comportement de « tueur en série » qui les caractérise [2, 10]. |
Nous tenons à remercier L’Inserm, l’Agence Nationale pour la Recherche (ANR-MIM), et La Fondation pour la recherche Médicale qui soutiennent généreusement nos travaux.
|
1. Russell JH, Ley TJ. Lymphocyte-mediated cytotoxicity. Annu Rev Immunol 2002; 20 : 323–70. 2. Stinchcombe JC, Bossi G, Booth S, et al. The immunological synapse of CTL contains a secretory domain and membrane bridges. Immunity 2001; 15 : 751–61. 3. Blott EJ, Griffiths GM. Secretory lysosomes. Nat Rev Mol Cell Biol 2002; 3 : 122–31. 4. Stinchcombe, JC, Majorovits, E, Bossi, G, et al. Centrosome polarization delivers secretory granules to the immunological synapse. Nature 2006; 443 : 462–5. 5. Menasche G, Feldmann J, Fischer A, et al. Primary hemophagocytic syndromes point to a direct link between lymphocyte cytotoxicity and homeostasis. Immunol Rev 2005; 203 : 165–79. 6. Menasche G, Menager M, Le Deist F, et al. Defect in lytic granule exocytosis: several causes, a same effect. Med Sci (Paris) 2006; 22 : 733–8. 7. Feldmann J, Callebaut I, Raposo G, et al. Munc 13-4 is essential for cytolytic granules fusion and is mutated in a form of familial hemophagocytic lymphohistiocytosis (FHL3). Cell 2003; 115 : 461–73. 8. Feldmann J, Deist FL, Fischer A, et al. Munc13-4 is essential for cytolytic granule fusion. Med Sci (Paris) 2004; 20 : 144–6. 9. Menager MM, Menasche G, Romao, M, et al. Secretory cytotoxic granule maturation and exocytosis require the effector protein hMunc13-4. Nat Immunol 2007; 8 : 257–67. 10. Miaczynska M, Zerial M. Mosaic organization of the endocytic pathway. Exp Cell Res 2002; 272 : 8–14. |