| |
| Med Sci (Paris). 2007 May; 23(5): 502–508. Published online 2007 May 15. doi: 10.1051/medsci/2007235502.Le natural killer, fer de lance des futures immunothérapies anti-tumorales ? Alexandre Iannello, Olfa Débbeche, Suzanne Samarani, Sébastien Sabbagh, Michel Duval, and Ali Ahmad* Centre de recherche de l’Hôpital Sainte-Justine, L’Axe du cancer et maladies virales et immunitaires, Département de microbiologie et d’immunologie, Université de Montréal, Montréal (Québec), Canada 3175, Côte Sainte-Catherine Montréal (Québec), H3T 1C5 Canada. |
Les cellules natural killer (NK) Les cellules NK sont de grands lymphocytes granulaires de faible densité, représentant 10 % à 15 % des cellules mononucléées du sang périphérique. Elles se développent et se différencient dans la moelle osseuse et possiblement dans le thymus ainsi que dans les ganglions lymphatiques. Reconnues phénotypiquement comme CD3-, CD14-, CD56+ et/ou CD16+, leur effet cytotoxique est principalement médié par le couple perforine-granzyme ainsi que par FasL et TRAIL. Dans les années 1980, Kärre et al. ont observé que les cellules tumorales n’exprimant pas le CMH de classe I (CMH-I, appelé aussi complexe majeur d’histocompatibilité ou HLA, human leukocyte antigen, chez l’humain) étaient tuées de façon préférentielle par les cellules NK. Leurs observations les ont mené à émettre l’hypothèse du « soi-manquant », selon laquelle les cellules NK surveilleraient la présence du CMH-I (le soi) à la surface des cellules cibles et tueraient celles qui ne l’expriment pas ou l’expriment de façon réduite [
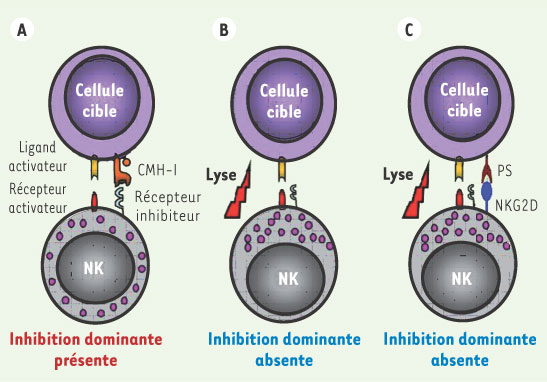
1] (Figure 1). La découverte des récepteurs inhibiteurs des cellules NK se liant spécifiquement aux différents antigènes du CMH-I a fourni la base moléculaire de leur hypothèse.  | Figure 1.
Reconnaissance des cellules cibles par les cellules NK. A. La reconnaissance des cellules cibles par les cellules NK est influencée par l’expression du CMH-I de la cellule cible. Lorsque la cellule cible exprime le CMH-I, les récepteurs KIR inhibiteurs interagissent avec celui-ci et transmettent un signal inhibiteur dominant qui n’entraîne pas de lyse. B. Lors d’infections virales ou de transformations, l’expression du CMH-I est diminuée, ce qui empêche l’inhibition de la celluleNK par ses KIR. Les récepteurs activateurs peuvent donc transmettre à l’intérieur de la celluleNK, un signal intracellulaire positif entraînant la lyse des cellules cibles. C. Les cellules cibles peuvent, de plus, exprimer de novo les protéines induites par le stress (PS) qui se fixent aux récepteurs activateurs NKG2D. |
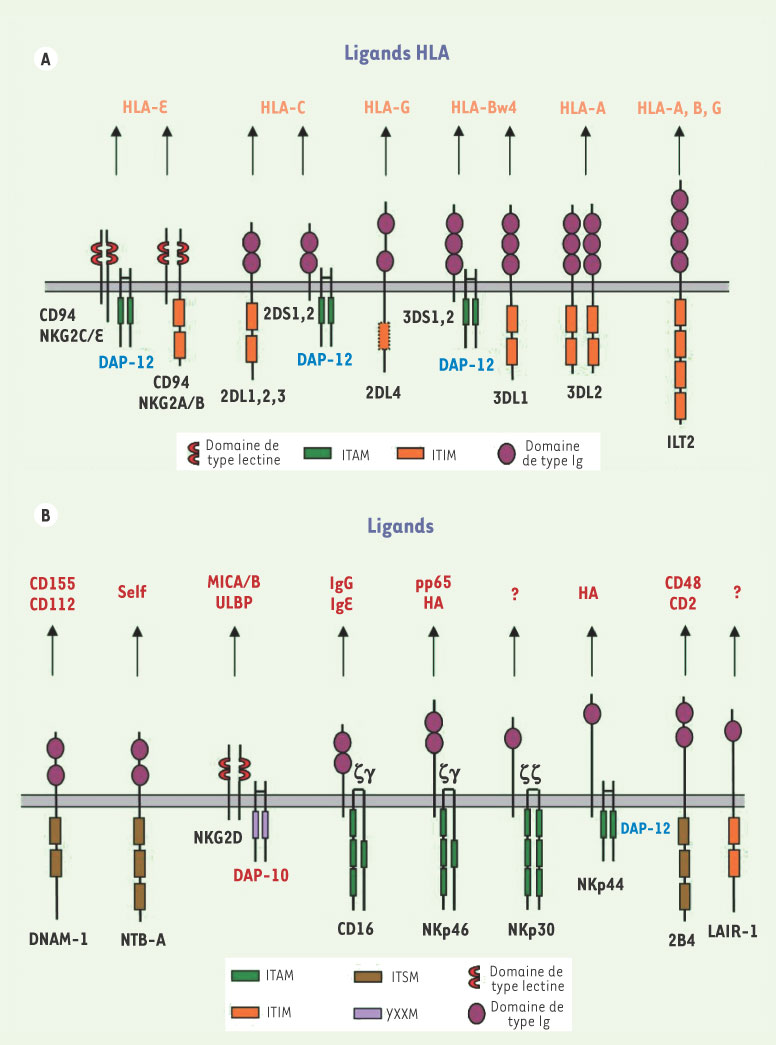
Nous savons aujourd’hui que les cellules NK expriment une multitude de récepteurs activateurs et inhibiteurs qui se lient à différents ligands [
2,
3] (Figure 2). Les récepteurs activateurs transmettent des signaux via leurs partenaires de signalisation (DAP-10, -12, les chaînes ζ et/ou γ du complexe CD3 des cellules T). Les kinases de la famille des Src phosphorylent les résidus tyrosines présents dans les ITAM (immunoreceptor tyrosine-based activating motif) des partenaires après liaison d’un récepteur à son ligand. Les ITAM phosphorylés recrutent les kinases ZAP-70 et les Syk. Cependant, les motifs tyrosines phosphorylés de DAP-10 recrutent et activent les protéines PI-3K et Grb2. La phosphorylation de Vav est une étape importante dans la lyse médiée par les cellules NK. Les Vav activent les petites GTPases de la famille Rho qui causent la réorganisation du cytosquelette des cellules NK vers la cellule cible et déclenchent la relâche des granules cytolytiques. L’engagement des récepteurs inhibiteurs (KIR) avec leurs ligands appropriés (CMH-I) sur la cellule cible résulte en une phosphorylation des ITIM (immunoreceptor tyrosine-based inhibitory motif) présents dans leurs longues queues cytoplasmiques. Les tyrosines phosphorylées dans les ITIM recrutent des phosphatases contenant des domaines SH-2 comme SHP-1 et SHP-2 qui déphosphorylent Vav et d’autres substrats impliqués dans l’activation des cellules NK. Ainsi, les signaux inhibiteurs médiés par les KIR inhibiteurs inhibent de façon transitoire l’activation des cellules NK et empêchent la lyse des cellules cibles. L’activité cytotoxique d’une cellule NK déclenchée contre les cellules cibles dépend donc d’un équilibre entre les signaux activateurs et inhibiteurs reçus. Les signaux inhibiteurs et particulièrement ceux émanant d’une liaison entre un récepteur KIR inhibiteur et son ligand CMH-I dominent ceux reçus par les récepteurs activateurs. Les cellules de l’hôte sont donc épargnées par leurs propres cellules NK tant qu’elles expriment le CMH-I. Lors d’infections ou de cancers, les cellules échappent à la lyse par les lymphocytesT cytotoxiques en réduisant leur expression du CMH-I, ce qui pourrait les rendre sensibles à la lyse par les cellules NK (Figure 1). L’activité des cellules NK est donc largement sous la coupe des récepteurs KIR inhibiteurs qui sont caractérisés par leurs longues queues cytoplasmiques.  | Figure 2.
Les récepteurs NK et leurs ligands. A. Les récepteurs KIR (killer-cell immunoglobulin-like receptors) sont des glycoprotéines de type1 appartenant à la superfamille des immunoglobulines (Ig) qui se lient au CMH de classe I. Les récepteurs NKG2 sont des glycoprotéines membranaires intégrales comme les lectines C de type II qui se lient aux HLA-E et sont exprimées sous formes hétérodimériques avec un polypeptide invariant appelé CD94. Les récepteurs inhibiteurs possèdent de longues queues cytoplasmiques et transmettent des signaux inhibiteurs par l’intermédiaire de motifs tyrosines intracellulaires (ITIM) qui, après phosphorylation, agissent comme sites de recrutement pour des phosphatases qui inhibent temporairement l’activité des cellules NK. Cependant, certains récepteurs (exemple : NKG2C/E-CD94 de la famille NKG2 et KIR2DS1/2 de la famille KIR) sont associés à la protéine DAP-12 qui possède un motif tyrosine activateur (ITAM) et sont donc des récepteurs activateurs. Le récepteur KIR2DL1 se lie aux HLA-C du groupe 2 (exemple : HLA-Cw2, 4, 6 et 15 qui possèdent dans leur séquence une lysine en position 80) et KIR2DL2 ainsi que son allotype KIR2DL3 se lie aux HLA-C du groupe 1 (exemple : HLA-Cw1, 3, 7 et 8 qui possèdent dans leur séquence une asparagine en position 80). Les récepteurs KIR activateurs se lient aussi aux mêmes ligands CMH que leurs homologues inhibiteurs; KIR2DS1 se lie aux HLA-C du groupe 2 et KIR3DS1 se lie au HLA-Bw4 et non au HLA-Bw6. B. Parmi les récepteurs ne se liant pas au CMH-I se trouvent les récepteurs de cytotoxicité naturelle (NRC), NKp46, NKp30 et NKp44. Ils appartiennent à la superfamille des Ig et sont très spécifiques aux cellules NK. NKp46 et NKp30 sont exprimés à la surface des cellules NK au repos et activés, tandis que NKp44 est exprimé exclusivement sur les cellules NK activées. Bien que certaines protéines du virus Influenza se lient aux NKp46 et NKp44, les ligands cellulaires de ces récepteurs sont inconnus. CD16 (FcγRIIIa) est le récepteur qui se fixe à la région Fc d’IgG permettant le mécanisme d’ADCC (antibody dependent cell-mediated cytotoxicity). Les signaux activateurs de ces récepteurs sont médiés par des ITAM contenus dans la protéine DAP-12 et les chaînes homodimèriques (ζ-ζ) ou hétérodimèriques (γ-ζ). NKG2D se lie aux protéines MIC-A et MIC-B, ainsi qu’aux molécules ULBP (UL16-binding proteins). Les ligands du récepteur NKG2D sont des protéines de stress exprimées par les cellules lors de stress génotoxiques, de transformations ou lors d’infections virales. NKG2D induit un signal activateur intracellulaire par la protéine DAP-10 contenant un motif YXXM qui recrute la protéine PI3-K. 2B4 et NTB-A sont des récepteurs qui contiennent des motifs ITSM à doubles fonctions (+/-) qui peuvent se lier à la protéine adaptatrice SAP (SLAM-associated protein) ou à la protéine ERT-2 (Ewing’s sarcoma activated transcript-2). Leurs fonctions dépendent donc des partenaires de signalisation intracellulaire présents. LAIR-1 est un récepteur inhibiteur qui ne reconnaît pas le CMH-I et dont l’expression n’est pas restreinte aux cellules NK. MIC-A/B: MHC classI heavy chain-like protein-A/B; ULBP: UL-16 binding proteins ; ITAM : immunoreceptor tyrosine-based activating motif ; ITIM : immunoreceptor tyrosine-based inhibitiory motif ; ITSM : immunoreceptor tyrosine-based switch motif ; DNAM-1 : Dynax accessory molecule-1; NTB-A: NK, T and B cell antigen ; 2DL, 3DL, 2DS et 3DS représentent KIR.
|
Le locus des KIR est multigénique et très polymorphique [3,
4]. Les 13 gènes codant pour les KIR sont exprimés dans différentes sous-populations de cellules NK, rendant la population de cellules NK d’un individu très hétérogène. Ces gènes sont exprimés de façon stochastique recouvrant tous les sous-types de cellules NK. Par conséquent, chaque cellule NK n’exprime pas tous les gènes codant pour les KIR présents dans le génome d’un individu mais peut exprimer 1 à 3 de ces gènes. Il en résulte sur une multitude de sous-types de cellules NK ayant un répertoire unique de récepteurs KIR. De plus, le nombre de gènes KIR (5 à 13) présents dans le génome de chaque individu peut varier. |
Alloréactivité des cellules NK L’alloréactivité médiée par les cellules NK diffère de celle médiée par les cellules T. Les récepteurs se liant aux antigènes (TCR) des cellules T d’un individu X peuvent reconnaître le CMH complexé avec des peptides endogènes exprimés à la surface des cellules présentatrices d’antigènes d’un individu Y. Cela entraîne la reconnaissance et l’activation des cellules T qui pourraient tuer les cellules de l’individu Y. L’alloréactivitée médiée par les cellules NK repose sur la présence d’une incompatibilité mismatch entre les KIR d’un donneur et ses ligands, les molécules du CMH-I du receveur (Figure 3A). Par conséquent, les cellules NK d’un individu X seront alloréactives contre les cellules hématopoïétiques d’un individu Y si l’individu X possède des cellules NK ayant des KIR inhibiteurs pour lesquels il n’existe pas de ligands (CMH-I) chez l’individu Y.  | Figure 3. Études menées sur les alloréactions des cellules NK lors de transplantations hématopoïétiques. A.Chez l’homme, les alloréactions ont lieu lors d’une incompatibilité au sein du CMH-I entre le donneur et le receveur. Cette figure présente les HLA des donneurs et des receveurs, ainsi que les cellules NK des donneurs qui pourraient agir de façon alloréactive chez les receveurs. Par exemple, les donneurs qui expriment les HLA-C de groupe1 possèdent des cellules NK exprimant le KIR2DL2/3 qui seront alloréactives contre les cellules des receveurs exprimant le HLA-C du groupe 2 et non les HLA-C du groupe1. B.La greffe de moelle provenant chacune des parents (A/A ou B/B) est rejetée par leur hybride F1 (A/B). Le rejet est effectué par une sous-population de cellules NK équipées de récepteurs inhibiteurs ne reconnaissant pas le CMHI du donneur. Ces expériences illustrent donc l’alloréaction des cellules NK contre le greffon. Cependant, les individus F1 acceptent les greffes de peau et d’organes, ce qui démontre une alloréactivité des cellules NK uniquement contre des cibles lympho-hématopoïétiques. |
Comme cela est indiqué dans la Figure 2, il existe un type de KIR qui possèdent des courtes queues cytoplasmiques sans posséder de motifs inhibiteurs ITIM [2, 3]. Chacun de ces KIR s’associe avec un partenaire de signalisation appelé DAP-12 qui envoie des signaux d’activation après liaison du récepteur avec le ligand approprié. Les KIR activateurs se lient aux mêmes ligands CMH que leurs homologues inhibiteurs à longues queues cytoplasmiques, bien que leur affinité pour ces ligands soit plus faible que celle existante pour les KIR inhibiteurs. Cependant, un antigène tumoral, donc différent du CMH-I, peut se lier au récepteur activateur KIR2DS4 [4]. Il est d’ailleurs envisagé que les récepteurs KIR activateurs se lient à des antigènes encore inconnus exprimés par les cellules tumorales. Si les cellules NK d’un donneur expriment un ou plusieurs KIR activateurs, elles seront plus alloréactives contre les cellules d’un receveur qui expriment les ligands spécifiques de ces KIR [2, 3]. Les gènes d’autres récepteurs activateurs des cellules NK tels que 2B4, NKp30, NKp46, NKp44, NKG2D, etc. exhibent peu de polymorphisme et ne différent donc pas d’une personne à l’autre. Si les cellules cibles expriment leurs ligands, l’engagement de ces récepteurs déclenche les fonctions effectrices des cellules NK. Il est important de noter que les ligands du NKG2D s’expriment peu à la surface des cellules normales mais peuvent être induits par un stress génotoxique, une infection ou une transformation de cellules. Ces ligands, comprenant MIC (MHC class I heavy chain related)-A, MIC-B et ULBPs (UL-16 binding proteins), sont polymorphiques et peuvent alors jouer un rôle dans l’alloréactivité des cellules NK. |
Les cellules NK et la transplantation hématopoïétique Les études portant sur des transplantations de cellules hématopoïétiques allogéniques ont fourni d’importantes preuves concernant le rôle des cellules NK contre les leucémies, ainsi que leur exploitation possible en immunothérapie [
5–
8]. Ces études démontrent que la présence de cellules NK alloréactives au sein des cellules greffées améliore les résultats de la greffe, réduit la GvHD (graft versus host disease), la récidive de la tumeur et l’apparition de PTLD (post-transplant lymphoproliferative disorders). Les alloréactions médiées par les cellules NK lors de transplantations haplo-identiques (lorsque le donneur partage un chromosome portant les gènes HLA avec le receveur) ont d’abord été observées chez la souris dans le modèle de résistance à la transplantation chez l’hybride [
9]. Les souris hybrides F1 rejettent la greffe de moelle osseuse provenant de leurs parents (Figure 3B) ; cela est dû à une sous-population de cellules NK présente chez la souris hybrideF1 qui ne possède pas les récepteurs inhibiteurs se liant aux ligands CMH-I des parents. Ces cellules NK vont donc tuer les cellules d’origine parentale après leur transplantation. Cette mise à mort pourrait être dépendante du récepteur NKG2D lorsque les cellules transplantées provenant de certaines souches (par exemple C56BL/6) de souris commencent à exprimer les ligands de ce récepteur activateur dans la souris receveuse (hybride F1) [
10]. Les études [
6,
11] utilisant un modèle de transplantation murin démontrent que les cellules NK ciblent les cellules hématopoïétiques. Après injection, les cellules NK alloréactives se propagent dans tous les organes et lysent les granulocytes, les cellules dendritiques (CD) et les cellules T dans la moelle osseuse, la rate et d’autres tissus. |
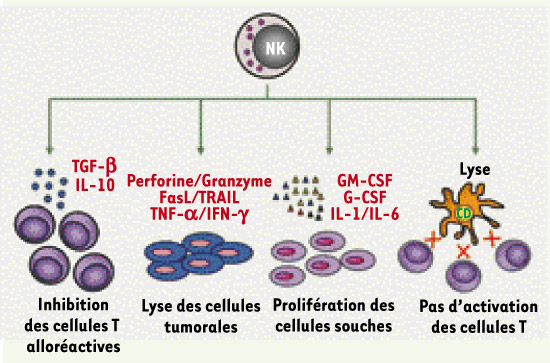
Effet des cellules NK alloréactives contre les leucémies Les cellules NK alloréactives sont reconnues pour lyser préférentiellement les cellules d’origine hématopoïétique. Cela explique l’effet anti-tumoral (contre les cellules leucémiques) des cellules NK alloréactives et leur rôle dans la diminution des récidives de tumeurs. Les cellules NK lysent rarement les cellules endothéliales vasculaires contrairement aux cellules T du donneur présentes dans le greffon. L’expression du HLA-E par les cellules endothéliales vasculaires les rend résistantes aux cellules NK en engageant les récepteurs inhibiteurs CD94/NKG2A [
12] (Figure 2). Cela explique pourquoi les cellules NK n’induisent pas de GvHD chez le receveur. De plus, les cellules NK peuvent produire des facteurs immunosuppresseurs comme le TGF-β, l’IL-10 et lyser les CD [
13]. La mort des cellules dendritiques du receveur empêche la présentation des antigènes du receveur aux cellules T du donneur. En l’absence de cette présentation antigénique, les cellules T du donneur ne peuvent pas tuer les tissus du receveur et par conséquent ne créent pas de GvHD (Figure 4). Il a été observé que les souris porteuses de cellules NK alloréactives peuvent ainsi tolérer la présence des cellules T dans le greffon et peuvent recevoir une greffe de moelle osseuse contenant plus de trente fois la dose permise de cellules T allogéniques [6]. Les cellules T présentes dans le greffon luttent contre les infections et défendent le receveur jusqu’à ce que le système immunitaire du donneur soit établi et fonctionnel chez le receveur. Les cellules NK alloréactives peuvent de plus sécréter des facteurs ayant un rôle dans l’hématopoïèse du receveur comme le GM-CSF, l’IL-1 et l’IL-6 qui renforcent l’établissement de la greffe chez le receveur (Figure 4). 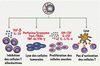 | Figure 4.
Mécanismes proposés concernant l’activité des cellules NK alloréactives lors de transplantations hématopoïétiques allogéniques. Les cellules NK venant du donneur renforcent la greffe par la production de facteurs de croissance hématopoïétiques comme l’IL-1, l’IL-6 ou le GM-CSF qui ont un effet direct sur les cellules souches hématopoïétiques. Les cellules NK peuvent inhiber les cellules T alloréactives en produisant des facteurs immunosuppresseurs comme le TGF-β et l’IL-10 ou en lysant les cellules présentatrices d’antigènes qui activent les cellules T. Ces mécanismes d’inhibitions des cellules T permettent d’empêcher une GvHD chez le receveur. Finalement, les cellules NK alloréactives ont un effet lytique sur les tumeurs (GvL) en utilisant leurs différents mécanismes cytotoxiques. GM-CSF : granulocyte-macrophage colony-stimulating factor ; CD : cellule dendritique ; GvHD : maladie du greffon contre l’hôte (graft versus host disease) ; GvL : effet du greffon contre la leucémie (graft versus leukemia effect) ; TGF-β : transforming growth factor-β. |
Des études in vitro démontrent que les cellules NK alloréactives peuvent tuer des cellules de leucémie myéloïde aiguë (LAM) et chronique (LMC), de leucémie lymphocytaire aiguë (LAL), de leucémie lymphocytaire chronique (LLC), de lymphome non-hodgkinien et de myélomes multiples. Les seules cibles résistantes seraient les cellules provenant de leucémie lymphoblastique aiguë du phénotype commun (C-LAL), ce qui a été partiellement expliqué par leur défaut d’expression de la molécule d’adhérence LFA-1 [5]. L’interaction entre LFA-1 (lymphocyte function-associated antigen-1) et son ligand ICAM-1 (intercellular adhesion molecule-1) est primordiale pour la formation d’une synapse immunologique entre la cellule cible et la cellule NK [
14]. Lors de transplantations chez l’homme, l’alloréactivité des cellules NK a réduit le risque de récidive de tumeur chez 57 patients ayant une LAM, amélioré leur prise de greffe, et les a protégés contre une GvHD [6]. Une autre étude a démontré la même réussite chez 93 patients atteints de LAM, diminuant le taux de rejet de greffe à 2 % contre 10 % et augmentant la probabilité de guérison (ou une vie sans maladie) à 55 % contre 15 % (p < 0,005) [
15]. L’utilité des cellules NK (du donneur) alloréactives (contre le receveur) a été observée lors de transplantations haploidentiques et aussi lors de transplantations avec des donneurs non apparentés ayant une incompatibilité partielle avec les receveurs [5–8]. Cependant, l’effet bénéfique des cellules NK alloréactives lors d’une transplantation de cellules souches n’a pas été corroboré par d’autres scientifiques [
16–
18]. En revanche, une étude démontre une augmentation de l’incidence de mortalité due aux infections chez les patients leucémiques qui ont reçu une transplantation allogénique ayant une alloréactivité des cellules NK contre les receveurs [
17]. Ces divergence de résultats pourraient être dues à la dose et au traitement de cellules transplantées, à l’âge et aux conditions cliniques du receveur ainsi qu’au traitement post-transplantation du patient. La présence de gènes KIR activateurs chez le donneur a été rapportée comme ayant des conséquences controversées [16, 18–
20]. Les résultats d’une de ces études montrent que c’est l’absence des gènes KIR activateurs dans le génome du donneur et non l’alloréactivité des cellules NK qui est responsable de l’amélioration des résultats de la transplantation [
21]. Ces études suggèrent une réévaluation du rôle de l’alloréactivité des cellules NK et de leurs KIR activateurs dans la détermination des conséquences de la transplantation de cellules souches allogéniques. Les recherches dans ce domaine devraient être très prioritaires car les résultats pourraient changer les pratiques cliniques courantes. |
Effet des cellules NK alloréactives contre les tumeurs solides Bien que des études montrent de façon claire l’effet anti-tumoral des cellules NK contre les leucémies, le potentiel de ces cellules contre les tumeurs solides et les tumeurs d’origine non hématopoïétique n’a pas encore été démontré. Les cellules NK peuvent tuer plusieurs types de cellules tumorales lors d’expériences in vitro, mais paradoxalement ne sont pas très efficaces pour réduire la croissance des tumeurs in vivo. Un des problèmes majeurs à résoudre tient à la faible infiltration des cellules NK à l’intérieur des masses tumorales. Toutes les tumeurs ne sont pas infiltrées de façon équivalente par les cellules NK [
22,
23]. Beaucoup d’efforts ont été consacrés pour augmenter l’infiltration et l’activité anti-tumorale des cellules NK par des modificateurs de la réponse biologique (MRB) comme l’IL-2. L’effet activateur de ces MRB permet une véritable accumulation des cellules NK autour et à l’intérieur des nodules tumoraux [
24,
25]. Outre le problème d’infiltration des cellules NK, certaines tumeurs peuvent relâcher les ligands solubles de certains récepteurs NK comme les protéines MIC [
26]. Ces ligands solubles se lient et réduisent l’action du récepteur NKG2D à la surface des cellules NK (Figure 2). Les cellules tumorales expriment souvent de novo les ligands du NKG2D à leur surface, ce qui explique le rôle important joué par NKG2D dans l’élimination des cellules tumorales par les cellules NK. Les conditions immunosuppressives qui prévalent chez les patients atteints de cancers peuvent aussi réduire les fonctions des cellules NK en régulant négativement l’expression des récepteurs activateurs. Mais, les patients atteints d’un cancer expriment souvent un niveau faible de certains récepteurs activateurs (par exemple NCR) sur leurs cellules NK [
27]. Finalement, certaines tumeurs peuvent échapper aux cellules NK en réduisant de façon différentielle leurs CMH-I. Elles peuvent réduire l’expression des molécules CMH-I (HLA-A, HLA-Bw6) principalement impliquées dans leur reconnaissance par les CTL tout en laissant à leur surface les CMH-I reconnus par les cellules NK (HLA-C, HLA-Bw4) [
28]. Elles peuvent également augmenter l’expression de HLA-G et HLA-E pour inhiber l’activité des cellules NK [
29,
30]. |
Le recours aux cellules NK allogéniques vient stimuler l’élaboration de nouvelles stratégies immunothérapeutiques. Leur alloréactivité révélée dans les transplantations haplo-identiques a permis l’établissement de critères spécifiques concernant la sélection d’un donneur potentiel. Certaines approches pourraient viser à augmenter leur effet cytolytique contre les cellules tumorales solides. À titre d’exemple, une équipe de chercheurs a modifié génétiquement des cellules NK afin de les cibler spécifiquement contre les cellules tumorales[
31]. Certaines études révèlent que l’inhibition des récepteurs inhibiteurs par des anticorps contre le CMH-I renforce l’effet anti-tumoral des cellules NK [
32]. Finalement, la clé d’une meilleure thérapie réside aussi dans la création d’un microenvironnement tumoral propice pour que les cellules NK puissent infiltrer la masse tumorale et atteindre leurs cibles. Avec ces nouvelles approches et découvertes, le futur de l’immunothérapie de cellules de NK contre le cancer semble très prometteur. |
Nous remercions tous nos collègues pour leurs discussions et leurs conseils qui ont aidé à la rédaction de ce manuscrit, ainsi que les organismes de subventions IRSC et FRSQ.
|
Footnotes |
1. Karre K, Ljunggren HG, Piontek G, et al. Selective rejection of H-2-deficient lymphoma variants suggests alternative immune defence strategy. Nature 1986; 319 : 675–8. 2. Ahmad A, Alvarez F. Role of NK and NKT cells in the immunopathogenesis of HCV-induced hepatitis. J Leuk Biol 2004; 76 : 743–59. 3. Lanier LL. NK Cell Recognition. Annu Rev Immunol 2005; 23 : 225–74. 4. Katz G, Gazit R, Arnon T, et al. MHC class I independent recognition of NK activating receptor KIR2DS4. J Immunol 2004; 173 : 1819–25. 5. Ruggeri L, Capanni M, Casucci M, et al. Role of natural killer cell alloreactivity in HLA-mismatched hematopoietic stem cell transplantation. Blood 1999; 94 : 333–9. 6. Ruggeri L, Capanni M, Urbani E, et al. Effectiveness of donor natural killer cell alloreactivity in mismatched hematopoietic transplants. Science 2002; 295 : 2097–100. 7. Giebel S, Locatelli F, Lamparelli T, et al. Survival advantage with KIR ligand incompatibility in hematopoietic stem cell transplantation from unrelated donors. Blood 2003; 102 : 814–9. 8. Ruggeri L, Mancusi A, Capanni M, et al. Exploitation of alloreactive NK cells in adoptive immunotherapy of cancer. Curr Opin Immunol 2005; 17 : 211–7. 9. Cudkowicz G, Bennett M. Peculiar immunobiology of bone marrow allografts. II. Rejection of parental grafts by resistant F 1 hybrid mice. J Exp Med 1971; 135 : 1513–28. 10. Ogasawara K, Benjamin J, Takai R, et al. A role for NKG2D in NK cell-mediated rejection of mouse bone marrow grafts. Nat Immunol 2005; 6 : 938–45. 11. Lundqvist A, McCoy JP, Samsel L, et al. Reduction of GvHD and enhanced anti-tumor effects after adoptive infusion of alloreactive Ly49-mismatched NK-cells from MHC-matched donors. Blood 2007; 109 : 3603–6. 12. Coupel S, Moreau N, Hamidou M, et al. Expression and release of soluble HLA-E is an immunoregulatory feature of endothelial cell activation. Blood 2006; online 19 décembre. 13. Chan GW, Gorgun G, Miller KB, Foss FM. Persistence of host dendritic cells after transplantation is associated with graft versus host disease. Biol Blood Marrow Transpl 2003; 9 : 170–6. 14. Barber DF, Faure M, Long EO. LFA-1 contributes an early signal for NK cell cytotoxicity. J Immunol 2004; 173 : 3653–9. 15. Caligiuri MA, Velardi A, Scheinberg DA, et al. Immunotherapeutic approaches for hematologic malignancies. Hematology 2004; 337–53. 16. Hsu KC, Keever-Taylor CA, Wilton A, et al. Improved outcome in HLA-identical sibling hematopoietic stem cell transplantation for acute myelogenous leukemia predicted by KIR and HLA genotypes. Blood 2005; 105 : 4878–84. 17. Schaffer M, Malmberg KT, Ringden O, et al. Increased infection-related mortality in KIR ligand mismatched unrelated allogeneic transplantation in AML. Transplantation 2004; 78 : 1081–5. 18. Davies SM, Ruggieri L, DeFor T, et al. Evaluation of KIR ligand incompatibility in mismatched unrelated donor hematopoietic transplants. Blood 2002; 100 : 3825–7. 19. Giebel S, Nowak I, Wojnar J, et al. Impact of activating killer immunoglobulin-like receptor genotype on outcome of unrelated donor-hematopoietic cell transplantation. Transplant Proc 2006; 38 : 287–91. 20. Verheyden S, Scots S, Duguet W, Demanet C. A defined donor activating natural killer cell receptor genotype protects against leukemia relapses after related identical hematopoietic stem cell transplantation. Leukemia 2005; 19 : 1446–51. 21. Kroger N, Binder T, Zabelina T, et al. Low number of donor activating killer immunoglobulin-like receptor (KIR) genes but not KIR-ligand mismatch prevents relapses and improves disease-free survival in leukemia patients after in vivo T cell-depleted unrelated stem cell transplantation. Transplantation 2006; 82 : 1024–30. 22. Albertsson PA, Basse PH, Hokland M, et al. NK cells and the tumour microenvironment: implications for NK-cell function and anti-tumour activity. Trends Immunol 2003; 24 : 603–9. 23. Ishigami S, Natsugoe S, Tokuda K, et al. Prognostic value of intratumoral natural killer cells in gastric carcinoma. Cancer 2000; 88 : 577–83. 24. Lee SG, Heo DS, Yoon S, et al. Effect of GM-CSF and IL-2 co-expression on anti-tumor immune response. Anticancer Res 2000; 20 : 2681–6. 25. Son YI, Dallal RM, Mailliard RB, et al. Interleukin-18 (IL-18) synergizes with IL-2 to enhance cytotoxicity, interferon-gamma production, and expansion of natural killer cells. Cancer Res 2001; 61 : 884–8. 26. Salih HR, Antropius A, Gieseke F, et al. Functional expression and release of ligands for the activating immunoreceptor NKG2D in leukemia. Blood 2003; 102 : 1389–96. 27. Fauriat C, Just-Landi S, Mallet F. Deficient expression of NCR in NK cells from acute myeloid leukemia: evolution during leukemia treatment and impact of leukemic cells in NCR dull phenotype induction. Blood 2007; 109 : 323–30. 28. Demanet C, Moulder A, Denevers A. Downregulation of HLA-A and HLA-Bw6, but not HLA-Bw4 allospecificities, in leukemia cells: an escape mechanism from CTL and NK attack ? Blood 2004; 15 : 3122–30. 29. Bukur J, Rebmann V, Gross-Wilde H, et al. Functional role of human leukocyte antigen-G up-regulation in renal cell carcinoma. Cancer Res 2003; 63 : 4107–11. 30. Tripathy P, Agarwal S. Non classical HLA-G antigen and its role in the cancer progression. Cancer Invest 2006; 24 : 178–86. 31. Imai C, Iwamoto S, Campana D. Genetic modification of primary natural killer cells overcomes inhibitory signals and induces specific killing of leukemic cells. Blood 2005; 106 : 376–83. 32. Koh CY, Blazar BR, George T, et al. Augmentation of antitumor effects by NK cell inhibitory receptor blockade in vitro and in vivo. Blood 2001; 97 : 3132–7. |