La sérotonine est un neurotransmetteur qui joue un rôle essentiel dans la régulation de l’humeur. Dans le contexte de nombreux troubles psychiatriques comme la dépression, la conduite suicidaire, l’anxiété, l’agressivité, l’addiction et la schizophrénie, un dysfonctionnement des systèmes sérotoninergiques est observé. L’activité de ces systèmes est étroitement contrôlée par la recapture dans le neurone présynaptique de la sérotonine libérée dans le milieu extracellulaire grâce un transporteur de haute affinité dépendant du Na+ et du Cl- : le transporteur de la sérotonine ou SERT [ 1]. Le SERT est une cible majeure des antidépresseurs (inhibiteurs spécifiques de la recapture de sérotonine et inhibiteurs mixtes de recapture de sérotonine et de noradrénaline) et de certaines drogues d’abus comme la cocaïne, l’amphétamine et l’ecstasy [1, 2].
La régulation spatio-temporelle de l’activité des transporteurs des neurotransmetteurs fait intervenir des réseaux de protéines qui interagissent avec leurs domaines intracellulaires. Ainsi, différents partenaires protéiques du SERT ont été identifiés au cours des dernières années, le plus souvent grâce à des expériences de double-hydride réalisées chez la levure. Dans une étude venant d’être publiée dans Proc Natl Acad Sci USA [ 3], notre équipe de l’Institut de Génomique Fonctionnelle de Montpellier, associée à la division de Psychopharmacologie de l’Institut de Recherche Servier, a mis en œuvre une approche protéomique pour identifier de façon globale les protéines qui interagissent avec l’extrémité carboxy-terminale du SERT, domaine encore peu exploré du point de vue des interactions. Cette approche, fondée sur des expériences de chromatographie d’affinité utilisant un peptide synthétique comme appât et sur l’identification des protéines retenues par affinité grâce à la spectrométrie de masse MALDI-TOF, a permis l’identification de plusieurs nouveaux partenaires potentiels du SERT.
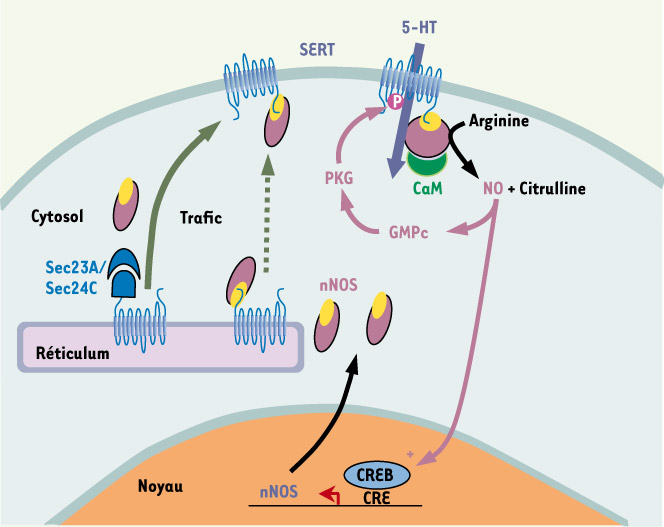
Parmi ceux-ci, nous nous sommes focalisés sur une des trois enzymes à l’origine de la production de monoxyde d’azote (NO), la NO-synthase neuronale (nNOS), en raison de son implication dans la régulation de l’humeur et des connexions déjà décrites entre les systèmes sérotoninergiques et nitridergiques. Ainsi, les souris chez lesquelles le gène codant pour la nNOS a été invalidé (nNOS−/− ) ont des conduites agressives et impulsives [ 4]. Ces troubles comportementaux sont associés à une altération de la neurotransmission sérotoninergique. De plus, la nNOS est co-exprimée avec le SERT dans la majorité des neurones sérotoninergiques [ 5]. Enfin, plusieurs études ont mis en évidence une modulation de l’activité du SERT par le NO. En stimulant la production de GMPc et la protéine kinase G (PKG), le NO induit la phosphorylation du SERT sur un résidu thréonine, un processus à l’origine d’une augmentation de son activité intrinsèque et de la recapture de sérotonine [ 6]. À l’inverse, à fortes concentrations, le NO induit une S-nitrosylation du transporteur sur des résidus cystéine, inhibant ainsi la recapture de sérotonine [ 7].
L’analyse fonctionnelle de l’interaction physique entre la nNOS et le SERT, réalisée dans un premier temps dans une lignée cellulaire, a permis de démontrer que celle-ci était à l’origine d’une diminution de l’expression du transporteur à la surface cellulaire et de la recapture de sérotonine [3]. De plus, contrairement aux schémas existants, cet effet était indépendant de l’activité catalytique de la nNOS et de la production de NO. Nous avons par la suite établi l’existence de cette régulation in vivo grâce à l’utilisation d’un peptide mimétique de l’extrémité carboxy-terminale du SERT, qui inhibe par compétition l’interaction entre le SERT et la nNOS. La fusion du peptide avec le domaine de transduction de la protéine TAT du VIH a permis son internalisation cellulaire. Un traitement de cultures de neurones issus du mésencéphale de souris par le peptide provoque une augmentation de la recapture de sérotonine alors qu’un peptide contrôle, qui n’inhibe pas l’interaction entre le transporteur et la NOS, ne modifie pas la vitesse de recapture de sérotonine. Enfin, l’injection intraveineuse du peptide mimétique chez la souris, qui est suivie de la pénétration du peptide dans les différentes régions du cerveau, provoque une augmentation de la recapture de sérotonine mesurée dans des synaptosomes, analogue à celle mesurée chez les souris nNOS−/− . Le mécanisme impliqué dans l’inhibition de l’adressage du SERT à la membrane plasmique induite par son contact physique avec la nNOS reste à démontrer. Cette inhibition pourrait résulter d’une compétition entre la nNOS et le complexe COPII impliqué dans l’export du réticulum endoplasmique des protéines membranaires nouvellement synthétisées, pour s’associer au SERT. En effet, deux sous-unités du complexe COPII, Sec23A et Sec24C, ont également été identifiées grâce au test protéomique mis en œuvre, et ces protéines sont recrutées par des motifs du domaine carboxy-terminal du transporteur également impliqués dans l’interaction avec la nNOS.
Notre étude montre également que l’interaction entre le SERT et la nNOS est à l’origine d’une régulation « réciproque » de l’activité fonctionnelle des deux partenaires. Ainsi, le contact physique entre les deux protéines permet une activation de la nNOS lors de la recapture de la sérotonine. De façon assez inhabituelle pour cette isoforme de NOS, cette activation a lieu indépendamment d’une augmentation du Ca2+ cytosolique, mais dépend de la calmoduline, à l’image de ce qui a été observé pour les autres formes de NOS [ 8]. Ce processus constitue un des tout premiers exemples d’une signalisation intracellulaire déclenchée, non pas par un récepteur, mais par un transporteur. Un phénomène analogue a été mis en évidence il y a quelques années dans les plaquettes [ 9]. Ainsi, la recapture plaquettaire de sérotonine est à l’origine de la transamidation des petites protéines G RhoA et Rab4 (un processus également appelé sérotonylation) qui conduit à l’exocytose des granules de sécrétion.