Les tumeurs solides représentent l’immense majorité des cancers chez l’adulte, avec une mortalité due principalement aux rechutes par métastase. Les approches thérapeutiques conventionnelles basées sur la chimiothérapie restent trop souvent inefficaces. Depuis quelques années, l’immunothérapie des cancers se développe [ 1] et la mise au point de traitements par vaccination est un enjeu majeur pour les années à venir. Le transfert adoptif de cellules effectrices spécifiques de tumeur est une stratégie thérapeutique qui s’est révélée parfois efficace chez l’homme [1]. Il semble que la taille des tumeurs au moment du transfert ainsi que la quantité de cellules transférées soient critiques dans l’efficacité du rejet [ 2, 3].
Grâce à la microscopie bi-photonique, certains chercheurs ont pu décrire des différences de mouvement des cellules tumorales, fonction du caractère plus ou moins métastatique du modèle étudié [ 4]. En revanche, très peu d’informations existent sur la dynamique des cellules T cytotoxiques in vivo, alors même que ces cellules jouent un rôle capital dans le rejet des tumeurs. Il est donc important de caractériser le comportement de ces cellules effectrices afin de déterminer quels sont les paramètres qui déterminent leur activité cytotoxique. Nous avons développé pour cela un système expérimental dans lequel il est possible de suivre par vidéo microscopie bi-photonique la dynamique du rejet in vivo d’une tumeur solide par les lymphocytes T après leur transfert adoptif [ 5].
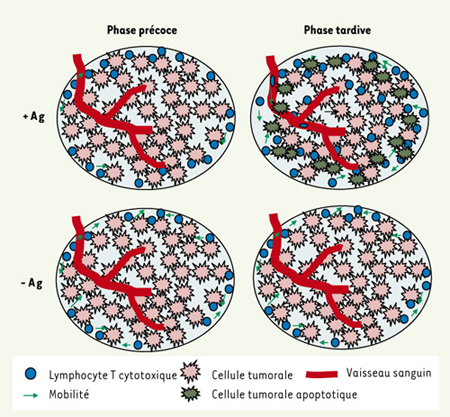
Nous avons utilisé un modèle murin de réponse immunitaire anti-tumorale, induite par un thymome exprimant un antigène recombinant, l’ovalbumine. Selon que les tumeurs expriment (EG7) ou non (EL4) l’ovalbumine, nous avons suivi la réponse des lymphocytes T cytotoxiques depuis leur activation dans les organes lymphoïdes secondaires jusqu’à leur infiltration dans la tumeur. Après injection sous-cutanée des deux types de tumeur, dans chaque flanc d’une même souris et après croissance de ces tumeurs, des lymphocytes T transgéniques spécifiques de l’ovalbumine (OT-1) sont transférés dans ces souris. Ces lymphocytes T infiltrent les deux tumeurs, mais ne rejettent que la tumeur exprimant l’antigène ovalbumine. Cette observation montre que l’environnement inflammatoire induit au niveau des tumeurs est suffisant pour permettre l’infiltration des lymphocytes activés et que la présence d’antigènes spécifiques des lymphocytes injectés n’est pas nécessaire. En effet, après activation dans les ganglions, les lymphocytes modifient leur profil d’expression d’un certain nombre de molécules d’adressage dont les récepteurs aux chimiokines qui leur permettent de migrer vers un site inflammatoire [ 6]. Cependant, la densité de lymphocytes T est plus importante dans la tumeur exprimant l’ovalbumine que dans la tumeur ne l’exprimant pas, suggérant que cet antigène retient les cellules dans le tissu tumoral, et qu’en son absence, les cellules quittent la tumeur ou meurent. Par ailleurs, les lymphocytes T peuvent se diviser, et donc proliférer, au sein de la tumeur, raison supplémentaire de leur accumulation préférentielle dans la tumeur exprimant l’antigène.
Notre approche, à l’échelle cellulaire de l’infiltration tumorale, nous a permis de distinguer deux phases dans le rejet de la tumeur. Une phase précoce qui correspond à l’infiltration des lymphocytes T cytotoxiques sans régression mesurable de la masse tumorale (3 à 4 jours après le transfert adoptif d’OT-1) et une phase plus tardive qui correspond à une période de régression tumorale, mais avant que celle-ci ne soit complète (5 à 6 jours après le transfert adoptif). Durant la phase précoce du rejet de la tumeur, les lymphocytes infiltrants sont peu mobiles, ils s’arrêtent fréquemment et ils n’explorent qu’un espace limité. Ces lymphocytes T établissent des contacts stables et de longue durée avec les cellules tumorales. En revanche, durant la phase tardive, dans les zones où les cellules tumorales ont été détruites et où ne persistent que les corps apoptotiques, les lymphocytes T reprennent une mobilité normale, comparable à celle qui est observée dans la tumeur n’exprimant pas l’ovalbumine.
En analysant in vivo les profils de migration des lymphocytes dans la matrice tumorale, nous avons pu confirmer certains résultats obtenus in vitro lors de la migration de lymphocytes T dans des matrices de collagène [ 7]. Les lymphocytes adaptent continuellement leur morphologie aux contraintes du microenvironnement tumoral. C’est ainsi que les lymphocytes recherchent activement des cellules tumorales résiduelles au sein de la matrice tumorale, en se déformant pour passer à travers les mailles denses du réseau de collagène. De façon plus inattendue, nous avons observé que les lymphocytes T présentent une affinité particulière pour les vaisseaux sanguins et qu’ils sont capables de migrer le long des vaisseaux sur des distances importantes (plus de 100 µm), tout en adoptant une morphologie plus fusiforme.
Afin d’étendre plus en profondeur l’analyse topographique de l’infiltration des lymphocytes, au-delà des limites d’observation par microscopie bi-photonique, nous avons reconstitué le processus d’infiltration des lymphocytes T par des techniques d’immuno-histologie classiques. Cela nous a permis de voir que, durant la phase précoce, les lymphocytes T colonisent la tumeur par la périphérie, indépendamment de l’expression par les cellules tumorales, de l’antigène spécifique des lymphocytes T. En revanche, l’infiltration en profondeur des tumeurs par les lymphocytes T n’est observée que pour les tumeurs qui expriment l’antigène. Cette infiltration localisée se traduit par une élimination de la masse tumorale débutant par la périphérie.