| |
| Med Sci (Paris). 2007 June; 23(6-7): 579–580. Published online 2007 June 15. doi: 10.1051/medsci/20072367579.Ô miroir, dis-moi comment les amines effacent les rides La cytopathologie vacuolaire médiée par la V-ATPase Guillaume Morissette and François Marceau* Centre de recherche en rhumatologie et immunologie, CHUL-CHUQ, Département de médecine, Faculté de médecine, Université Laval, 2705, boulevard Laurier, Québec (Québec), G1V 4G2 Canada MeSH keywords: Amines, Cosmétiques, Humains, Peau, Vieillissement de la peau, Vacuolar Proton-Translocating ATPases |
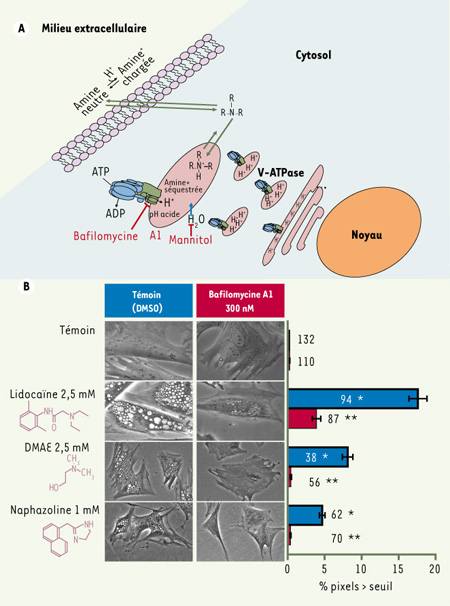
La pharmacopée moderne comprend de nombreuses amines organiques réparties dans plusieurs classes thérapeutiques. Au pH physiologique, ces bases faibles se distribuent entre leur forme protonée et leur forme neutre. Cette dernière pénètre plus facilement les cellules par diffusion simple avant d’être séquestrée dans différents compartiments cellulaires. Dans les organites acides, les amines seront protonées et séquestrées, puisque la forme chargée est peu rétrodiffusible (figure 1A) [
1]. L’accumulation des amines organiques conduit à une vacuolisation osmotique qui est initialement périnucléaire et dont l’analyse morphologique a montré qu’elle concerne au moins le trans-Golgi [
2,
3]. Cette cytopathologie est prévenue ou renversée par la bafilomycine A1 [2–
4], un macrolide inhibiteur de la pompe à proton V-ATPase (vacuolar-ATPase) essentielle à l’acidification des organites (figure 1) [
5]. La V-ATPase est une machine moléculaire complexe distribuée principalement dans le trans-Golgi et les organites qui en dérivent, comme les endosomes, lysosomes et granules sécrétoires [5], et il est très plausible que la consommation d’ATP requise pour maintenir l’acidité dans ces organites soit indirectement le moteur de la concentration des amines organiques [1–4]. Si la séquestration des cations dépendante de la V-ATPase et la vacuolisation cellulaire qui en découle ne représentaient qu’un transport de faible affinité, on pourrait croire que le phénomène n’a qu’un intérêt toxicologique. Cependant, certains agents sont administrés de façon locale ou topique à de fortes concentrations (mM) correspondant à cette affinité.  | Figure 1.
A. Représentation schématique de la séquestration cellulaire d’amines organiques par des organites acides possédant la V-ATPase (représentée selon [ 5]) avec gonflement osmotique de ces compartiments (vacuolisation). B. Vacuolisation des cellules de muscle lisse d’aorte de lapin induite par 4 h de traitement avec la lidocaïne, le DMAE ou la naphazoline, réponse inhibée par un co-traitement avec la bafilomycine A1, un inhibiteur de la V-ATPase. À gauche : microscopie à contraste de phase; grossissement original x100-200. À droite : quantification de la vacuolisation (méthodes [ 3, 4]). Le nombre de cellules évaluées sous chaque condition est indiqué. Test de Mann-Whitney : *p < 0,001 versus témoin ; **p < 0,001 versus amine seule. |
|
Plusieurs crèmes anti-rides qui possèdent des effets «liftants instantanés » contiennent des amines secondaires ou tertiaires (diméthylaminoéthanol (DMAE), triéthanolamine, méthyl-diéthanolamine, etc.) à des concentrations pouvant atteindre 25 %. Des données cliniques objectives existent sur l’effet anti-ride d’un gel facial de DMAE 3 % (337 mM) [
6]. Des travaux récents de notre groupe ont démontré que le DMAE induit la vacuolisation cellulaire dépendante de la V-ATPase in vitro (> 1 mM, appliqué pendant 30 minutes ou plus) (figure 1B) dans les fibroblastes dermiques de lapin, l’épithélium cutané humain [4] et le muscle lisse en culture (figure 1B). La morphologie vacuolaire est lentement réversible. Un épaississement de l’épiderme et une présence de cellules vacuolaires in vivo, après l’application de DMAE (3 %, 1 h) sur la surface interne de l’oreille de lapin, ont été observés (coupes histologiques) [4]. Nous avons proposé comme interprétation que la base cellulaire de l’effet anti-ride très rapide des amines appliquées sous la forme d’une crème persistante constitue une expansion cellulaire vacuolaire médiée par la V-ATPase, plutôt que le résultat d’une hypothétique interférence avec la transmission nerveuse cholinergique, proposée sans base expérimentale dans le passé [6]. Les effets cosmétiques pourraient malheureusement ne pas être dissociables de conséquences néfastes de la cytopathologie vacuolaire. En effet, le DMAE induit un arrêt mitotique associé transitoirement à des changements de ploïdie (légère augmentation de la phase G2/M dans les premières 6 heures) [4]. Les amines tertiaires concentrées, notamment le DMAE, causent une certaine cytotoxicité (la mort d’une fraction des cellules en 24 h peut être causée par la fragilisation des organites distendus ou par leur paralysie fonctionnelle) et un arrêt de la migration des protéines le long de la voie sécrétoire, des réponses inversées par la bafilomycine A1 et donc dépendantes de la V-ATPase [3, 4]. |
La séquestration des amines organiques et la cytopathologie qui en découle sont des phénomènes plutôt méconnus. Or, ils pourraient s’appliquer à des médicaments conventionnels. Les anesthésiques locaux, comme la lidocaïne, sont injectés à des concentrations de l’ordre de 1-10 % (42-420 mM) dans des espaces anatomiquement confinés afin d’inhiber la conduction nerveuse. Ce médicament induit aussi in vitro la cytopathologie vacuolaire dépendante de la V-ATPase et ce, à une concentration bien inférieure à celle injectée (figure 1B). De plus, l’application sur les muqueuses (nez, pharynx, oreille moyenne, conjonctive de l’œil) de solutions concentrées d’agonistes α-adrénergiques (naphazoline, etc.) à des fins de décongestion ou d’action mydriatique (phényléphrine 10 % = 491 mM) cause aussi la vacuolisation, comme on l’a rapporté dans des tissus oculaires exposés in vivo à la lidocaïne ou à la phénylephrine [
7,
8]. À partir de nos travaux, il est plausible que ces effets soient explicables par la séquestration des amines médiée par la V-ATPase (Figure 1B, effet cellulaire de la naphazoline). Il sera important de déterminer si de tels réservoirs influencent la durée d’action des médicaments par un relargage lent, limitent la distribution et modifient les propriétés pharmacocinétiques, la toxicité et l’efficacité des agents concernés. Un mode de distribution cellulaire peu connu des amines xénobiotiques se cache derrière le miroir - celui de l’armoire à pharmacie où voisinent cosmétiques et médicaments. |
1. Moriyama Y. Membrane energization by proton pumps is important for compartmentalization of drugs and toxins: a new type of active transport. J Exp Biol 1996; 199 : 1447–54. 2. Morissette G, Moreau EC, Gaudreault R, Marceau F. Massive cell vacuolization induced by organic amines such as procainamide. J Pharmacol Exp Ther 2004; 310 : 395–406. 3. Morissette G, Moreau EC, Gaudreault R, Marceau F. N-Substituted 4-aminobenzamides (procainamide analogs): an assessment of multiple cellular effects concerning ion trapping. Mol Pharmacol 2005; 68 : 1576–89. 4. Morissette G, Germain L, Marceau F. The anti-wrinkle effect of topical concentrated 2-dimethylaminoethanol involves a vacuolar cytopathology. Br J Dermatol 2007; 156 : 433–9. 5. Breton S, Brown D. New insights into the regulation of V-ATPase-dependent proton secretion. Am J Physiol Renal Physiol 2007; 292 : F1–10. 6. Grossman R. The role of dimethylaminoethanol in cosmetic dermatology. Am J Clin Dermatol 2005; 6 : 39–47. 7. Atilla H, Tekeli O, Can B, et al. Effects of intracameral lidocaine on ocular tissues. Clin Exp Ophthalmol 2003; 31 : 73–7. 8. Cohen KL, Van Horn DL, Edelhauser HF, Schultz RO. Effect of phenylephrine on normal and regenerated endothelial cells in cat cornea. Invest Ophthalmol Vis Sci 1979; 18 : 242–9. |