| |
| Med Sci (Paris). 2007 June; 23(6-7): 585–587. Published online 2007 June 15. doi: 10.1051/medsci/20072367585.Quand la lumière contrôle l’activité neuronale et le comportement Laurent Groc* and Daniel Choquet Unité « Physiologie Cellulaire de la Synapse », UMR 5091 CNRS, Université Bordeaux 2, Bordeaux 33077, France MeSH keywords: Animaux, ADN viral, Humains, Réseau nerveux, Neurones |
« Si l’on pouvait regarder à travers la voûte crânienne et si la zone à excitabilité optima était éclairée, on découvrirait sur un être pensant le déplacement incessant de ce point lumineux »
Ivan Petrovitch Pavlov, 1927
Parmi les rêves qui foisonnent dans la tête des neuroscientifiques figure en bonne place celui d’observer le fonctionnement du cerveau, ou encore mieux de contrôler l’activité des neurones, à l’aide de lumière maîtrisée. La lumière maîtrisée en microscopie du vivant est principalement utilisée comme moyen d’observation [
1], depuis la morphologie générale des neurones jusqu’au mouvement de protéines uniques [
2]. Le tour de force technologique de l’équipe de K. Deisselroth, publié dans la revue Nature [
3], montre que l’association d’approches de biologie moléculaire et d’optique permet de moduler l’activité neuronale, et par la même le comportement d’organismes vivants. Quand le rêve devient lumière !  | Figure 1.
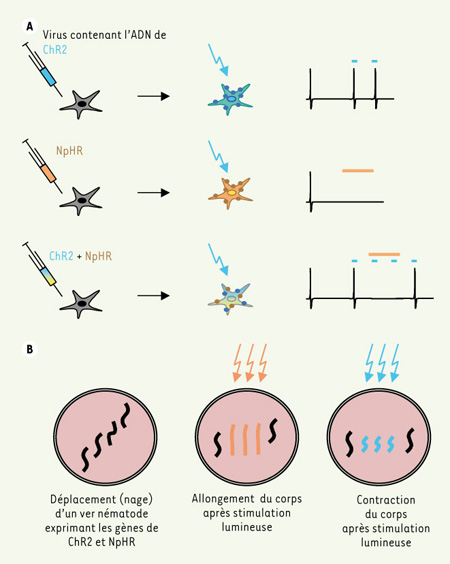
Modulation de l’activité neuronale par la lumière. A. L’infection de neurones par des virus contenant l’ADN de ChR2 (bleu) et NpHR (orange) permet l’expression de ces canaux au niveau de la membrane plasmique des neurones. L’activation transitoire et réversible de ces canaux par un faisceau lumineux dont la longueur d’onde est précisément choisie permet soit l’excitation (ChR2, bleu), soit l’inhibition (NpHR, orange) du neurone. L’expression des deux types de canaux au sein du même neurone permet de contrôler à la fois l’excitation et l’inhibition du neurone. B. Le développement de vers nématodes transgéniques exprimant les canaux ChR2 (vers bleus) et NpHR (vers oranges) au sein de muscles locomoteurs, ou de neurones innervant ces muscles locomoteurs, permet un contrôle instantané et réversible du comportement du ver à la suite de l’illumination de l’animal. |
|
Comment activer ou inhiber rapidement un ensemble de neurones avec de la lumière ? La question peut sembler simple, mais chaque mot cache une difficulté expérimentale de taille. Les neurones sont des cellules excitables qui reçoivent et émettent des informations. Leur excitation ou inhibition dépend en grande partie de l’activation de récepteurs par des neuromédiateurs ou des variations du potentiel membranaire. Le principal neuromédiateur excitateur du cerveau est le glutamate. Lorsque du glutamate est libéré par un neurone au niveau d’une synapse (zone de connexion entre neurones), il active les récepteurs glutamatergiques présents dans la membrane du neurone opposé, ce qui entraîne une dépolarisation du neurone et possiblement la génération de potentiels d’action. Afin de contrôler l’activité d’un neurone ou d’une synapse particulière, une des approches développées au cours de la dernière décennie a consisté à bloquer l’activité des molécules de glutamate à l’aide de cages chimiques sensibles à la lumière [
4]. Lors d’une stimulation lumineuse dans l’ultraviolet, la cage se défait, le glutamate est libéré, les récepteurs glutamatergiques sont activés, et le neurone excité. Cette approche permet donc d’activer un neurone, mais peut poser problème lorsque l’expérimentateur cherche à contrôler l’activité d’un ensemble de neurones. Entre autres, cela nécessite la libération de glutamate dans un grand volume contenant les neurones d’intérêt, et entraîne une activation massive, et excessive, de tous les récepteurs glutamatergiques membranaires. Or, cette situation est représentative d’un état pathologique observé, par exemple, lors d’accidents cérébraux vasculaires. Il fallait donc trouver une alternative à l’utilisation de neurotransmetteurs « encagés », qu’ils soient excitateurs ou inhibiteurs, pour activer des ensembles neuronaux. |
C’est de la diversité des organismes vivants qu’une solution a émergé En effet, il existe des récepteurs qui s’activent après stimulation lumineuse. Par exemple, les récepteurs rhodopsine sont présents dans la rétine, le phytochrome des plantes, et dans des cellules procaryotes. Le canal membranaire rhodopsine-2 (ChR2), qui est exprimé chez l’algue Chlamydomonas reinhardtii, répond à ces caractéristiques puisque, en présence du co-agoniste nécessaire rétinoïde, une stimulation lumineuse produit un flux de cations (ions chargés positivement) à travers le canal [
5]. De telles propriétés ont fait de ChR2 une protéine de choix pour pouvoir moduler le potentiel de membrane et donc l’activation de neurones. ChR2 n’étant pas exprimé dans les neurones, Zhang et al. [3] ont utilisé des lentivirus contenant l’ADNc codant ChR2 pour infecter et exprimer ChR2 dans les neurones d’intérêt [
6,
7] (Figure 1A). Cette étape, qui pourrait apparaître à première vue contraignante, s’avère en fait présenter un double avantage. Premièrement, elle permet de cibler, si besoin est, une population neuronale spécifique, telle ou telle partie du cerveau par exemple. Deuxièmement, un rapporteur fluorescent introduit dans la construction ADN permet de visualiser les neurones infectés par ChR2, et donc excitables par un faisceau lumineux. Les neurones exprimant le ChR2 répondent à une stimulation lumineuse de très courte durée (~ 15 ms) par une dépolarisation membranaire (potentiel plus positif) et la genèse d’un potentiel d’action. L’effet excitateur est immédiat, et surtout réversible puisque l’arrêt de l’illumination conduit à un retour instantané au potentiel membranaire d’origine (Figure 1A). Nous sommes donc en présence de neurones répondant de façon réversible et très rapide à une stimulation lumineuse par une décharge de potentiel d’action. Au regard de la question d’origine, à savoir comment activer ou inhiber rapidement un ensemble de neurones avec de la lumière, subsiste donc le problème de l’inhibition des réseaux neuronaux. Question d’autant plus importante que les neurones en culture, ou a fortiori dans un animal vivant, sont actifs spontanément et que le seul moyen d’agir sur ces patrons d’activité spontanée est d’inhiber le neurone. En d’autres termes, induire 5 potentiels d’actions/minute dans un neurone qui en décharge spontanément 100 par minute aura peu d’effet et sera peu informatif. Le grand catalogue de constructions moléculaires présentes dans la nature a encore apporté une solution. Zhang et al. ont utilisé une halorhodopsine (NpHR) provenant du mico-organisme procaryote Natronomas pharaonis, et qui fonctionne comme pompe au chlore (ion chargé négativement) dont l’activité est dépendante de la lumière. À l’inverse du canal ChR2, l’activation du NpHR par la lumière induit une hyperpolarisation membranaire (potentiel plus négatif). La même stratégie d’infection virale, avec cette fois NpHR, a permis de montrer qu’une stimulation lumineuse des neurones contenant NpHR produit une inhibition rapide et réversible du neurone (Figure 1A). L’excitation et l’inhibition d’un neurone peuvent alors être contrôlées par l’expérimentateur. Un même neurone peut-il cependant être excité et inhibé séquentiellement puisque les deux processus nécessitent une même stimulation lumineuse ? La réponse est oui. C’est grâce à la différence des spectres d’excitation du ChR2 et du NpHR que cela est possible. En effet, le ChR2 est principalement activé par une lumière bleue (longueur d’onde ~ 460 nm) tandis que le NpHR est principalement activé par une lumière jaune (longueur d’onde ~ 580 nm) (Figure 1A). |
Quid de l’utilisation de ces systèmes de contrôle d’activité neuronale dans un cerveau d’animal actif ? Afin de répondre à cette question primordiale, les auteurs ont notamment testé leurs systèmes dans un organisme entier et vivant, le ver Caenorhabditis elegans. Pour ce faire, des vers transgéniques exprimant à la fois ChR2 et NpHR dans des sous-types cellulaires précis ont été développés. L’expression des canaux au niveau de muscles locomoteurs ou de neurones cholinergiques impliqués dans la contraction musculaire permet alors le contrôle instantané et réversible du mouvement ondulatoire du ver (Figure 1B). En d’autres termes, l’excitation ou l’inhibition de neurones du système nerveux intact d’un animal vivant et libre de ses mouvements peut être modulée par l’expérimentateur en fonction du type de lumière envoyée. L’utilisation de cette nouvelle technologie permet donc de contrôler précisément la fréquence de décharge d’un neurone (délai de moins de quelques millisecondes) et possède une grande reproductibilité dans l’induction de trains de potentiels d’action (plus de 98 %). De plus, l’expression de ces canaux dans des animaux transgéniques permet la modulation rapide et réversible de l’activité de réseaux neuronaux. Les perspectives d’une telle prouesse technologique sont presque aussi vastes que l’ensemble des fonctions du système nerveux, fusse-t-il celui d’un ver. L’utilisation de ces outils d’optique et de génétique permettra, à n’en pas douter, de disséquer le fonctionnement de nombreux réseaux neuronaux lors de tâches comportementales complexes, comme le système olfactif de cerveaux de rats [
8]. Quand le rêve des neuroscientifiques se rapproche de la lumière ! |
1. Lippincott-Schwartz J, Patterson GH. Development and use of fluorescent protein markers in living cells. Science 2003; 300 : 87–91. 2. Groc L, Choquet D. AMPA and NMDA glutamate receptor trafficking : multiple roads for reaching and leaving the synapse. Cell Tissue Res 2006; 326 : 423–38. 3. Zhang F, Wang LP, Brauner M, et al. Multimodal fast optical interrogation of neural circuitry. Nature 2007; 446 : 633–9. 4. Judkewitz B, Roth A, Hausser M. Dendritic enlightenment : using patterned two-photon uncaging to reveal the secrets of the brain’s smallest dendrites. Neuron 2006; 50 : 180–3. 5. Nagel G, Szellas T, Huhn W, et al. Channelrhodopsin-2, a directly light-gated cation-selective membrane channel. Proc Natl Acad Sci USA 2003; 100 : 13940–5. 6. Boyden ES, Zhang F, Bamberg E, et al. Millisecond-timescale, genetically targeted optical control of neural activity. Nat Neurosci 2005; 8 : 1263–8. 7. Zhang F, Wang LP, Boyden ES, et al. Channelrhodopsin-2 and optical control of excitable cells. Nat Methods 2006; 3 : 785–92. 8. Arenkiel BR, Peca J, Davison IG, et al. In vivo light-induced activation of neural circuitry in transgenic mice expressing channelrhodopsin-2. Neuron 2007; 54 : 205–18. |