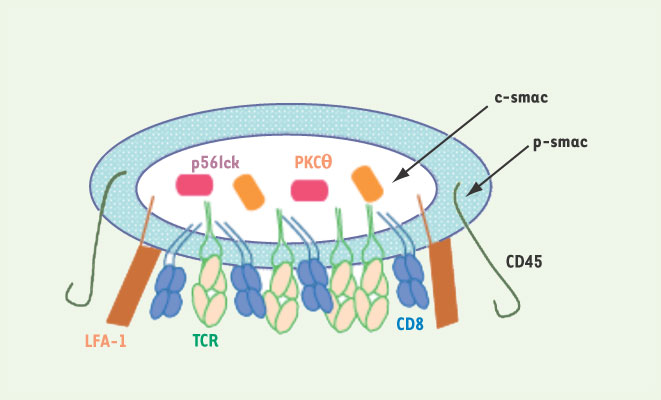
L’interaction des lymphocytes T naïfs avec des cellules présentatrices de l’antigène (CPA), communément les cellules dendritiques, dans les organes lymphoïdes secondaires, induit leur activation. La microscopie confocale a permis de mettre en évidence la ségrégation des molécules d’activation à l’interface entre le lymphocyte T et la CPA, une structure appelée « synapse immunologique » [ 1– 3] (Figure 1).
| Figure 1.
Synapse immunologique. La zone centrale de la synapse (c-smac) concentre notamment le récepteur à l’antigène (TCR) et les molécules CD3 associées, les co-récepteurs CD4 ou CD8, les protéines kinase PKCθ et p56lck ; à la périphérie de cette zone centrale, se trouvent les molécules d’adhérence LFA-1 et la taline ; enfin, une zone distale (p-smac) contient des molécules de grande taille telle la phosphatase CD45. Très tôt dans la formation de la synapse, il y a une polymérisation localisée du cytosquelette d’actine et le centre organisateur des microtubules (MTOC) se réoriente vers la synapse (non montré). |
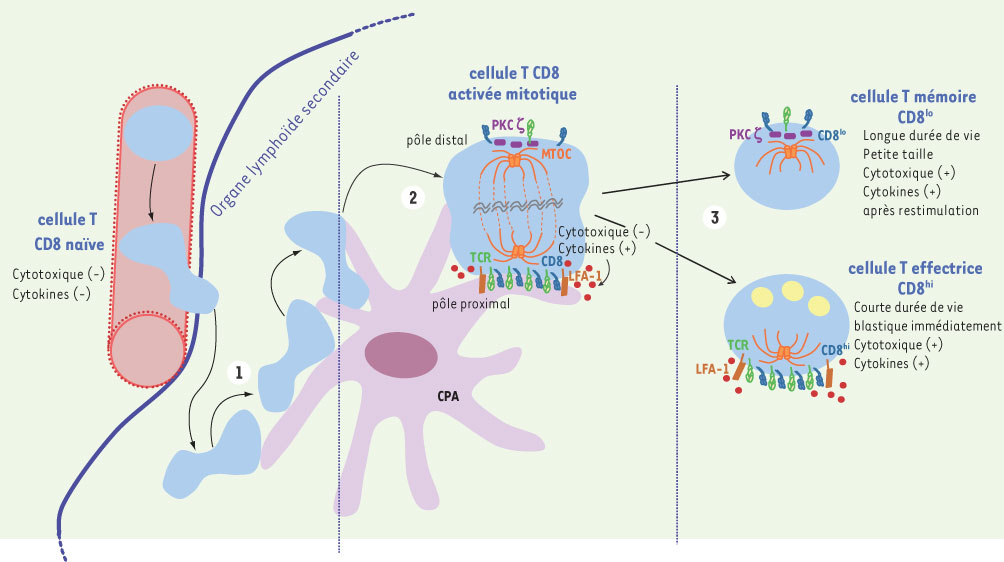
Par ailleurs, depuis 2002, plusieurs groupes ont utilisé les techniques de microscopie multiphotonique afin de visualiser, à l’intérieur d’un ganglion lymphatique intact, les déplacements des lymphocytes T et leur interaction avec les CPA en l’absence ou en présence de l’antigène (Ag) [ 4]. Les premières heures (0-6h) qui suivent l’entrée des lymphocytes dans un ganglion lymphatique sont caractérisées par des interactions de courte durée avec les CPA, qui induisent l’expression de marqueurs d’activation. La seconde phase (6-32h) implique une interaction de longue durée (> 1h) avec une CPA présentant l’Ag et l’initiation de la sécrétion de cytokines, en l’absence de division cellulaire. Dans la troisième phase, les lymphocytes T se détachent des CPA, prolifèrent et retrouvent une grande mobilité (Figure 2).
| Figure 2.
Cinétique d’activation et de différenciation des lymphocytes T CD8 mettant en jeu une division asymétrique. Les lymphocytes T migrent continuellement du sang vers les ganglions lymphatiques. Phase 1 : 0-6 h - Grande mobilité des lymphocytes T ; interactions de courte durée avec la CPA. Phase 2 : 6-32 h - Interaction stable (> 1 h) du lymphocyte T avec la CPA. La formation de la synapse immunologique induit l’activation de la cellule T (expression de marqueurs d’activation, sécrétion de cytokines) et son entrée en mitose : ségrégation asymétrique des molécules d’activation aux 2 pôles de la cellule. Phase 3 : 32-72 h - Le lymphocyte T redevient mobile. La division cellulaire engendre 2 cellules filles différentes : une cellule CD8hi exprimant un phénotype caractéristique de cellule T effectrice (contenant des granules cytotoxiques, représentés en jaune), et une cellule CD8lo ayant plutôt un phénotype de cellule T mémoire. |
L’activation des lymphocytes T induit un programme développemental incluant à la fois une phase d’expansion clonale et la différenciation des cellules T naïves en cellules T effectrices ou mémoires.
La généalogie des cellules mémoires est, encore à ce jour, sujet de controverses et 3 modèles sont proposés [ 5] :
- le premier propose une différenciation divergente des cellules effectrices et mémoires, qui serait influencée par la durée de la stimulation antigénique initiale [ 6] et les cytokines environnantes, notamment de type inflammatoire ;
- le second est une différenciation linéaire des cellules T d’abord en cellules effectrices, puis de façon ultime en cellules mémoires ;
- le troisième est une variation du modèle précédent, qui intègre en plus une relation inversement corrélée entre la durée de la stimulation antigénique et la capacité des cellules T à se différencier en cellules mémoires.
Jusqu’à présent, aucune étude n’avait fait le lien entre les évènements précoces qui surviennent au niveau de la synapse immunologique et les évènements tardifs qui régissent, après la phase d’expansion clonale, la différenciation en cellules T effectrices ou mémoires. Cependant, l’observation que les lymphocytes T restent en contact pendant plusieurs heures avec la CPA suggérait que cette interaction englobe la phase de mitose. Dans un numéro récent de Science [ 7], l’équipe de Steven Reiner propose que les cellules T effectrices et mémoires soient simultanément générées lors de la première mitose qui suit la reconnaissance de l’Ag selon un mécanisme de division asymétrique.
Des lymphocytes T exprimant un TCR (T cell receptor) spécifique d’un Ag de Listeria monocytogenes ont été marqués avec un composant fluorescent et injectés à une souris infectée. Trente-deux heures après leur transfert, les lymphocytes T qui, à ce stade, ne se sont pas encore divisés mais ont subi une augmentation de leur volume (phénotype de blastes) en réponse à leur activation, sont analysés en microscopie confocale. Dans la plupart de ces cellules T activées pré-mitotiques, le MTOC (microtubule-organizing center) co-localise avec les molécules LFA-1 (leukocyte function-associated antigen), CD8 et CD3 agrégées à un pôle du lymphocyte T, qui constitue les vestiges de la synapse immunologique. Au pôle opposé, on observe une concentration de la protéine kinase C ζ (PKCζ) - un composant impliqué dans la polarité cellulaire. Cette répartition moléculaire est maintenue dans les cellules T en cours de mitose. Ces résultats suggèrent que la signalisation émanant de la synapse immunologique induit une mitose asymétrique qui aboutit à une partition inégale des molécules dans les 2 cellules filles.
En suivant la prolifération de ces cellules T grâce au composé fluorescent qui se dilue à chaque division cellulaire, Chang et al. ont observé que les cellules T qui ont fait une seule division, 48h après leur transfert, peuvent être séparées en 2 sous-populations exprimant le co-récepteur CD8 à un fort (CD8hi) ou un faible (CD8lo) niveau [7]. Les auteurs suggèrent que ces 2 sous-populations proviennent des cellules filles générées respectivement au pôle proximal et au pôle distal de la synapse immunologique initiale. Après purification de ces 2 populations, les auteurs ont pu établir que la population CD8hi exprime un phénotype caractéristique de cellule T effectrice, tandis que la population CD8lo a plutôt un phénotype de cellule T mémoire. L’injection de l’une ou l’autre de ces populations cellulaires dans une souris hôte immédiatement infectée par Listeria monocytogenes permet de contrôler l’infection. En revanche, si l’infection de l’hôte survient 30 jours après le transfert des lymphocytes T, la population CD8hi est plus efficace que la population CD8lo pour contrôler cette infection tardive. Les auteurs suggèrent que les descendants d’un lymphocyte activé T CD8 héritent d’un matériel moléculaire disparate : la cellule fille recueillant les molécules concentrées au pôle proximal de la synapse immunologique (TCR, CD8 et LFA-1) se différencie en cellule T effectrice, tandis que celle qui reçoit les molécules ségrégées au pôle distal (PKCζ) devient plutôt une cellule T mémoire.
L’observation majeure rapportée par Chang et al. est donc la description de la division asymétrique des lymphocytes T. À ce stade, il n’y a pas encore de preuve directe que les 2 populations CD8hi et CD8lo caractérisées 48h après l’infection dérivent réellement de la même cellule T qui subissait une mitose asymétrique. En effet, à ce jour, les techniques disponibles ne permettent pas d’isoler les cellules filles montrant à 32h une répartition inégale de PKCζ et du TCR et de suivre le devenir de ces cellules individuelles dans le temps.
Les 2 populations de cellules T CD8hi et CD8lo diffèrent par leur taille et leur granulosité, des modifications morphologiques observées lors de la différenciation des cellules T naïves en cellules T activées blastiques et qui s’accompagnent de l’augmentation de certains récepteurs à la surface. Dans le modèle utilisé par les auteurs, on ne peut exclure une réponse non synchronisée des cellules T transférées : les cellules T ayant rencontré l’Ag précocement seraient alors activées et blastiques ; tandis que les cellules T ayant été stimulées à un temps plus tardif seraient en cours d’activation/différenciation et n’auraient pas encore subi le changement métabolique et morphologique conduisant à la blastogenèse. Selon cette hypothèse, la différence d’expression du co-récepteur CD8 reflèterait plutôt 2 stades distincts du processus de différenciation des lymphocytes T. Malgré cette restriction, les données de Chang et al. montrent clairement que ces 2 populations CD8hi et CD8lo génèrent in vivo respectivement, des cellules T effectrices et mémoires.
La génération de divers types cellulaires via un processus de division asymétrique qui sépare inégalement les déterminants cellulaires est un mécanisme conservé dans l’évolution, depuis Caenorhabditis elegans et Drosophila melanogaster [ 8, 9] jusqu’aux vertébrés. Elle pourrait, entre autres, être à l’origine de la grande plasticité des réponses des cellules du système immunitaire.